第一节 元素周期表 核素
- 格式:docx
- 大小:60.58 KB
- 文档页数:7



第2课时元素周期表核素[核心素养发展目标] 1.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的相互推导,提升微观探析能力。
2.了解元素周期表的发展历程及现行元素周期表的结构,培养严谨、求实的科学态度。
3.知道元素、核素、同位素、A Z X的含义,并能比较它们的不同,促进“宏观辨识与微观探析”化学核心素养的发展。
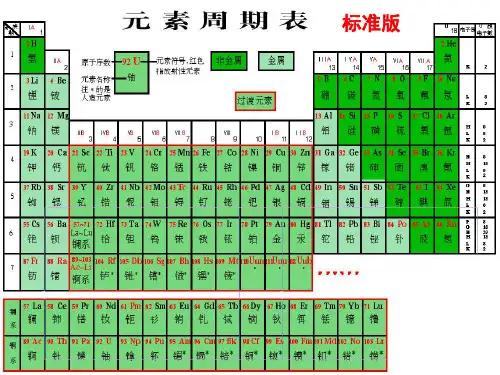
一、元素周期表的编排原则与结构1.元素周期表的发展历程2.元素周期表的编排原则(1)原子序数:按照元素在周期表中的顺序给元素编的序号。
(2)原子序数=核电荷数=质子数=核外电子数。
(3)横行原则:把电子层数目相同的元素,按原子序数递增的顺序从左到右排列。
(4)纵列原则:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排列。
3.元素周期表的结构(1)周期(2)族个数元素周期表中有18个纵列,共有16个族特点主族元素的族序数=最外层电子数分类主族共有7个,包括第ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA族副族共有7个,包括第ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB族Ⅷ族包括第8、9、10三个纵列0族占据元素周期表的第18纵列,最外层电子数为8(He为2)(3)常见族的别称族别名第ⅠA族(除氢外)碱金属元素第ⅦA族卤族元素0族稀有气体元素4.元素周期表方格中的符号的意义(1)一个横行即是一个周期,一个纵列即是一个族()(2)每一周期都是碱金属元素开始,稀有气体元素结束()(3)同周期中元素电子层数一定相同()(4)同族元素的最外层电子数一定等于族序数()(5)0族元素的最外层电子数均为8()(6)元素周期表已发展成一个稳定的形式,它不可能再有新的变化了()答案(1)×(2)×(3)√(4)×(5)×(6)×1.最外层电子数是2的元素一定为第ⅡA族的元素吗?提示不一定,可能是第ⅡA族,也可能是0族或副族元素。



第2课时元素周期表核素[核心素养发展目标] 1.通过了解元素周期表的结构(周期、族),认识原子结构与元素周期表中位置间的关系,培养“宏观辨识与证据推理”的核心素养。
2.通过了解核素的含义及符号和元素、核素、同位素的内含与外延,培养“宏观辨识与微观探析”的核心素养。
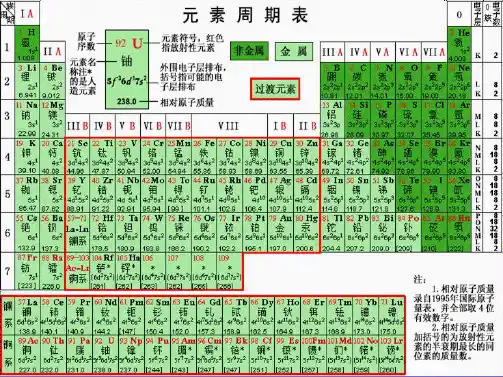
一、元素周期表的编排原则与结构1.原子序数(1)含义:按照元素在________________________给元素编号。
(2)原子序数与元素的原子结构之间存在的关系:原子序数=核电荷数=________=________________。
2.元素周期表的结构(1)编排原则(2)元素周期表的结构①周期的划分思考1在现行周期表中第四、五、六、七周期均有18列,为什么第四、五周期各有18种元素,而第六、七周期各有32种元素?②族的分类思考2在周期表中第Ⅷ族元素包含8、9、10三个纵列,而其他族只有一个纵列,故第Ⅷ族元素种类最多,这种判断对吗?③常见族的别称族别称第ⅠA族(除________外) ________元素第ⅦA族________元素0族稀有气体元素(3)元素周期表中方格里的符号的意义思考3同周期的第ⅡA、ⅢA族元素的原子序数差一定为“1”吗?1.判断正误(1)元素周期表中每一横行称为一周期,每一纵列称为一个族()(2)氧元素位于第二周期第Ⅵ族()(3)元素周期表中8、9、10纵列称为第ⅧB族()(4)第ⅠA族完全为金属元素()(5)最外层电子数是2的元素一定为第ⅡA族的元素()(6)同族元素的最外层电子数一定等于族序数()2.1869年,俄国化学家制出了第一张元素周期表,随着科学的发展,元素周期表的形式变得更加完美,关于现代元素周期表的说法正确的是()A.第ⅠA、ⅡA族的元素全部是金属元素,均能与酸发生反应生成氢气B.元素周期表中非金属元素都不位于副族C.现代元素周期表是按照相对原子质量的大小顺序对元素进行排列的D.0族元素中所有元素原子的最外层电子数都是8,化学性质稳定3.我国一直致力研究开发自己的芯片,制造芯片需要单晶硅,其中硅元素在元素周期表中的位置是()A.第二周期第ⅤA族B.第三周期第ⅥA族C.第三周期第ⅣA族D.第二周期第ⅣA族元素周期表的结构原子序数的定量关系①同周期,第ⅡA族元素与第ⅢA族元素原子序数差可能为1、11、25。
](https://uimg.taocdn.com/7954c4a4b14e852458fb57f2.webp)
第一章物质结构元素周期律第一节元素周期表第4课时核素教材分析核素的概念,对于学生进一步学习很重要:从分子→原子的内部结构,使学生对微观世界的认识产生了一个飞跃。
教学目标(一)知识与能力学生理解核素及同位素概念。
(二)过程与方法通过对构成原子微粒间的关系和氢元素核素等问题的探讨,培养学生分析处理能力,运用比较和归纳等方法。
(三)情感态度与价值观精心设计问题,培养学生的学习兴趣。
教学重点构成原子的粒子之间的关系和数目教学难点质量数、同位素、核素的概念。
教学过程预习探究(学生用)1.原子的质量主要集中在原子核上,质子和中子的相对原子质量都近似为1,如果忽略电子的质量,将核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
2.质量数(A)=质子数(Z)+中子数(N)。
3.元素是具有相同核电荷数(质子数)的同一类原子的总称。
4.核素:把具有一定数目质子和一定数目中子的一种原子。
5.同位素:质子数相同而中子数不同同一元素的不同原子互称。
6.“同位”指核素的质子数相同,在元素周期表中占有相同的位置。
7.天然存在同位素,相互间保持一定的比率。
元素的相对原子质量,就是按照该元素各种原子所占的一定百分比算出的平均值。
8.氢的同位素:氕( 1 1H H) 、氘( 2 1H D ) 、氚( 31H T )9.考古时利用14C 测定一些文物年代,2H 和3H 用于制造氢弹。
互动课堂(一)情景激思(教师用)【引入】同学们回一下阿伏加德罗常数的规定,C -12是什么含义?考古时利用C-14测定一些文物的年代,C -12和C -14有什么关系吗?元素周期表中有一百多种元素,是不是有一百多个原子呢?【教师强调】本节课的课标是:了解核素、同位素的概念。
【板书】三、核素【多媒体展示】原子结构AZ X 。
【问题1】根据多媒体的展示,指出A 、Z 代表的含义? 【学生思考回答】【教师总结】A 代表质量数,Z 代表质子数。


化学必修二 03号导学案第一章第一节元素周期表第3课时核素班级:组名:姓名:教师评价:X的含义。
【学习目标】 1、了解原子结构与同位素,懂得质量数和AZ2、具有把元素周期表的位置与元素组成微粒的结构初步联系起来并在一定条件下相互转化的运用能力。
3、认识事物变化过程中量变引起质变的规律性。
【自学检测】1、原子是由居于原子中心的带正电的和核外带负电的构成的。
原子核由和构成。
2、原子的质量主要集中在,质子和中子的相对质量都近似为如果忽略电子的质量,将核内所有叫做质量数。
3、质量数与质子数和中子数间的关系。
质量数(A)= +在化学上,我们为了方便地表示某一原子。
在元素符号的左下角表出其质子数,左上角标出质量数AX。
Z4、科学研究证明,同种元素原子的原子核中,中子数。
如组成氢元素的氢原子,就有以下三种:我们把原子叫核素。
[思考与探究]1111113、同位素的特点是什么?[反馈练习]1、若有某种新元素,它的原子核内有161个中子,质量数为272。
该元素的原子序数与原子核内中子数的关系是( )A. 大于B. 小于C. 等于D. 不能肯定23、11H、21H、31H、H+、H2是( )A.氢的五种同位素B.五种氢元素C.氢的五种核素D.氢元素的五种不同粒子4、在63Li、147N、2311Na、2412Mg、73Li、146C中:(1)和互为同位素。
(2)和质量数相等,但不能互称同位素。
(3)和的中子数相等,但质子数不相等,所以不是同一种元素。
5、放射性原子在人类生活中的很多地方有着特殊的作用,对人类的科学研究有很大的帮助,其中最主要的作用是作为示踪原子。
最近医学界通过用放射性14C的羧酸衍生物在特定条件下可通过断裂DNA来杀死细胞,从而抑制艾滋病。
(1)下面有关14C的叙述正确的是( )A.14C与14N含有相同的中子数B. 14C与C60互为同位素C. 14C与C60中普通碳原子的化学性质不同D. 14C与12C互为同位素(2)自然界中存在很多像14C的放射性原子,这些天然放射现象的发现说明了什么问题( )A.原子不可以再分B.原子的核式结构C.原子核还可以再分D.原子核是由质子和中子构成。
4.1.1原子结构元素周期表核素本课时是教材第四章第一节第一课时的内容,该课时包括两部分内容:原子结构和元素周期表。
首先是在初中学习原子结构的基础上,继续学习原子结构,尤其是深入理解原子的核外电子排布,了解质量数和同位素的基本概念。
其次是在学习原子核外电子排布的基础上,了解元素周期表的绘制原则,了解族和周期的概念。
在之前的学习中,学生已经知道了原子是由核外电子、质子和中子构成的,但是还没有质量数的概念,对于原子的核外电子排布也没有非常清晰的印象。
同时,学生在初中也了解了元素周期表的简单概念,但是不清楚元素周期表的编写原则,对于族和周期的分类也不是非常清晰。
通过本课时的学习,学生可以建立原子结构的简单模型,理解元素周期表尤其是短周期元素的编写方式,为今后元素周期律的学习打下坚实的基础。
宏观辨识与微观探析:从微观上理解原子核外电子排布的基本规律,明确宏观上的元素周期表与微观上的原子核外电子排布之间的关系,理解元素的排列规律。
证据推理与模型认知:建立原子结构的微观模型,理解门捷列夫利用已知元素的性质推理出元素周表的科学思想。
科学精神与社会责任:通过对元素周期表的学习,认识化学知识的规律性,理解化学知识从实验到理论,再由理论推测出实验结果的科学精神。
元素周期表的结构,元素周期表中元素的排列与原子核外电子排布的关系。
学生复习初中有关原子结构、元素周期表的知识,预习本课内容;教师准备多媒体课件。
【引入】在序言的学习中,我们知道门捷列夫绘制出第一张元素周期表是化学科学发展中一个重要的里程碑。
【投影】门捷列夫绘制元素周期表的视频。
【过渡】门捷列夫是根据什么对元素进行排列的呢?这就是我们今天这节课要学习的内容。
【板书】原子结构与元素周期表一、原子结构【投影】原子结构与元素周期表一、原子结构【学生活动】根据初中学习的关于原子结构的知识,请同学们描述一下原子的结构。
【讲解】初中化学中,我们学习了,原子是由原子核以及核外电子组成的,而原子核又由质子和中子构成。
绝密★启用前【原创精品】高中化学人教版 必修2 第一章 物质结构 元素周期律 第一节 元素周期表 核素试卷副标题注意事项:1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上第I 卷(选择题)请点击修改第I 卷的文字说明 一、单选题1.下列叙述正确的是( )。
A.40K 和40Ca 原子中的质子数和中子数都相等B.某元素原子最外层只有一个电子,则它一定是第ⅠA 族元素C.任何原子或离子的组成中都含有质子D.同位素的不同核素物理、化学性质完全相同 2.下列各组物质中,互为同位素的是( )。
A.重氢、超重氢 B.氧、臭氧 C.红磷、白磷 D.H 2O 、D 2O3.现有5种微粒,分别是XZQ +R 2+M,它们所属的元素种类是( )。
A.2 B.3 C.4 D.54.重水(D 2O)是重要的核工业原料,下列说法错误..的是( )。
A.氘(D)原子核外有1个电子 B.1H 与D 互为同位素 C.H 2O 与D 2O 互为同素异形体 D.1O 与O 的相对分子质量相同5.已知R 2+有b 个中子,核外有a 个电子,表示R 原子符号正确的是( )。
A .b R B .2a b R +- C .2a b R ++ D .a bR +○………※※订※※线○………6.已知自然界中氧的同位素有16O 、17O 、18O,氢的同位素有H 、D 、T,从水分子的原子组成来看,自然界中的水一共有( )。
A.9种 B.12种 C.18种 D.24种7.I 是常规核裂变产物之一,可以通过测定大气或水中I 的含量变化来检测核电站是否发生放射性物质泄漏。
下列有关I 的叙述中错误..的是( )。
A .I 的化学性质与I 相同 B .I 的原子序数为53 C .I 的原子核外电子数为78 D .I 的原子核内中子数多于质子数8.下列关于X 与X +两种粒子的叙述中正确的是( )。
A.质子数一定相等,电子数一定不同 B.化学性质几乎相同C.一定由质子、中子和电子构成D.核电荷数、核外电子数一定相同9.科学家第一次实现人工转变元素是从如下核反应开始的NHe OH,下列叙述正确的是( )。
A .O 原子核内有9个质子B .H 原子核内有1个中子 C.O 2和O 3互为同位素 D.14NH 3和O 具有相同的质子数10.2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注U 是一种重要的核燃料,其原子核内中子数为( )。
A.92 B.235 C.143 D.32711.与铂同族的贵金属钯(Pd)有多种核素。
下列关于Pd 、Pd 的说法正确的是( )。
A.中子数相同,化学性质不同 B.质子数相同,互为同位素 C.核外电子数不同,是同一种元素 D.质量数不同,性质完全相同12.核磁共振(NMR)技术已广泛用于复杂分子结构的测定和医学诊断等高科技领域。
已知只有质子数或中子数为奇数的原子核有NMR 现象。
试判断下列哪组原子均可以产生NMR 现象( )181924123127…订…………○………线…………○…___考号:__________…订…………○………线…………○…C .第ⅤA 族原子 D .第三周期原子13.简单原子的原子结构可用下图的表示方法来形象表示,其中表示质子或电子,表示中子。
则下列有关①②③的叙述中正确的是A .①、②、③互为同位素B .①、②、③互为同素异形体C .①、②、③是三种化学性质不同的粒子D .①、②、③具有相同的质量数 14.铋(Bi )在医药方面有重要应用。
下列关于Bi 和Bi 的说法正确的是A .Bi 和Bi 都含有83个中子B .Bi 和Bi 互为同位素C .Bi 和Bi 的核外电子数不同 D .Bi 和Bi 分别含有126和127个质子15.某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。
下列叙述中错误的是( ) A .它是副族元素 B .它是第六周期元素C .它的原子核内有63个质子D .它的一种同位素的核内有89个中子……………………○※※请※※不※※※在※※装※※……………………○第II卷(非选择题)请点击修改第II卷的文字说明二、填空题16.(1)H、D、T三种核素,它们之间的关系是 ;在标准状况下,它们形成的单质的密度之比是 ;1 mol各单质中所含的质子数之比是 ;在标准状况下,1 L各种单质中所含电子数之比是。
(2)核内中子数为N的R2+,质量数为A,则n g它的同价态氧化物中所含电子的物质的量为。
(3)含6.02×1023个中子的Li的质量是 ;4 g D2和20 g 18O2的单质化合时最多能生成 g O。
17.(1)A元素原子的核电荷数为8,其原子核内的质子数为___________,该元素原子的二价阴离子中,核外电子数为___________,中子数是9的核素表示为___________。
(2)B元素原子的一价阳离子的核外有18个电子,质量数为40,该元素原子的原子核内中子数为________。
(3)A、B形成型化合物的相对分子质量是___________。
18.科学研究表明,月球上有丰富的He资源,可开发利用作未来的新型能源。
(1) He的中子数是________,He与He互称为________。
(2)α粒子是带有2个单位正电荷、质量数为4的原子核,由此推断α粒子含有________个质子和________个中子。
(3)在He、He两种核素中,原子核内的中子数之差为________,与α粒子有相同质子数和中子数的是________。
三、计算题19.某元素的氯化物化学式为MCl2,现将11.1 g该氯化物溶于水配成溶液后,需用200 mL1 mol·L-1 AgNO3溶液才能把溶液中氯离子完全沉淀。
已知该M原子中有20个中子,则:(1)计算M的质量数并写出其原子组成符号。
(2)指出M元素在周期表中的位置(周期、族)。
参考答案1.C【解析】40K和40Ca原子中的质子数和中子数都不相等,只是质量数相等,A项错误;原子最外层只有一个电子的元素不一定是第ⅠA族元素,如Cu,B项错误;同位素的不同核素化学性质几乎完全相同,但物理性质不同,D项错误。
2.A【解析】B、C两项物质均为同素异形体。
3.B【解析】元素的种类由质子数决定,题中5种微粒共有3种不同的质子数,故B项正确。
4.C【解析】同种元素形成的不同单质称为该元素的同素异形体,H2O与D2O都是化合物,不能互称为同素异形体。
【答案】C【解析】R2+核外有a个电子,则其质子数为a+2,R2+有b个中子,其质量数为a+b+2,故R原子符号为22a bR a+++。
6.C【解析】水分子由2个氢原子和1个氧原子构成,自然界中的水有HD16O、HD17O、HD18O、HT16O、HT17O、HT18O、TD16O、TD17O、TD18O 、H216O、H217O、H218O、D216O、D217O、D218O、T216O、T217O、T218O,共计18种。
7.C【解析】I所含质子数为53,质量数为131,则所含中子数为131-53=78,其原子核外电子数为53,故C项错误。
8.A【解析】原子得失电子后形成离子,故原子和其对应的离子的3一定不等,A项正确,D项错误;原子和其对应的离子化学性质不同,B项错误;H+既无电子,又无中子,C项错误。
9.D【解析】O原子核内有9个中子、8个质子,A项错误H原子核内不含中子,B项错误;O2和O3是由同种元素组成的不同单质,属于同素异形体,C项错误;每个14NH3和O分子都含有10个电子和10个质子,D项正确。
10.C【解析】核素U的质子数为92,质量数为235,则其原子核内中子数为235-92=143。
11.B【解析】Pd和Pd质子数相同,核外电子数相同,中子数不同,属于同种元素,互为同位素,化学性质几乎完全相同,物理性质有所不同。
12.C【解析】略13.A【解析】①中含有1个质子和1个电子。
②中含有1个质子、1个电子和1个中子。
③中含有1个质子、1个电子和2个中子,所以三种微粒是氢元素的三种同位素,A正确。
14.B【解析】试题分析:A、根据原子表示,左下角为质子数,中子数=质量数-质子数,中子数分别是(209-83)=126、(210-83)=127,故错误;B、同位素:质子数相等,中子数不同同种元素不同核素,故正确;C、质子数等于核外电子数,质子数相等,因此核外电子数相同,故错误;D、质子数都是83,故错误。
考点:考查原子的表示、质子数、中子数、质量数之间的关系等知识。
15.D【解析】同种元素即同位素之间都必须满足有相同的质子数,所以核外电子数也是不变的,核外电子数是63,其质子数也为63,所以它是元素周期表中的63号元素铕,C选项本身正确;由63-2-8-8-18-18=9可以得出它在周期表的位置是第六周期的第九号元素纵列,即第六周期第三副族,所以A、B正确;152是元素的相对原子质量不是原子的质量数,不能用此算出中子数是多少,D项错误。
16.(1)互为同位素;1∶2∶3;1∶1∶1;1∶1∶1(2)(A-N+8) mol(3)1.75(或) g;22【解析】(1)H、D、T互为同位素,它们形成的单质分别为H2、D2、T2。
在标准状况下其密度之比等于摩尔质量之比1∶2∶3,H2、D2、T2所含质子数和电子数都为2。
(2)R的氧化物的化学式为RO,所含电子数为A-N+8,故n g该氧化物所含电子的物质的量为×(A-N+8)。
(3Li所含中子数为4,含6.02×1023个即1 mol中子的Li的物质的量是 mol,其质量为 g;4 g D2为1 mol,20 g 18O2为 mol,二者相互反应时18O2过量,D2完全反应,因此最多生成1 mol O,其质量为22 g。
17.(1)8 10 (2)21 (3)114【解析】(1)核电荷数=质子数,阴离子的核外电子数=质子数+所带电荷数=10,中子数是9的核素,质量数是17,可表示为。
(2)B元素质子数是18+1=19,质量数为40,该元素原子的中子数为40-19=21。
(3)两元素形成型化合物是K2O2,其相对分子质量是40×2+17×2=114。
18.(1)1 同位素 (2)2 2 (3)1 He【解析】(1)He表示质子数为2、质量数为3的一个氦原子,其中子数是3-2=1;He与He 互称为同位素。
(2)根据信息α粒子是一个原子核可知α粒子中不含电子,再由α粒子带有2个单位正电荷可知其含有2个质子,进而可以根据质量数为4的原子核推断出α粒子含有2个中子。