难点细致讲解专题七电解质溶液共124张
- 格式:pptx
- 大小:10.61 MB
- 文档页数:124

专题七电解质溶液【考纲点击】1.了解弱电解质在水溶液中存在电离平衡。
2.了解水的电离、离子积常数。
3.了解溶液pH的定义,能进行pH的简单计算。
4.了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
5.了解难溶电解质的溶解平衡。
了解溶度积的含义,能用平衡移动原理分析沉淀溶解、生成和转化过程。
【命题规律】水溶液中的离子平衡是化学平衡的延伸和应用,也是高考中考点分布较多的内容之一。
其中沉淀溶解平衡是新课标中新增的知识点,题型主要是选择题和填空题,其考查主要内容有:1电离平衡。
2酸、碱混合溶液酸碱性的判断及pH的简单计算。
3盐对水电离平衡的影响及盐溶液蒸干(或灼烧)后产物的判断。
4电解质溶液中离子浓度的大小比较。
5沉淀的溶解平衡及沉淀的转化。
从高考命题的变化趋势来看,溶液中离子浓度的大小比较及沉淀的溶解平衡和转化是主流试题。
此类题目考查的内容既与盐的水解有关,又与弱电解质的电离平衡有关。
题目不仅偏重考查粒子的浓度大小顺序,而且还侧重溶液中的各种守恒(电荷守恒、物料守恒、质子守恒)关系的考查,从而使题目具有一定的综合性、灵活性和技巧性。
【知识网络】【重点知识梳理】一、电解质1.强、弱电解质与物质分类的关系2.强、弱电解质与化学键的关系一般电解质的键型不同,电离程度就不同,已知典型的离子化合物,如强碱(NaOH、KOH等)、大部分盐类(如NaCl、CaCl2)以及强极性共价化合物(如HCl、H2SO4),在水分子作用下能够全部电离,我们称这种在水溶液中能够完全电离的物质为强电解质。
而含弱极性键的共价化合物如CH3COOH、NH3·H2O、H2O等,在水中仅部分电离,为弱电解质。
但是,仅从键型来区分强、弱电解质是不全面的,即使强极性共价化合物也有属于弱电解质的情况,如HF。
3.弱电解质的判断在中学化学电解质溶液这一知识点的学习中,常常需要根据一些性质对强弱电解质进行有关判断和分析,属于高考的热点。
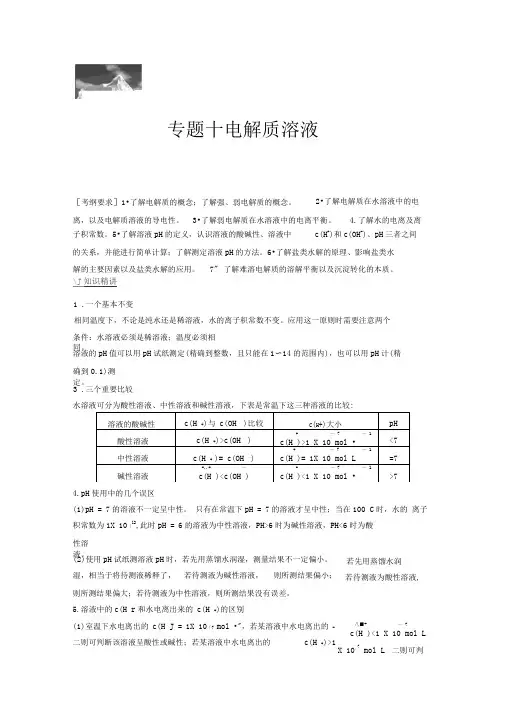
专题十电解质溶液2•了解电解质在水溶液中的电[考纲要求]1•了解电解质的概念;了解强、弱电解质的概念。
离,以及电解质溶液的导电性。
3•了解弱电解质在水溶液中的电离平衡。
4.了解水的电离及离子积常数。
5•了解溶液pH的定义,认识溶液的酸碱性、溶液中c(H+)和c(OH-)、pH三者之间的关系,并能进行简单计算;了解测定溶液pH的方法。
6•了解盐类水解的原理、影响盐类水解的主要因素以及盐类水解的应用。
7" 了解难溶电解质的溶解平衡以及沉淀转化的本质。
\J知识精讲1 .一个基本不变相同温度下,不论是纯水还是稀溶液,水的离子积常数不变。
应用这一原则时需要注意两个条件:水溶液必须是稀溶液;温度必须相同。
溶液的pH值可以用pH试纸测定(精确到整数,且只能在1〜14的范围内),也可以用pH计(精确到0.1)测定。
3 .三个重要比较溶液的酸碱性c(H +)与c(OH —)比较C(H+)大小pH酸性溶液c(H +)>c(OH —)+ —7 —1c(H )>1 X 10 mol •<7中性溶液c(H + )= c(OH —)+ —7 —1c(H )= 1X 10 mol L =7碱性溶液-..+ —c(H )<c(OH )+ —7 —1c(H )<1 X 10 mol •>7水溶液可分为酸性溶液、中性溶液和碱性溶液,下表是常温下这三种溶液的比较:4.pH使用中的几个误区(1)pH = 7的溶液不一定呈中性。
只有在常温下pH = 7的溶液才呈中性;当在100 C时,水的离子积常数为1X 10「12,此时pH = 6的溶液为中性溶液,PH>6时为碱性溶液,PH<6时为酸性溶液。
(2)使用pH试纸测溶液pH时,若先用蒸馏水润湿,测量结果不一定偏小。
湿,相当于将待测液稀释了,若待测液为碱性溶液,则所测结果偏小;若先用蒸馏水润若待测液为酸性溶液,则所测结果偏大;若待测液为中性溶液,则所测结果没有误差。

![专题七 难溶电解质的溶解平衡[可修改版ppt]](https://uimg.taocdn.com/2025e9475901020206409c49.webp)


七、电解质溶液(293题)一、选择题( 共92 题)1. 5 分(3611)H2S2O8可由电解法制取,阳极反应为:2H2SO4 →H2S2O8 + 2H+ + 2e-,阳极副反应为O2的析出。
阴极析氢效率为100%,已知电解产生H2,O2的气体体积分别为9.0 L和2.24 L (标准态下),则生成H2S2O8的物质的量为:()(A) 0.1 mol (B) 0.2 mol (C) 0.3 mol (D) 0.4 mol2. 2 分(3612)法拉第电解定律限用于:()(A) 液态电解质(B) 无机液态或固态电解质(C) 所有液态或固态电解质(D) 所有液态、固态导电物质3. 2 分(3613)将铅酸蓄电池在10.0 A电流下充电1.5 h,则PbSO4分解的质量为()(A) 84.8 g (B) 169.6 g(C) 339.2 g (D) 无法确定(已知M r(PbSO4) = 303)4. 2 分(3614)按物质导电方式的不同而提出的第二类导体,下述对它特点的描述,哪一点是不正确的?()(A)其电阻随温度的升高而增大(B)其电阻随温度的升高而减小(C)其导电的原因是离子的存在(D)当电流通过时在电极上有化学反应发生5. 2 分(3615)描述电极上通过的电量与已发生电极反应的物质的量之间的关系的是:()(A) 欧姆定律(B)离子独立运动定律(C) 法拉第定律(D)能斯特定律6. 2 分(3617)当一定的直流电通过一含有金属离子的电解质溶液时,在阴极上析出金属的量正比于:()(A) 阴极的表面积(B) 电解质溶液的浓度(C) 通过的电量(D) 电解质溶液的温度7. 2 分(3618)电解熔融NaCl时,用10 A的电流通电5 min,能产生多少金属钠?()(A) 0.715 g (B) 2.545 g (C) 23 g (D) 2.08 g8. 2 分(3619)下列物理量除哪一个外,均与粒子的阿伏加德罗数有关:()(A) 法拉第(B)标准状态下22.4 dm3气体(C) 摩尔(D)库仑9. 2 分(3620)在CuSO4溶液中用铂电极以0.1 A的电流通电10 min,在阴极上沉积的铜的质量是:()(A) 19.9 mg (B) 29.0 mg (C) 39.8 mg (D) 60.0 mg10. 2 分(3608)电解时,主要承担电量迁移任务的离子与首先在电极上发生反应的离子间有什么关系?()(A)没有任何关系(B)有某种关系(C)有无关系视相对电迁移率的大小而定(D)两者总是一致的11. 2 分(3610)已知Cu的相对原子量为64,用0.5法拉第电量可从CuSO4溶液中沉淀出多少Cu?()(A) 16 g (B) 32 g (C) 64 g (D) 127 g12. 2 分(3621)在NiI2的水溶液中,通过24 125 C的电量后,沉积出金属镍(M r=58.7)的质量最接近于:()(A) 7.3 g (B) 14.6 g (C) 29.2 g (D) 58.7 g13. 2 分(3622)电解硫酸铜溶液时,析出128 g铜(M r =64),需要通入多少电量?()(A) 96 500 C (B) 48 250 C (C) 386 000 C (D) 24 125 C14. 2 分(3623)1 mol电子电量与下列哪一个值相同?()(A) 1安培·秒(B) 1库仑(C) 1法拉第(D) 1居里15. 2 分(3624)使2000 A的电流通过一个铜电解器,在1 h 内,能得到铜的质量是:()(A) 10 g (B) 100 g (C) 500 g (D) 2 700 g16. 2 分(3625)用0.1 A的电流,从200 ml 浓度为0.1 mol·dm-3的AgNO3溶液中分离Ag,从溶液中分离出一半银所需时间为:()(A) 10 min (B) 16 min (C) 100 min (D) 160 min17. 2 分(3651)离子电迁移率的单位可以表示成( )(A) m·s-1(B) m·s-1·V-1(C) m2·s-1·V-1(D) s-118. 2 分(3652)z B、r B及c B分别是混合电解质溶液中B 种离子的电荷数、迁移速率及浓度,对影响B 离子迁移数(t B) 的下述说法哪个对? ()(A) │z B│愈大,t B愈大(B) │z B│、r B愈大,t B愈大(C) │z B│、r B、c B愈大,t B愈大(D) A、B、C 均未说完全19. 2 分(3653)水溶液中氢和氢氧根离子的电淌度特别大,究其原因,下述分析哪个对?()(A) 发生电子传导(B) 发生质子传导(C) 离子荷质比大(D) 离子水化半径小20. 1 分(3654)在一定温度和浓度的水溶液中,带相同电荷数的 Li +、Na +、K +、Rb +、… ,它们的离子半径依次增大,但其离子摩尔电导率恰也依次增大,这是由于: ( )(A) 离子淌度依次减小 (B) 离子的水化作用依次减弱(C) 离子的迁移数依次减小 (D) 电场强度的作用依次减弱21. 1 分 (3666)电解质溶液中离子迁移数 (t i ) 与离子淌度 (U i ) 成正比。



最新最全〔07和08〕电解质溶液解析及方法攻略某某鸡西市一中王维德《考点细要》①判断电解质和非电解质;②判断强电解质和弱电解质③电离方程式的书写④电解质强弱与导电性的强弱⑤电解质的电离条件⑥影响弱电解质的电离平衡的因素⑦弱电解质电离平衡移动方向的判定及平衡移动后溶液组分的变化⑧弱电解质电离常数的定义和应用高考要求:①了解电解质、非电解质;强电解质、弱电解质的概念;②了解电解质在水溶液中的电离以及电解质溶液的导电性;③了解弱电解质在水溶液中的平衡。
能力要求:①.理解电解质、非电解质;强电解质、弱电解质的概念的能力②理解弱电解质电离平衡移动方向的判定及平衡移动后溶液组分的变化的能力③.综合运用弱电解质知识解决实际问题的能力2、考点:离子反应考点细要:①离子反应的定义②离子方程式书写③离子反应发生的条件④离子方程式正误判断⑤离子共存判断高考要求:①理解离子反应的定义②掌握离子反应发生的条件③正确书写离子方程式④掌握离子方程式正误判断和离子共存能力要求:①理解离子反应的概念的能力②综合运用离子反应知识解决离子方程式、离子共存等问题的能力3、考点:说的电离〔水的离子积,水电离出的H+与OH-〕、溶液的酸碱性及有关pH计算的基本规律。
考点细要:①水的离子积②影响水的电离平衡的因素及移动方向③溶液的酸碱性的判断④pH与溶液的酸碱性⑤有关pH计算的基本规律高考要求:①理解水的电离及水的离子积②掌握影响水的电离平衡的因素及移动方向③掌握溶液的酸碱性的判断④了解有关pH计算的基本规律能力要求:①理解水的电离、影响水的电离平衡的因素及移动方向的能力②掌握水的离子积和pH计算的能力4、考点:中和滴定考点细要:①中和滴定的实质②中和滴定的仪器、操作步骤③中和滴定的误差分析④中和滴定指示剂的选择⑤中和滴定终点的判断高考要求:①理解中和滴定的实质②掌握中和滴定的仪器、操作步骤③掌握中和滴定的误差分析④了解中和滴定指示剂的选择⑤了解中和滴定终点的判断⑥运用中和滴定知识探究氧化还原滴定等能力要求:①理解中和滴定的实质的能力②形成一定的科学实验与探究的能力③信息迁移的能力5、考点:盐类水解考点细要:①盐类水解的实质②水解规律③影响水解平衡的因素和水解平衡的移动④各种水解方程式的书写⑤有关溶液中离子浓度的比较⑥盐类水解的应用⑦盐溶液及酸式盐溶液的酸碱性的判断高考要求:①理解盐类水解的实质②掌握盐类水解规律和特点③掌握影响水解平衡的因素和水解平衡的移动④掌握各种水解方程式的书写⑤掌握有关溶液中离子浓度的比较⑥了解盐类水解的应用⑦掌握盐溶液及酸式盐溶液的酸碱性的判断能力要求:①理解盐类水解的实质的能力②综合运用盐类水解知识解决实际问题的能力6、考点:溶解平衡考点细要:①溶解平衡实质②饱和溶液的特点③难溶盐的溶度积K SP④影响溶解度及溶度积K SP的因素及平衡移动方向⑤沉淀的生成及转化⑥有关溶解度及溶度积K SP的计算⑦溶液中离子是否沉淀及是否沉淀完全的判断高考要求:①理解溶解平衡实质②理解影响溶解度及溶度积K SP的因素及平衡移动方向③掌握沉淀的生成及转化④掌握有关溶解度及溶度积K SP的计算⑤掌握溶液中离子是否沉淀及是否沉淀完全的判断⑥了解饱和溶液及溶度积K SP的应用能力要求:①理解溶解平衡实质的能力②形成一定的科学实验与探究的能力③有关溶解度及溶度积K SP的计算能力④综合运用溶解度及溶度积K SP知识解决实际问题的能力[规律预测]:离子反应是历年高考热点之一,重点考查判断已书写的离子反应式的正误,离子是否大量共存,及根据题意书写离子反应方程式。

专题07 电解质溶液易错点1 混淆强、弱电解质的性质1.25℃时,关于某酸(用H2A表示)下列说法中,不正确的是A.pH=a的Na2A溶液中,由水电离产生的c(OH−)=10a−14B.将pH=a的H2A稀释为pH=a+1的过程中,c(H2A)/c(H+)减小,则H2A为弱酸C.测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸D.0.2 mol·L−1 H2A 溶液中的c(H+)=a,0.1 mol·L−1 H2A溶液中的c(H+)=b,若a<2b,则H2A为弱酸【错因分析】不能准确理解强、弱电解质的概念,掌握强、弱电解质常用的判断方法,容易出错。
【试题解析】A.若H2A为强酸,则Na2A为中性,pH=7,水电离产生的c(OH−)=10−7,若H2A为弱酸,则Na2A为碱性,pH=a的Na2A溶液中因A2−的水解促进水的电离,溶液中的OH−来源于水的电离,则由水电离产生的c(OH−)=10a−14,故A正确;B.若H2A为强酸,c(H2A)/c(H+)=0,若H2A为弱酸将pH=a的H2A稀释为pH=a+1的过程中,c(H2A)/c(H+)减小,故B正确;C.测NaHA溶液的pH,若pH>7,说明HA−在溶液中水解,则H2A是弱酸;若pH<7,H2A不一定是强酸,可能是HA−的电离大于HA−的水解,故C错误;D.若H2A为强酸,0.2 mol·L−1 H2A 溶液中的c(H+)=a=0.4mol·L−1,0.1 mol·L−1 H2A溶液中的c(H+)=b=0.2 mol·L−1,此时a=2b,现a<2b,则H2A为弱酸,故D正确;答案为C。
【参考答案】C强、弱电解质的判断方法(1)在相同浓度、相同温度下,比较导电能力的强弱。
如同体积等浓度的盐酸和醋酸,前者的导电能力强于后者。