备考高考化学二轮专题复习七电解质溶液ppt
- 格式:pptx
- 大小:2.21 MB
- 文档页数:114





高考化学二轮复习专题考点剖析—水溶液中的离子平衡必备知识解读一、弱电解质的电离(弱电解质:包括弱酸、弱碱、极少数盐(如醋酸铅)、两性氢氧化物、水等。
)1.电离度(1)概念在一定条件下的弱电解质达到电离平衡时,已经电离的电解质分子数占原电解质总分子数的分数。
(2)表示方法α=已电离的弱电解质分子数溶液中原有弱电解质的总分子数×100%也可表示为α=弱电解质的离子浓度弱电解质的浓度×100%(3)影响因素温度的影响升高温度,电离平衡向右移动,电离度增大;降低温度,电离平衡向左移动,电离度减小浓度的影响当弱电解质溶液浓度增大时,电离度减小;当弱电解质溶液浓度减小时,电离度增大2.电离常数(1)概念:电离平衡的常数叫做电离常数。
(2)表达式①对于一元弱酸HA :HAH ++A -,电离常数K a =c(H +)·c (A -)c(HA)。
②对于一元弱碱BOH :BOH B ++OH -,电离常数K b =c(B +)·c(OH -)c(BOH -)。
(3)特点多元弱酸各级电离常数的大小关系是K 1≫K 2≫K 3,故其酸性取决于第一步电离。
(4)影响因素内因:弱电解质本身的性质外因:电离常数只与温度有关,升高温度,K值增大。
(5)意义K越大―→越易电离―→酸碱性越强如相同条件下常见弱酸的酸性强弱:H2C2O4>H2SO3>H3PO4>HF>HCOOH>CH3COOH>H2CO3>H2S>HClO。
3.电离常数的四大应用①判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
②判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,酸性(或碱性)越弱。
③判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
④计算弱酸、弱碱溶液中的c(H+)、c(OH-)。
有关电离平衡常数的计算(以弱酸HX为例)已知c(HX)和电离平衡常数,求c(H+)。
HX H++X-起始:c(HX)00平衡:c(HX)-c(H+)c(H+)c(X-)则:K=c(H+)·c(X-)c(HX)-c(H+)=c2(H+)c(HX)-c(H+)由于c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX),则c(H+)=K·c(HX),代入数值求解即可。

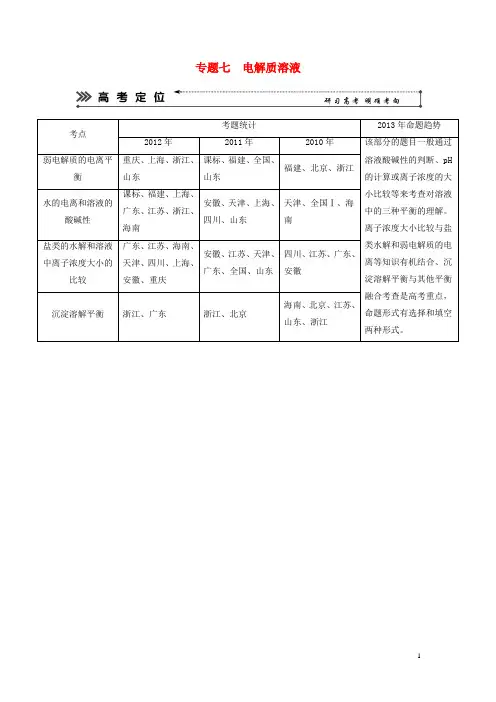
专题七电解质溶液考点考题统计2013年命题趋势2012年2011年2010年该部分的题目一般通过溶液酸碱性的判断、pH的计算或离子浓度的大小比较等来考查对溶液中的三种平衡的理解。
离子浓度大小比较与盐类水解和弱电解质的电离等知识有机结合、沉淀溶解平衡与其他平衡融合考查是高考重点,命题形式有选择和填空两种形式。
弱电解质的电离平衡重庆、上海、浙江、山东课标、福建、全国、山东福建、北京、浙江水的电离和溶液的酸碱性课标、福建、上海、广东、江苏、浙江、海南安徽、天津、上海、四川、山东天津、全国Ⅰ、海南盐类的水解和溶液中离子浓度大小的比较广东、江苏、海南、天津、四川、上海、安徽、重庆安徽、江苏、天津、广东、全国、山东四川、江苏、广东、安徽沉淀溶解平衡浙江、广东浙江、北京海南、北京、江苏、山东、浙江1.弱电解质的电离平衡。
2.水的电离与溶液的酸碱性。
3.盐类水解的实质、规律和应用。
4.溶度积与沉淀的溶解、生成和转化。
1.影响弱电解质电离平衡的因素?答案影响弱电解质电离平衡的因素:(1)浓度:浓度越大,电离程度越小;(2)温度:温度越高,电离程度越大;(3)同离子效应:加入含有与弱电解质电离出的离子相同的离子的盐,电离程度减小;(4)加入与弱电解质反应的物质,电离程度增大。
2.水的电离与溶液的酸碱性的关系?答案水的电离为H2O H++OH-,纯水中的c(H+)=c(OH-)。
当向溶液中加入酸抑制水的电离或加入可溶性强酸弱碱盐促进水的电离,此时溶液中c(H+)>c(OH-),溶液呈酸性;当向溶液中加入碱抑制水的电离或加入可溶性强碱弱酸盐促进水的电离,此时溶液中c(H +)<c(OH-),溶液呈碱性;纯水或向溶液中加入可溶性强酸强碱盐,此时溶液中c(H+)=c(OH -),溶液呈中性。
3.如何计算溶液的pH?答案在做关于溶液pH的计算题目时,要抓住“矛盾的主要方面”,溶液显酸性时用溶液中的c(H+)来计算溶液的pH;溶液显碱性时先求溶液中的c(OH-),再求溶液中的c(H+),然后计算溶液的pH。



第八单元电解质溶液一、电离平衡1.电解质与非电解质(1)概念电解质:在熔融状态或溶液状态下能导电的化合物非电解质:在熔融状态和溶液状态下都不能导电的化合物[讨论]1.如何用实验区分电解质与非电解质?2.金属Cu常用作导线,NH3的水溶液能导电,能否Cu 、NH3说明是电解质?3.总结金属导电与电解质导电的区别。
(2)电解质溶液的导电其实质是电解质溶液的电解过程,其导电能力的大小取决于离子浓度的大小。
[讨论] 1.如何区别离子化合物和共价化合物?2.在0.1mol/LBa(OH)2溶液中逐滴滴入0.1mol/LH2SO4溶液,溶液的导电能力将如何变化?试画出草图。
3.强电解质溶液的导电能力是否一定比弱电解质溶液强?2.强电解质与弱电解质(1)概念[讨论]如何用简单实验来证明醋酸是弱酸?①②③④……(2)电离与电离方程式[例1]写出下列物质在水中发生电离的方程式NaCl、HCl、CH3COOH、NH3·H2O、H2CO3、H3PO4、Al(OH)33.弱电解质的电离—电离平衡(1)电离平衡在一定条件下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态,称为电离平衡(2)影响电离平衡的因素①浓度同一弱电解质,通常是溶液越稀,电离程度越大②温度升高温度,电解质的电离程度增大③外加试剂的影响[例2]对于0.1mol/LCH3COOH溶液,采用何种措施,能使醋酸的电离程度减小而溶液的pH值增大的是A.加入一定体积的0.1mol/L的NaOH溶液B.加入等体积的水C.加入少量固体醋酸钠D.加热二、水的电离、溶液的pH值研究电解质溶液时往往涉及到溶液的酸碱性,而溶液的酸碱性与水的电离有着密切的联系。
1.水的电离、水的离子积(1)水是一个极弱的电解质。
存在极弱的电离:H2O H++OH- 或H2O+H2O H3O++OH-其特点是自身作用下发生的极微弱的电离,类似的还有:2NH3NH2-+NH4+(2)水的离子积在25℃时,纯水中的c(H+)=c(OH-)=10-7mol/L①K w= c(H+)·c(OH-)=10-14②水的离子积适用于所有稀的水溶液,而不论其是酸性、碱性或中性溶液③水的离子积随温度升高而增大[讨论]1.计算25℃时,纯水中平均多少个水分子中有1个水分子发生电离。
电解质溶液[考纲要求] 1.了解水的电离、离子积常数(K w)。
2.了解溶液pH的含义及其测定方法,能进行pH的简单计算。
3.理解弱电解质在水中的电离平衡,能利用电离平衡常数(K a、K b、K w)进行相关计算。
4.了解盐类水解的原理,影响盐类水解程度的主要因素,盐类水解的应用。
5.了解难溶电解质的沉淀溶解平衡。
理解溶度积(K sp)的含义,能进行相关的计算。
6.以上各部分知识的综合运用。
考点一溶液中的“三大”平衡电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡。
这三种平衡都遵循勒夏特列原理——如果改变影响化学平衡的条件之一,平衡向能够减弱这种改变的方向移动。
1.对比“四个”表格,正确理解影响因素(1)外界条件对醋酸电离平衡的影响CH3COOH CH3COO-+H+ΔH>0(2)外界条件对水的电离平衡的影响H2O H++OH-ΔH>0(3)外界条件对FeCl 3溶液水解平衡的影响 Fe 3++3H 2OFe(OH)3+3H +ΔH >0(4)外界条件对AgCl 溶解平衡的影响 AgCl(s)Ag +(aq)+Cl -(aq) ΔH >0[易错易混辨析](1)弱电解质的电离平衡和溶液的酸碱性。
加水稀释醋酸溶液,在稀释过程中,c (CH 3COO -)c (CH 3COOH )______(填“增大”“减小”或“不变”,下同),c(H+)·c(CH3COO-)c(CH3COOH)________,c(CH3COO-)c(CH3COOH)·c(OH-)________,c(CH3COOH)+c(CH3COO-)________________,n(CH3COOH)+n(CH3COO-)____________。
答案增大不变不变减小不变(2)试判断下列溶液在常温下的酸、碱性(在括号中填“酸性”“碱性”或“中性”)。
①相同浓度的HCl和NaOH溶液等体积混合( )②相同浓度的CH3COOH和NaOH溶液等体积混合( )③相同浓度的NH3·H2O和HCl溶液等体积混合( )④pH=2的HCl和pH=12的NaOH溶液等体积混合( )⑤pH=3的HCl和pH=10的NaOH溶液等体积混合( )⑥pH=3的HCl和pH=12的NaOH溶液等体积混合( )⑦pH=2的CH3COOH和pH=12的NaOH溶液等体积混合( )⑧pH=2的HCl和pH=12的NH3·H2O等体积混合( )答案①中性②碱性③酸性④中性⑤酸性⑥碱性⑦酸性⑧碱性2.pH的计算已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)则25℃时水的电离平衡曲线应为________(填“A”或“B”),请说明理由:_______________________。