应用噬菌体抗体库技术制备抗体
- 格式:doc
- 大小:16.00 KB
- 文档页数:3


2010.012010.01的目的基因克隆进表达载体(fuse phage),与噬菌体的外壳蛋白基因融合表达,使得一个噬菌体上含有一种序列的肽。
与有机合成法相比较,该方法有其独特的优越性:它可将特定分子的基因型和其表型统一在同一个病毒颗粒内,并且将选择能力和扩增能力联系在一起,即通过与配体的结合从数量众多的多样性群体中选择出表达有相应配体的噬菌体颗粒,再通过感染大肠杆菌使选择出的噬菌体颗粒得到扩增。
其不足在于肽库的容量及短肽的大小受到了限制,且只能表达L 型天然氨基酸形成的短肽。
3噬菌体肽库的筛选技术如何从噬菌体肽库中筛选到特异的重组噬菌体是肽库技术的关键。
经典的方法有两种:①将纯抗体包被在固相介质上,如酶标板、免疫试管或亲和层析柱,然后加入待筛选的噬菌体,洗去非亲和性的噬菌体,回收高亲和性的噬菌体;②将抗体与生物素基因相连,再将其固定在包被有Streptavidin 的磁珠上对噬菌体进行筛选。
3.1宿主菌直接洗脱经典筛选过程中,一般利用pH 的变化来洗脱与目标分子结合的噬菌体,这可能对噬菌体造成伤害。
利用噬菌体与宿主之间的亲和性可以直接用宿主菌来洗脱,以避免对筛选的影响,并且将洗脱和感染合并到一步[7]。
3.2双层膜筛选系统获得重组噬菌体蛋白的方法是将筛选出的特异噬菌体转入不含校正基因的菌株,将外源蛋白以可溶性蛋白的形式表达出来。
通过细胞膜间隙最终进入培养基质中。
针对这种情况,Skerra 等[8]建立了双层膜筛选系统。
第一层膜为亲水性多孔膜,这种膜对蛋白质的结合能力小,孔径能让蛋白质分子自由通过,但细胞不能通过;第二层膜为疏水膜,膜表面包被目标蛋白(抗原或抗体),两种膜分别覆盖在固体培养基上。
细胞在第一层膜上培养一段时间后,将这层膜转移到第二层膜上培养,分泌的可溶性蛋白透过第一层膜,与第二层膜上的目标蛋白结合,然后再用已知的抗原或抗体筛选。
这种方法避免了蛋白常遇到的细胞碎片的干扰,提高了筛选效率。

人源化单克隆抗体的构建技术摘要:单克隆抗体从问世到现在已广泛应用于临床,经历了一段曲折的发展历程。
其中人源化抗体是一个重要的里程碑,并伴随着一系列重大的技术革新,如PCR 技术、抗体库技术、转基因动物等。
抗体技术从最初的嵌合抗体、改型抗体逐渐发展为今天的人源化抗体。
本文综述了人源化单克隆抗体的构建技术。
关键词:人源化,单克隆抗体,构建从20世纪70年代英国学者Milstein和德国学者Kohler利用细胞融合技术首次成功地制备出单克隆抗体以来[1],单克隆抗体在医学、生物学、免疫学等诸多学科中发挥了巨大的作用。
单克隆抗体可用于分析抗原的细微结构及检验抗原抗体未知的结构关系,还可用于分离、纯化特定分子抗原,甚至用于临床疾病的诊断和治疗等。
然而,单克隆抗体技术在临床治疗应用中的进展却很慢,主要原因是目前单克隆抗体大多是鼠源性的,而鼠源性单克隆抗体应用于人体治疗时存在诸多问题:一是不能有效地激活人体中补体和Fc受体相关的效应系统;二是被人体免疫系统所识别,产生人抗鼠抗体(human antigen mouse antibody,HAMA);三是在人体循环系统中被很快清除掉。
因此,在保持对特异性抗原表位高亲和力的基础上进行人源化改造,减少异源抗体的免疫原性,成为单克隆抗体研究的重点[2]。
随着对抗体基因的研究和DNA分子重组技术的应用,通过基因改造获得特异性抗体成为可能。
1989年Huse等首次构建了抗体基因库,从而使抗体的研究从细胞水平进入到分子水平,并推动了第3代抗体—基因工程抗体技术的发展。
至此,抗体的产生技术经历了三个阶段:经典免疫方法产生的异源多克隆抗体;细胞工程产生的鼠源单克隆抗体及基因工程产生的人源单克隆抗体。
人源化抗体就是指抗体的可变区部分(即Vh和Vl区)或抗体全部由人类抗体基因所编码。
人源化抗体可以大大减少异源抗体对人类机体造成的免疫副反应。
人源化抗体的形式也从最初的嵌合抗体、改型抗体等逐步发展为今天的人源化抗体。


噬菌体抗体是指能够特异性识别和结合噬菌体的抗体。
噬菌体是一类可以感染细菌和病毒的微生物,它们通常具有一个由蛋白质外壳和内部基因组组成的结构。
噬菌体抗体的产生通常是由于人体免疫系统识别噬菌体表面的
抗原表位而引发的。
这些抗原表位可以是蛋白质、糖类或者其他化学物质,它们能够刺激免疫系统产生相应的抗体。
这些抗体可以与噬菌体表面的抗原表位结合,从而阻止噬菌体对细胞的感染。
噬菌体抗体在医学和生物学领域具有广泛的应用价值。
例如,可以利用噬菌体抗体来研究病毒的感染机制和病毒与宿主细胞之间的
相互作用。
此外,噬菌体抗体也可以用于治疗病毒感染和抗生素耐药感染。
在实践中,噬菌体抗体的制备通常需要使用动物模型或者体外实验方法。
例如,可以使用病毒蛋白或者噬菌体表面蛋白来免疫动物,以刺激动物产生相应的抗体。
然后,可以从动物的血清中提取出抗体,用于进一步的研究或治疗。
总之,噬菌体抗体是一种具有重要应用价值的抗体,它可以帮助我们更好地理解病毒的感染机制和病毒与宿主细胞之间的相互作用,同时也为治疗病毒感染和抗生素耐药感染提供了新的思路和方法。


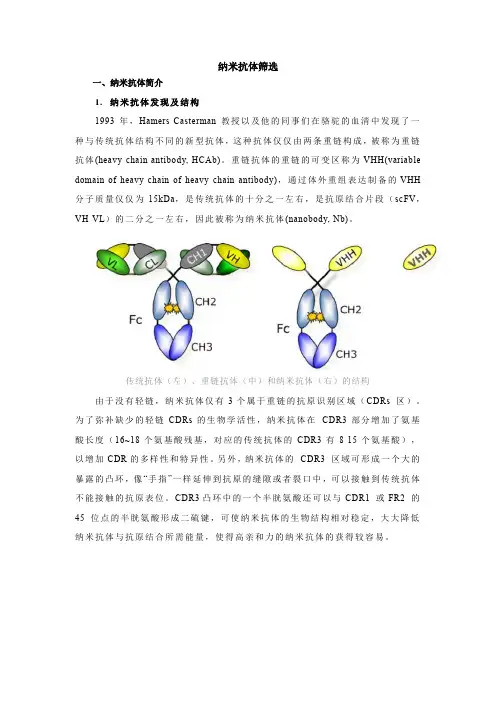
纳米抗体筛选一、纳米抗体简介1.纳米抗体发现及结构1993年,Hamers-Casterman教授以及他的同事们在骆驼的血清中发现了一种与传统抗体结构不同的新型抗体,这种抗体仅仅由两条重链构成,被称为重链抗体(heavy-chain antibody, HCAb)。
重链抗体的重链的可变区称为VHH(variable domain of heavy chain of heavy-chain antibody),通过体外重组表达制备的VHH 分子质量仅仅为15kDa,是传统抗体的十分之一左右,是抗原结合片段(scFV,VH-VL)的二分之一左右,因此被称为纳米抗体(nanobody, Nb)。
传统抗体(左)、重链抗体(中)和纳米抗体(右)的结构由于没有轻链,纳米抗体仅有3个属于重链的抗原识别区域(CDRs 区)。
为了弥补缺少的轻链CDRs的生物学活性,纳米抗体在CDR3部分增加了氨基酸长度(16~18个氨基酸残基,对应的传统抗体的CDR3有8-15个氨基酸),以增加CDR的多样性和特异性。
另外,纳米抗体的CDR3 区域可形成一个大的暴露的凸环,像“手指”一样延伸到抗原的缝隙或者裂口中,可以接触到传统抗体不能接触的抗原表位。
CDR3凸环中的一个半胱氨酸还可以与CDR1 或FR2 的45 位点的半胱氨酸形成二硫键,可使纳米抗体的生物结构相对稳定,大大降低纳米抗体与抗原结合所需能量,使得高亲和力的纳米抗体的获得较容易。
纳米抗体和VH结构示意图2.纳米抗体优势(1)纳米抗体理化特性较稳定(2)纳米抗体的大规模生产较容易实现(3)纳米抗体免疫原性低(4)纳米抗体分子量小,组织渗透能力强,血液清除较快(5)纳米抗体可以识别传统抗体不能识别的位点(6)纳米抗体具备形成多聚体的能力3.纳米抗体筛选纳米抗体筛选和制备纳米抗体的获得现在普遍通过免疫羊驼,从羊驼体内自身的抗体成熟阶段来得到抗体基因,然后通过噬菌体展示筛选技术来从羊驼抗体库中筛选得到高亲和力的抗体序列。

人源抗Peroxiredoxin Ⅰ肺腺癌噬菌体抗体的制备及鉴定罗弋;庞华;李淑杰;曹辉;李少林;樊春波;王洁【摘要】目的构建人源噬菌体抗体库,从中筛选出抗Peroxiredoxin Ⅰ(Prx Ⅰ)肺腺癌人源单链抗体.方法提取肺癌患者癌旁淋巴结组织,通过RT-PCR扩增出重链可变区基因(V_H)和轻链可变区基因(V_L),再经剪切-重叠-延伸PCR(SOE-PeR)将V_H和V_L连接得剑单链抗体(ScFv);将双酶切后的ScFv基因片段克隆入噬菌体表达载体pCANTAB5E,得到初级噬菌体抗体库.PCR检测TG1中ScFv基因插入率;1%琼脂糖凝胶电泳鉴定SfiⅠ和NotⅠ双酶切质粒的结果;以肺腺癌细胞株D549及在肺癌中高表达的抗氧化蛋白PrxⅠ为靶抗原对抗体库进行筛选富集.将阳性克隆用IPTG诱导表达.用SDS-PAGE及Western blotting鉴定该抗体;用ELISA法、免疫细胞化学法鉴定该抗体与人肺腺癌细胞的结合特异性.结果成功构建噬菌体单链抗体库.ScFv基因插入率为77%,双酶切鉴定检测到目的条带.在亲和筛选过程中,肺癌单链抗体得到富集.收获率逐轮提高,第6轮为第1轮的180倍.随机选取10个克隆,通过ELISA法检测剑其中6个与A549细胞呈阳性反应,阳性率为60%.SDS-PAGE及Western blotting证实抗体得到可溶表达.ELISA及免疫细胞化学检测表明抗体能相对特异地与肺腺癌细胞结合.结论成功构建肺腺癌人源噬菌体抗体库,并从中筛选得到能相对特异地与高表达Prx Ⅰ的肺腺癌细胞D549结合的单链抗体.【期刊名称】《南方医科大学学报》【年(卷),期】2010(030)001【总页数】5页(P30-34)【关键词】噬菌体抗体库;单链抗体;Peroxiredoxin Ⅰ;肺腺癌【作者】罗弋;庞华;李淑杰;曹辉;李少林;樊春波;王洁【作者单位】重庆医科大学,放射医学教研室,重庆400016;重庆医科大学,附属第一医院核医学科,重庆400016;重庆医科大学,放射医学教研室,重庆400016;重庆医科大学,放射医学教研室,重庆400016;重庆医科大学,放射医学教研室,重庆400016;重庆医科大学,放射医学教研室,重庆400016;重庆医科大学,附属第一医院核医学科,重庆400016【正文语种】中文【中图分类】Q78肺癌是严重威胁人类健康的疾病。

噬菌体的应用和原理引言噬菌体是一种寄生于细菌体内并以细菌为宿主的病毒,这种病毒能够感染特定类型的细菌并利用其细胞机制进行繁殖。
噬菌体不仅对细菌的研究有重要意义,而且在基因工程、抗菌治疗等领域具有潜在的应用前景。
本文将介绍噬菌体的应用和原理。
噬菌体的特点•结构简单:噬菌体由蛋白质壳和DNA/RNA组成,通常呈现棒状或类似陀螺的形状。
噬菌体的大小和形状因种类而异。
•寄生性:噬菌体不能自主繁殖,需要依靠细菌的细胞机制进行复制。
•高度专一性:不同种类的噬菌体对不同种类的细菌具有高度专一性,只能感染特定的细菌种类。
噬菌体的应用基因工程研究噬菌体在基因工程研究中发挥重要作用,尤其是噬菌体生物展示系统。
这种系统通过将目标蛋白质基因插入噬菌体基因组中,使得噬菌体在感染细菌时能够在细菌表面展示目标蛋白质。
这一系统可以用于研究蛋白质结构、功能、相互作用等。
此外,噬菌体展示系统还可以用于制备重组蛋白质,例如制备抗体和蛋白质药物。
抗菌治疗噬菌体在抗菌治疗方面具有潜在的应用前景。
由于噬菌体对细菌具有高度专一性,能够选择性地感染并杀死目标细菌,因此被认为是一种潜在的替代抗生素的疗法。
噬菌体治疗对于多药耐药菌的治疗尤为重要,因为噬菌体可以通过感染和杀死这些耐药菌来解决抗生素耐药问题。
食品安全噬菌体还可以应用于食品安全领域。
食品中可能存在细菌污染,这些细菌有时会引发食品中毒事件。
通过使用噬菌体,在食品生产过程中可以对细菌进行灭菌,从而提高食品的安全性。
噬菌体的高度专一性保证了不会对其他有益菌种造成伤害,从而在不影响食品质量的情况下确保了食品安全。
噬菌体的原理吸附与侵染噬菌体通过尾纤毛等结构物与细菌表面的受体结合,从而实现对细菌的吸附。
随后,噬菌体释放其基因组,使其进入细菌细胞内。
噬菌体的基因组会利用宿主细菌的细胞机制进行复制,最终导致细菌的溶解和噬菌体的释放。
寄生与复制噬菌体寄生细菌是通过利用细菌的细胞机制进行复制的。
噬菌体基因组会利用细菌的酶和蛋白质合成机制,合成新的噬菌体DNA和蛋白质。

抗体库筛选技术介绍导读自从噬菌体展示技术于1985年创立以来,细胞生物学、免疫学、蛋白质工程以及医药行业等领域深受影响。
它从根本上了改变了传统的单抗制备流程(杂交瘤技间接术),宣告在体外改良抗体的特异性以及进行亲和力成熟。
随着该技术的不断发展,继而出现了核糖体展示、mRNA展示、细菌展示和酵母展示等多种展示技术。
这篇文章主要以噬菌体展示抗体库为例,来介绍抗体库的筛选技术。
抗体库的筛选是指从抗体库中筛选出针对某一抗原的特异性抗体,是获得高亲和力抗体过程中的关键环节。
那什么是抗体库呢?通过PCR和DNA重组技术克隆人类或者动物体内全套抗体可变区基因(关于抗体的具体结构详见抗体的基本结构),并通过展示技术进行表达,得到的全套抗体基因表达文库即为抗体库。
图1、抗体库克隆的抗体基因片段(SCFV)图2、噬菌体展示抗体库构建流程由于单抗性质的千差万别,抗体库的筛选需要根据不同的单抗制定严格的筛选条件,优化筛选方法,因此抗体库的筛选技术一直处于发展和改进的状态,根据出现时间的先后,主要分为经典筛选法和新型筛选法。
1、经典筛选法经典筛选法主要包括固相筛选法和液相筛选法,适合针对性质明确并且可纯化的抗原进行抗体筛选。
固相筛选法是通过包被在酶标板或者免疫试管等固相介质上的抗原富集高亲和性的噬菌体;液相筛选法是将生物素化的抗原包被在与亲和素偶联的磁珠或琼脂糖上,通过磁珠富集能与抗原特异性结合的噬菌体抗体,再通过洗涤、洗脱、回收等步骤。
如此反复筛选数次,可得到高亲和性的噬菌体。
这两种方法可通过添加脱脂牛奶或者BSA来减少非特异性结合。
2、新型筛选法对于抗原无法提纯或者性质不明确的情况(如癌细胞表面受体),或者经典筛选过程可能造成抗原失活的情况,需要开发新的筛选方法。
目前的新型筛选法主要有细胞筛选法、组织切片或体内筛选法、选择感染筛选法和蛋白质芯片筛选法等。
细胞筛选法:细胞筛选能维持抗原和抗体的天然构象,因此在对肿瘤细胞筛选方面应用较多,该技术还适合于细胞表面受体筛选和抗原鉴定等。
抗体药物的研究现状和发展趋势一、研究现状1.抗体研究发展历程抗体作为药物用于人类疾病的治疗拥有很长历史.但整个抗体药物的发展却并非一帆风顺,而是在曲折中前进。
第一代抗体药物源于动物多价抗血清,主要用于一些细菌感染性疾病的早期被动免疫治疗。
虽然具有一定的疗效,但异源性蛋白引起的较强的人体免疫反应限制了这类药物的应用,因而逐渐被抗生素类药物所代替. 第二代抗体药物是利用杂交瘤技术制备的单克隆抗体及其衍生物。
单克隆抗体由于具有良好的均一性和高度的特异性,因而在实验研究和疾病诊断中得到了广泛应用.单抗最早被用于疾病治疗是在1982年,美国斯坦福医学中心Levy等人利用制备的抗独特型单抗治疗B细胞淋巴瘤,治疗后患者病情缓解,瘤体消失,这使人们对抗体药物产生了极大的期望.1986年,美国FDA批准了世界上第一个单抗治疗性药物——抗CD3单抗OKT3进入市场,用于器官移植时的抗排斥反应.此时抗体药物的研制和应用达到了顶点。
随着使用单抗进行治疗的病例数的增加,鼠单抗用于人体的毒副作用也越来越明显。
同时一些抗肿瘤单抗未显示出理想效果。
人们的热情开始下降。
到20世纪90年代初,抗内毒素单抗用于治疗脓毒败血症失败使得抗体药物的研究进入低谷。
由于大多数单抗均为鼠源性,在人体内反复应用会引起人抗鼠抗体(HAMA)反应,从而降低疗效,甚至可引起过敏反应。
因此,一方面在给药途径上改进,如使用片段抗体、交联同位素、局部用药等使鼠源性抗体用量减少,也增强了疗效;另一方面,积极发展基因工程抗体和人源抗体。
近年来,随着免疫学和分子生物学技术的发展以及抗体基因结构的阐明,DNA 重组技术开始用于抗体的改造,人们可以根据需要对以往的鼠抗体进行相应的改造以消除抗体应用不利性状或增加新的生物学功能,还可用新的技术重新制备各种形式的重组抗体。
抗体药物的研发进入了第三代,即基因工程抗体时代.与第二代单抗相比,基因工程抗体具有如下优点:①通过基因工程技术的改造,可以降低甚至消除人体对抗体的排斥反应;②基因工程抗体的分子量较小,可以部分降低抗体的鼠源性,更有利于穿透血管壁,进入病灶的核心部位;③根据治疗的需要,制备新型抗体;④可以采用原核细胞、真核细胞和植物等多种表达形式,大量表达抗体分子,大大降低了生产成本。
抗呼吸道合胞病毒免疫噬菌体抗体库的构建及初步鉴定(作者:___________单位: ___________邮编: ___________)作者:汪治华, 张国成*, 许东亮, 孙新, 李小青, 李思袖, 张学红, 聂晓晶, 豆玉凤【摘要】目的: 构建小儿呼吸道合胞病毒感染患者人源性噬菌体抗体库, 搭建人源性抗体制备的技术平台, 为小儿呼吸道合胞病毒感染发病机制的研究、诊断、治疗和预防提供新的有效途径。
方法: 从52例呼吸道合胞病毒感染患儿外周血淋巴细胞中提取总RNA, 并逆转录为cDNA。
用PCR扩增轻链和重链Fd段(即重链的可变区和第一恒定区)基因, 并将扩增的轻链和重链基因片段克隆于pComb3x噬粒载体, 电转化XL1Blue大肠杆菌, 经辅助噬菌体M13K07超感染后构建成Fab段噬菌体抗体库。
对此抗体库双酶切进行鉴定, 并用呼吸道合胞病毒颗粒作抗原进行初步筛选。
结果: 经过重轻链基因的重组, 成功构建一免疫噬菌体抗体基因库, 共有2.6×106个不同的克隆菌, 其中70%的克隆均含有轻链和重链Fd 基因。
因此, 所构建的噬菌体抗体库的库容量为1.8×106, 经初步筛选, 抗体库得到了不同程度的富集。
结论: 利用基因重组技术和噬菌体展示技术, 成功构建小儿呼吸道合胞病毒感染患者人源性免疫噬菌体抗体库, 为进一步的研究奠定了基础。
【关键词】抗体库; 噬菌体展示技术; Fab抗体; 呼吸道合胞病毒; 儿童随着分子生物学的发展, 基因工程抗体技术的出现, 尤其是噬菌体抗体库技术, 为各种不同免疫原人源性抗体的制备提供了新途径, 成为抗体工程领域革命性的进展[1]。
我们以52例呼吸道合胞病毒感染患儿外周血淋巴细胞作为基因来源, 成功地构建了一个人源性Fab段免疫噬菌体抗体库, 并对其进行了初步鉴定, 为研制诊断、治疗和预防小儿呼吸道病毒感染的基因工程药物奠定了基础, 同时也将解决鼠源性抗体在临床应用中存在的不足。
应用噬菌体抗体库技术制备抗体
摘要:噬茵体抗体库技术是利用PCR扩增出抗体的全套可变区基因,将抗体分子
DNA片断如Fab或单链抗体(scFv)与噬茼体外壳蛋白基因PⅢ或PVI]I连接,使融合
蛋白表达于噬茵体颗粒的表面,经过“吸附一洗脱一扩增”过程富集筛选特异性
抗体.。这一技术将抗体基因型和表型联系在一起,使识剐抗原的能力和噬茵体
的可扩增性统一起来,较好的模拟了体内的抗体产生的过程,成为一种高效的筛
选体系。噬菌体抗体库是近年发展起来的一项分子生物学新技术。构建容量大、
特异性高和敏感性强的人源性抗体是此项技术的核心,也是其远大前景的基础.
本文就噬茵体抗体库技术的原理、构建、筛选做一综述。
关键词:噬茵体抗体库技术;抗体库;噬茵体
噬菌体抗体库技术(phage display antibody li—brary techniques)是指
用聚合酶链反应(polymerasechain reaction,PCR)扩增抗体的全套可变区基因,
通过噬菌体表面展示技术,把Fab段或单链抗体(ScFv)表达在噬菌体的表面,经
过“吸附一洗脱一扩增”过程筛选并富集特异性抗体。20世纪80年代中期,Smith
在前人对丝状噬菌体分子生物学研究的基础上首先提出了噬菌体展示技术。由于
该技术具有生产人抗体的潜力,因此,吸引了许多学者投入这一研究中,使得噬
菌体抗体库技术得以迅速发展,并由此开创了一条简便、快速的基因工程抗体生
产路线.
1 噬菌体抗体库技术的基本原理
噬菌体抗体库技术的原理是将抗体重链可变区(VH)和轻链可变区(VL)基因
与噬菌体的外壳蛋白Ill(PIl1)或外壳蛋白Ⅷ(PⅧ)基因随机重组,继而感染大肠
杆菌,经增殖并在噬菌体表面以抗体片段Fab或ScFv一外壳蛋白融合蛋白的形式
表达。这种噬菌体颗粒可以特异识别抗原,又能感染宿主菌进行再扩增,经过“吸
附一洗脱一扩增”过程就能筛选并富集特异性抗体。所构建的抗体库称为全套抗
体库,从中筛选到的抗体称为噬菌体抗体。它的最大特点是实现了直接将基因型
和表型联系在一起,可以快速而高效地从大量克隆中筛选出表达特异性抗体。
2 噬菌体抗体库的构建
噬菌体抗体库按抗体基因的性质分为DNA文库和cDNA 文库,按抗体基因的来
源分天然抗体库、免疫抗体库、半合成抗体库和全合成抗体库等。免疫球蛋白基
因可来源于杂交瘤细胞、体外免疫的细胞、致敏及非致敏的B淋巴细胞(骨髓、外
周血、病灶局部引流淋巴结、扁桃体或经过免疫的小鼠脾脏等),其中以淋巴结
的B淋巴细胞较好。建库的大致过程是:首先提取细胞的总RNA,经过RT—PCR扩
增可变区基因,运用两种不同的限制性内切酶分别对纯化的轻链PCR产物和表达
载体进行酶切,再对切割产物进行分离纯化,按一定比例将载体和轻链连接,转
化感受态细胞并扩大培养,提取质粒即为轻链库。再对重链PCR产物和轻链库进
行双酶切,纯化后按一定比例连接、转化感受态细胞并扩大培养,提取质粒既为
轻链库。再对重链PCR产物和轻链库进行双酶切,纯化后按一定比例连接、转化
感受态细胞,加入辅助噬菌体培养,离心取上清,加入聚乙二醇(PEG)沉淀并收
集噬菌体颗粒,这样就得到噬菌体总抗体库。
3 噬菌体抗体库的表达载体和筛选
噬菌体抗体库的表达载体可分为入噬菌体(phage入)、单链丝状噬菌体
(filamentous phage)及噬菌粒(phagemid)三种系统,这三种系统各有其利弊。
入噬菌体表达系统可通过菌斑印迹(plaque lift)筛选克隆,但外源性片段不能
太大,其库容量较小(106)。丝状噬菌体主要为Winter实验室所采用,目前已构
建了fd CAT1及fd D()Gl,并已制备ScFv;在此载体中又包括单价及多价两个子
系统,可筛选出高亲和力抗体。噬菌粒是应用最多的表达载体,也是简便高效模
拟B细胞产生抗体的原核表达系统。建抗体库的目的是筛选出各种特异性的抗体
分子,噬菌体抗体库在这方面有无可比拟的优势。经典的筛选方法有两种:一是
将纯抗体包被在固相介质上,如酶标板、免疫试管或亲和层析柱,然后加入待筛
选的噬菌体,洗去非亲和性的噬菌体,回收高亲和性的噬菌体;二是将抗体与生
物素基团相连,再将其固定在包被有链霉蛋白抗生素的顺磁珠上对噬菌体进行筛
选。在筛选过程中,噬菌体种类、固相介质表面的抗原密度或溶液中抗原的浓度
和清洗时间三种因素对筛选的效率影响较大。同时,每一轮筛选都需要进行检测,
以证实筛选的有效性。
4 噬菌体抗体库技术的优点
①方法简单易行,节省时间,可通过发酵生产来大量制备;②筛选容量增大,
可在数周内筛选100万~ 1亿个克隆,可获得高亲和力的人源化抗体;③ 直接从
未经免疫的人或小鼠的淋巴细胞中得到抗体基因,因此可以获得完全人源化的抗
体,克服了杂交瘤细胞不稳定的缺点,避开了人工免疫和杂交瘤技术;④模拟体
内免疫过程和天然全套抗体库,随意“制造”和克隆针对任何抗原的抗体。
5 结语
不可否认,噬菌体抗体库技术已显示强劲的发展势头,它的价值不仅仅在于
抗体的制备,其强大的筛选能力已广泛地应用到免疫学、细胞生物学、药理学、
蛋白质工程等诸多领域。后基因组时代的到来,就是研究蛋白质的结构、功能及
其相互作用,噬菌体抗体库技术能提供此项技术平台。但人们需要进一步解决的
问题是构建库容大、多样性好的抗体库,长时间保存抗体库使其库容和多样性不
下降和新筛选方法的建立。相信随着此项技术的不断完善,将会有一个广阔的诱
人前景.