六、脲酶米氏常数简易测定2010(精)
- 格式:ppt
- 大小:217.00 KB
- 文档页数:17

简便法测定脲酶含量
简便法测定脲酶含量通常使用间接法,即测定尿液中尿素的产生量。
具体方法如下:
材料:碱性磷酸盐缓冲液、尿液样品、脲酶试剂(含间苯二酚)、少量尿素。
步骤:
1. 准备样品:取适量的尿液样品。
2. 离心:将尿液样品离心,以去除杂质。
3. 反应液的制备:在试管中加入适量的碱性磷酸盐缓冲液和脲酶试剂。
4. 反应液的预热:将试管置于恒温水浴中,预热至适当的温度。
5. 打断反应:将预热的反应液加入样品中,迅速混合,打断反应。
6. 倍化尿素:将适量的尿素加入反应液中,促使脲酶的活性增加。
7. 反应时间:将试管放置在恒温水浴中反应一定时间。
8. 终止反应:加入酸性溶液,终止反应。
9. 高速离心:将反应液离心,以去除沉淀。
10. 测定吸光度:取上清液,使用分光光度计测定吸光度。
11. 计算脲酶含量:根据吸光度测定结果,通过对照物质的标准曲线,计算脲酶含量。
需要注意的是,尽管这种方法相对简便,但仍需要一定的实验操作技巧和仪器设备,同时还需要对研究对象进行合适的前处理,以提高测定的准确性和可靠性。

一、实验目的1. 了解脲酶的基本性质及其催化反应原理。
2. 掌握脲酶活性测定的实验方法。
3. 通过实验验证脲酶活性受温度、pH值等因素的影响。
二、实验原理脲酶是一种水解脲的酶,可以将脲分解为氨和二氧化碳。
在酸性条件下,氨与苯酚反应生成蓝色络合物,通过测定蓝色络合物的吸光度,可以计算出脲酶的活性。
三、实验材料与仪器1. 实验材料:脲酶溶液、脲底物、苯酚、硫酸、NaOH、pH缓冲液、蒸馏水、移液器、试管、恒温水浴锅、紫外可见分光光度计等。
2. 实验仪器:移液器、试管、恒温水浴锅、紫外可见分光光度计等。
四、实验方法1. 配制脲酶溶液:取一定量的脲酶粉末,加入适量的蒸馏水溶解,配制成一定浓度的脲酶溶液。
2. 配制底物溶液:将脲底物与苯酚按照一定比例混合,加入适量的硫酸,配制成底物溶液。
3. 脲酶活性测定:a. 取一定量的脲酶溶液,加入底物溶液,混匀;b. 将混合液置于恒温水浴锅中,设定一定的温度;c. 在一定时间内,每隔一定时间取样,用紫外可见分光光度计测定吸光度;d. 根据吸光度计算脲酶活性。
五、实验结果与分析1. 温度对脲酶活性的影响:a. 在不同温度下(如25℃、30℃、35℃、40℃、45℃)进行实验,记录吸光度;b. 根据吸光度计算脲酶活性;c. 分析温度对脲酶活性的影响。
2. pH值对脲酶活性的影响:a. 在不同pH值条件下(如pH 4.0、5.0、6.0、7.0、8.0)进行实验,记录吸光度;b. 根据吸光度计算脲酶活性;c. 分析pH值对脲酶活性的影响。
六、实验结论1. 温度对脲酶活性的影响:在一定范围内,随着温度的升高,脲酶活性逐渐增强;超过最适温度后,脲酶活性逐渐降低。
2. pH值对脲酶活性的影响:在一定范围内,随着pH值的升高,脲酶活性逐渐增强;超过最适pH值后,脲酶活性逐渐降低。
七、实验注意事项1. 实验过程中应严格控制温度和pH值,以保证实验结果的准确性。
2. 操作过程中注意移液器的准确使用,避免污染和误差。


脲酶Km值的测定一、[背景与目的]K m值一般可看作是酶促反应中间产物的解离常数。
测定K m在研究酶的作用机制、观察酶与底物间的亲和力大小、鉴定酶的种类及纯度、区分竞争性抑制与非竞争性抑制作用等中均具有重要意义。
当环境温度、pH值和酶的浓度等条件相对恒定时,酶促反应的初速度v随底物浓度[S]增大而增大,直至酶全部被底物所饱和达到最大速度V。
反应初速度与底物浓度之间的关系经推导可用下式来表示,即米氏方程式:对于K m值的测定,我们通常采用Lineweaver-Burk作图法,即双倒数作图法。
具体做法为:取米氏方程式倒数形式。
若以1/v对1/[S]作图,即可得下图中的曲线,通过计算横轴截距的负倒数,就可以很方便地求得K m值。
本实验从大豆中提取脲酶,脲酶催化尿素分解产生碳酸铵,碳酸铵在碱性溶液中与纳氏试剂作用,产生橙黄色的碘化双汞铵。
在一定范围内,呈色深浅与碳酸铵的产量成正比。
通过分光光度计所得到的光吸收值可代表酶促反应的初速度(单位时间所产生的碳酸铵含量与光吸收值成正比)。
具体反应如下:(1)酶促反应(2)呈色反应通过本实验学习大豆脲酶的提取方法;掌握脲酶米氏常数Km的测定方法。
二、[仪器与试剂]1. 仪器(1) 721型分光光度计 (2) 恒温水浴锅2.试剂(1) 0.05mol/L尿素溶液(2) 0.1mol/LpH=7.0Tris-HCl缓冲液(3) 10%ZnSO4溶液(4) 0.5mol/LNaOH溶液(5) 10%酒石酸钾钠溶液(6) 奈氏试剂三 [实验方法]1. 脲酶提取液的制备(由老师准备)2. 取5支试管编号,按下表加入试剂和操作,加入试剂量单位为mL25℃恒温水浴,预温5min25℃恒温水浴,准确作用10min充分混匀,过滤另取5支试管,与上述离心管对应编号,如下操作混合均匀,以对照管调零,在480nm处,读取各管的A480nm值以酶促反应初速度的倒数为纵坐标(以1/ A480nm代替),以保温混合液中脲酶提取液浓度,以mol数计的倒数为横坐标,按双倒数作图法,求得K m值*[S]=每管中尿素的mol数/4.1mL×10-3(4.1mL为酶促反应总体积)五、[注意事项](1)米氏方程系线性方程,酶促反应初速度v与光吸收值A成正比,所以用1/A代表1/v 作图求K m值,方法简便,且结果不受影响。
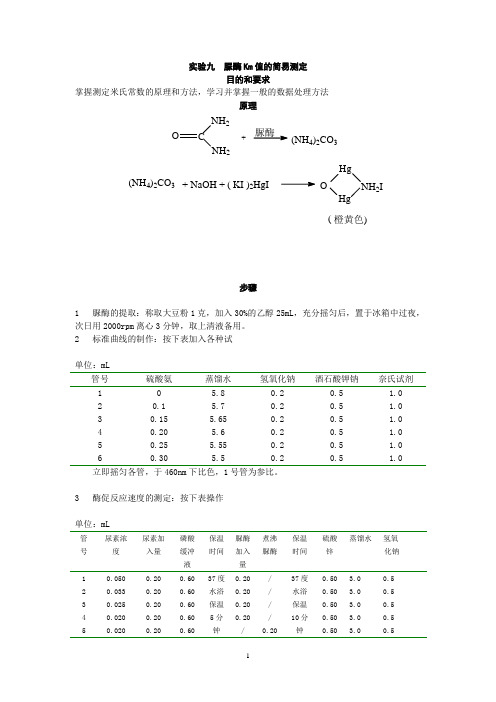
实验九脲酶Km值的简易测定目的和要求掌握测定米氏常数的原理和方法,学习并掌握一般的数据处理方法原理O CNH2NH2+脲酶(NH4)2CO3(NH4)2CO3+ NaOH + ( KI )2HgI OHgHgNH2I (橙黄色)步骤1脲酶的提取:称取大豆粉1克,加入30%的乙醇25mL,充分摇匀后,置于冰箱中过夜,次日用2000rpm离心3分钟,取上清液备用。
2标准曲线的制作:按下表加入各种试单位:mL管号硫酸氨蒸馏水氢氧化钠酒石酸钾钠奈氏试剂1 2 3 4 5 60.10.150.200.250.305.85.75.655.65.555.50.20.20.20.20.20.20.50.50.50.50.50.51.01.01.01.01.01.0立即摇匀各管,于460nm下比色,1号管为参比。
3酶促反应速度的测定:按下表操作单位:mL管号尿素浓度尿素加入量磷酸缓冲液保温时间脲酶加入量煮沸脲酶保温时间硫酸锌蒸馏水氢氧化钠1 2 3 4 5 0.0500.0330.0250.0200.0200.200.200.200.200.200.600.600.600.600.6037度水浴保温5分钟0.200.200.200.20/////0.2037度水浴保温10分钟0.500.500.500.500.503.0 0.53.0 0.53.0 0.53.0 0.53.0 0.5摇匀,静置5分钟后,于3000rpm离心5分钟,取上清液,供下步使用。
4从标准曲线方程中脲酶作用于不同浓度尿素生成碳酸铵的量,然后以取单位时间碳酸铵生成量的倒数即1/V为纵坐标,以对应的尿素浓度的倒数即1/[S]为横坐标,应用最小二乘法公式,求出方程,计算Km值。
思考题Km值的物理意义是什么?为什么要用酶反应的初速度计算Km值?本实验的关键是什么?。

一、实验目的1. 理解并掌握米氏常数(Km)及其与最大反应速度(Vmax)的关系。
2. 通过实验测定酶的米氏常数,了解酶与底物之间的亲和力。
3. 学习并掌握酶促反应动力学的基本原理和实验方法。
二、实验原理米氏常数(Km)是酶的特征性常数,表示酶与底物结合的亲和力。
在一定的实验条件下,酶促反应的初速度(v)与底物浓度([S])之间的关系可用米氏方程表示:\[ v = \frac{V_{max} [S]}{Km + [S]} \]当底物浓度很低时,酶促反应速度与底物浓度成正比,随着底物浓度的增加,反应速度逐渐加快,但增速逐渐减慢。
当底物浓度增加到一定程度时,反应速度达到最大值(Vmax),此时酶已全部被底物饱和。
本实验采用分光光度法测定酶的米氏常数。
实验中,通过改变底物浓度,测定不同浓度下酶促反应的初速度,根据米氏方程绘制v/[S]对1/[S]的曲线,通过线性回归分析求出曲线的斜率和截距,进而计算出Km和Vmax。
三、实验材料与仪器材料:1. 酶制剂(如蔗糖酶、淀粉酶等)2. 底物溶液(如葡萄糖溶液、淀粉溶液等)3. 碳酸盐缓冲液4. 4-氨基安替比林5. 铁氰化钾6. 0.1 mol/L NaOH溶液7. 葡萄糖标准溶液仪器:1. 分光光度计2. 移液管3. 移液器4. 恒温水浴5. 试管6. 比色皿四、实验步骤1. 制备酶溶液:将酶制剂溶解于适量的碳酸盐缓冲液中,调节pH值至最适值,稀释至一定浓度。
2. 制备底物溶液:将底物溶液稀释至不同浓度,备用。
3. 测定酶促反应初速度:a. 将不同浓度的底物溶液分别加入试管中,加入适量的酶溶液。
b. 将试管放入恒温水浴中保温一段时间。
c. 取出试管,立即加入适量的4-氨基安替比林和铁氰化钾,充分混匀。
d. 在分光光度计上测定溶液的吸光度,记录数据。
4. 数据处理:a. 以底物浓度[S]为横坐标,酶促反应速度v为纵坐标,绘制v/[S]对1/[S]的曲线。
b. 对曲线进行线性回归分析,求出曲线的斜率和截距。
脲酶urease(水解酶):脲酶试验原理:存在于大多数细菌、真菌和高等植物里。
它是一种酰胺酶、能酶促有机物质分子中酶键的水解。
脲酶的作用是极为专性的,它仅能水解尿素,水解的最终产物是氨和碳酸。
土壤脲酶活性,与土壤的微生物数量、有机物质含量、全氮和速效磷含量呈正相关。
根际土壤脲酶活性较高,中性土壤脲酶活性大于碱性土壤。
人们常用土壤脲酶活性表征土壤的氮素状况。
土壤中脲酶活性的测定是以脲素为基质经酶促反应后测定生成的氨量,也可以通过测定未水解的尿素量来求得。
本方法是测定生成的氨量。
试剂:1)甲苯2)10%尿素:称取10g尿素,用水溶至100ml。
3)柠檬酸盐缓冲液(PH6.7):184克柠檬酸和147.5克氢氧化钾溶于蒸馏水。
将两溶液合并,用1mol/LNaOH将PH调至6.7,用水稀释至1000毫升。
4)苯酚钠溶液(1.35mol/L):62.5克苯酚溶于少量乙醇,加2毫升甲醇和18.5毫升丙酮,用乙醇稀释至100毫升(A),存于冰箱中;27克NaOH溶于100毫升水(B)。
将AB溶液保存在冰箱中。
使用前将2溶液各20毫升混合,用蒸馏水稀释至100毫升。
5)次氯酸钠溶液:用水稀释试剂,至活性氯的浓度为0.9%,溶液稳定。
6)氮的标准溶液:a 精确称取0.4717克硫酸铵溶于水并稀释至1000ml,得到1ml含有0.1mg氮的标准液标准曲线绘制:吸取配置好的氮溶液10ml,定容至100ml,即稀释了10倍,吸取1,3,5,7,9,11,13ml移至50ml容量瓶,加水至20ml,再加入4ml苯酚钠,仔细混合,加入3ml次氯酸钠,充分摇荡,放置20分钟,用水稀释至刻度。
将着色液在紫外分光光度计上于578nm处进行比色测定,以标准溶液浓度为横坐标,以光密度值为纵坐标绘制曲线图。
1) 称取5g过1mm筛的风干土样于100ml容量瓶中。
2) 向容量瓶中加入1ml甲苯(以能全部使土样湿润为度)并放置15分钟3) 之后加入10ml 10%尿素溶液和20ml柠檬酸缓冲液(PH6.7),并仔细混合4) 将容量瓶放入37摄氏度恒温箱中,培养24h5) 培养结束后,用热至38摄氏度水稀释至刻度,仔细摇荡,并将悬液用致密滤纸过滤于三角瓶中。
酶的米氏常数测定实验报告背景酶是一种生物催化剂,能够加速化学反应的速率。
酶的活性常常通过测定其米氏常数来评估,米氏常数也被称为酶的催化效能常数。
米氏常数能够反映出酶与底物之间的亲和力以及酶对底物的催化速率。
米氏常数(Km)表示在酶浓度不变的情况下,酶对底物的亲和力。
它是底物浓度达到一半时的酶活性的浓度。
Km值越小,说明酶与底物结合的亲和力越大,反之亦然。
在本次实验中,我们选择使用酸性磷酸酯酶作为模型酶,它催化对硫酸酚酸酯的水解反应。
通过测定酶的活性随底物浓度变化的情况,来确定酶的米氏常数。
实验设计实验材料•酸性磷酸酯酶提取物•磷酸二氢钠溶液•氯化亚铁(III)溶液•硫酸酚酸酯溶液•无水醋酸溶液•pH 7缓冲溶液实验步骤1.准备一系列不同浓度的硫酸酚酸酯溶液(如0.1 mM、0.2 mM、0.3 mM等),并标记每个溶液的浓度。
2.分别向多个试管中加入相同体积的pH 7缓冲溶液、酸性磷酸酯酶提取物和不同浓度的硫酸酚酸酯溶液,混合均匀。
3.将试管放入恒温水浴中,保持温度稳定。
4.在0、5、10、15等不同时间点,取出一部分反应液,立即加入冰冷的无水醋酸溶液停止反应。
5.加入氯化亚铁(III)溶液以生成可检测的产物。
6.使用分光光度计测定反应液的吸光度,根据吸光度与产物浓度的线性关系,得到各个时间点的反应速率。
7.根据浓度和时间的关系,绘制酶活性随底物浓度变化的图谱。
8.根据实验数据,计算出酶的米氏常数。
分析通过实验数据的收集和处理,我们得到了酶活性随底物浓度变化的曲线图。
根据实验结果,我们可以进行如下分析:1.绘制酶活性随底物浓度变化的图谱,可以观察到反应速率随着底物浓度的增加而增加,但当底物浓度达到一定水平时,反应速率趋于饱和,不再显著增加。
这可能是由于酶与底物结合的位点有限,或者由于酶的饱和度导致的。
2.根据实验数据,我们可以使用米氏方程来计算酶的米氏常数。
米氏方程可以表示为:其中V是反应速率,Vmax是最大反应速率,[S]是底物浓度,Km是米氏常数。