滴定法考核表
- 格式:doc
- 大小:80.50 KB
- 文档页数:2


学习情境一药物检测前准备工作任务4 盐酸滴定液(0.1 mol/L)的配制与标定一、任务下达1.子任务子任务一:查阅药品质量标准,并根据要求准备好仪器、试药。
子任务二:根据质量标准和标准操作规程,进行盐酸滴定液(0.1 mol/L)的配制与标定操作。
子任务三:正确完成检验原始记录及检验报告。
3.任务目标通过本任务的教学和实施,预期达到以下目标。
(1)技能目标:能根据《中国药典》的要求配置滴定液;能正确标定滴定液。
(2)知识目标:掌握滴定液的配置与标定方法。
二、任务准备1.查找质量标准盐酸滴定液的配制与标定标准收载于《中国药典》2010年版二部附录181页。
【配制】盐酸滴定液(0.1 mol/L)取盐酸90ml,加水适量使成1000ml,摇匀。
盐酸滴定液(0.5 mol/L、0.2 mol/L或0.1 mol/L)照上法配制,但盐酸的使用量分别为45ml、18ml或9.0ml.【标定】盐酸滴定液(1 mol/L)取在270~300℃干燥至恒重的基准无水碳酸钠约1.5g,精密称定,加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变成紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液绿色变为暗紫色。
每1ml盐酸滴定液(1mol/L)相当于53.00mg的无水碳酸钠,根据本液的消耗量与无水碳酸钠的取用量算出本液的浓度,即得。
盐酸滴定液(0.1 mol/L)照上法标定,但基准无水碳酸钠的取用量改为约0.15g,每1ml盐酸滴定液(0.1mol/L)相当于5.30mg的无水碳酸钠。
2.准备仪器与试药(1)试验仪器:锥形瓶、万分之一电子天平、称量瓶、酸式滴定管、胶头滴管、洗瓶、电炉等。
(2)试药:浓盐酸1瓶、甲基红1瓶、溴甲酚绿1瓶、95%乙醇1瓶、基准用无水碳酸钠100g(若无可选用普通无水碳酸钠,用前300度干燥至恒重,然后用称量瓶分装好);大张滤纸5张、称量纸1包。
3.配制试液(1)甲基红-溴甲酚绿混合指示液:取0.1%甲基红的乙醇溶液20ml, 0.2%溴甲酚绿的乙醇溶液30ml,摇匀,即得。

表3 回收率测定结果样品编号加标量/(mg·kg-1)回收率/%酸性红诱惑红11109.70109.652105.00105.35 3109.45103.204298.90100.055101.45100.53 6101.83100.80710103.14100.308104.15102.469103.95100.77 2.4.2 精密度试验取回收试验卤肉加标样品3份(每个水平各1份),连续测定6次,记录峰面积,计算精密度。
结果见表4。
表4 精密度测定结果项目加标量/(mg·kg-1)精密度/%酸性红1.0 1.82.03.3 10.00.7诱惑红1.0 2.82.00.8 10.0 1.32.4.3 检出限确定称取卤肉阴性样品1份,取混合标准储备液(50 µg·mL-1)0.01 mL,按试样分析步骤处理测定,目标物各组分色谱峰信噪比:酸性红为S/N=8.2(>3),诱惑红为S/N=12.3(>3)。
由实验结果可知,当称样量为2 g,各目标组分的方法检出限为酸性红:0.3 mg·kg-1,诱惑红:0.3 mg·kg-1。
2.5 盲样考核试验实验室盲样考核能力验证一般以《ISO13528实验室间能力比对试验》经典Z值法评估实验室的检验检测水平,Z值的大小代表实验室的结果与中位值的偏离程度,而符号“+”和“-”代表与中位值的偏离方向,一般|Z|≤1为结果满意[6]。
本次对盲样进行检测,称取两份盲样考核卤肉制品进行试验,采用已建立的方法进行测试,做2次平行试验。
酸性红和诱惑红测定结果分别为1.92 mg·kg-1、5.37 mg·kg-1,盲样真值分别为2.07 mg·kg-1 、5.35 mg·kg-1,Z值分别为-0.65和0.17,|Z|均小于1,结果均为满意。
2.6 方法应用随机抽取市内各大市场及商超的卤肉样品共30批次,应用本方法进行合成着色剂的测定。



化学检验工操作技能大赛评分记录表姓名:_______ 考号:________ 班级:_____序号考核项目配分具体要求评分标准扣分得分1氢氧化钠标准溶液的标定100分滴定管的使用(60分)滴定管种类规格的选择,滴定管洗涤方法正确,洗涤效果好不规范,扣1-3分试漏和试漏方法正确,没试漏和方法不正确,扣1-3分摇匀待装液,用待装液润洗三次以上,润洗液用量润洗方法不规范,扣1-3分赶气泡,赶气泡方法方法不正确扣1-3分调节液面前放置1-2min 不规范,扣1-2分初读数姿态,初读数准确不正确扣1-2分滴定前管间悬挂液的处理不正确扣1-2分滴定管的握持姿势,滴定时管尖插入锥形瓶口的距离,滴定速度,滴定时左右手的配合,近终点时的半滴操作不正确、不规范扣1-2分没有挤松活塞漏液的现象,漏液扣1-5分没有滴出锥形瓶外的现象,滴出瓶外扣1-10分终点判断及终点控制,不正确扣1-10分终点后滴定管间没有悬挂液,没有气泡,停1-2min读数悬挂液、有气泡、不规范扣1-3分读数时取下滴定管,读数时滴定管的握持不规范扣1-2分终读数姿态(滴定管垂直,视线水平,读数准确)不规范扣1-5分滴定完毕后管内残液的处理,滴定管及时清洗且方法正确,洗净后滴定管的放置不规范扣1-2分数据处理(20分)数据记录及时,字迹应工整,有效数字正确,数据无涂改(修改规范);未按要求酌情扣5~10分结果计算有误扣5分,精密度有误和准确度有误扣5分操作时间(10分)按时完成操作;未按时扣1~10分安全文明生产(10分)台面及实验条理性未达到安全操作规程规定,扣1~10分;发生重大人身和设备事故,按考核不合格论处。
合计100分考评员签字:。

化学实验操作考核评分表1. 实验项目1:测定溶液的酸碱度- 实验目的:测定给定溶液的酸碱度,并分析结果。
- 操作方法:将溶液滴加酸碱指示剂,并根据颜色变化判断酸碱度。
- 实验步骤:1. 使用滴管将溶液滴于试管中。
2. 滴加适量的酸碱指示剂。
3. 根据颜色变化判断酸碱度。
- 评分标准:根据正确的判断和操作步骤给予评分,操作正确得分较高。
2. 实验项目2:测定溶液的浓度- 实验目的:测定给定溶液的浓度,并计算结果。
- 操作方法:利用滴定法测定溶液的浓度。
- 实验步骤:1. 使用滴管将标准溶液滴于滴定瓶中。
2. 加入滴定指示剂。
3. 滴加待测溶液直至指示剂颜色变化。
4. 记录滴定液的用量。
5. 根据滴定液的用量计算溶液的浓度。
- 评分标准:根据正确的滴定操作和浓度计算给予评分,操作准确得分较高。
3. 实验项目3:分离与提取溶液中的物质- 实验目的:通过分离与提取的方法从溶液中分离出目标物质。
- 操作方法:使用适当的分离与提取技术。
- 实验步骤:1. 准备分离与提取所需的试剂和设备。
2. 将溶液加入分离漏斗中,并加入适量的提取剂。
3. 摇匀分离漏斗,等待分层。
4. 倾倒分离漏斗,收集目标物质。
5. 干燥或浓缩目标物质。
- 评分标准:根据分离与提取的操作步骤和目标物质的收集情况给予评分,操作熟练得分较高。
4. 实验项目4:化学反应实验- 实验目的:观察和研究化学反应。
- 操作方法:根据实验要求进行化学反应。
- 实验步骤:1. 准备所需的试剂和设备。
2. 按照实验要求混合试剂。
3. 观察并记录化学反应过程中的现象和变化。
4. 分析实验结果并撰写实验报告。
- 评分标准:根据实验数据的准确性、实验报告的完整性给予评分,实验结果和报告全面得分较高。
以上为化学实验操作考核评分表,目的是为了评估学生在化学实验操作中的能力和熟练度。
根据每个实验项目的操作方法和步骤,进行评分,并针对不同的实验给予不同的评分标准。
学生在实验中准确操作、注意安全并理解实验原理的能力得分较高。


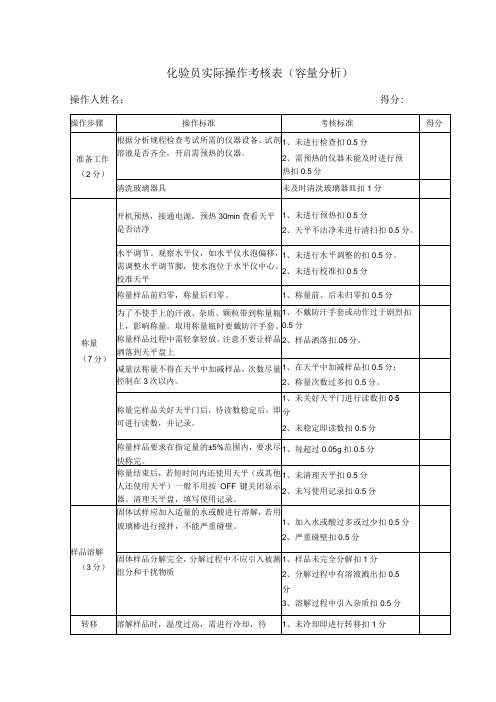




湖南省职业技能鉴定试卷
化学检验工二级操作技能考核试卷评分表
姓名: 准考证号:
滴定操作数据记录表
姓名
一、数据记录:
二、数据处理:
1、待测氢氧化钠溶液浓度为mol/L
2、数据处理过程:
统分人:年月日
湖南省职业技能鉴定试卷
化学检验工二级操作技能考核试卷材料、工具准备清单
一、材料、工具清单:
二、考场准备
1.每个考位有一个工作台,所需工具材料摆放齐全。
2.考场应干净整洁,空气新鲜,无环境干扰。
3.考前由考务管理人员检查考场各考位应准备的器材、工具是否齐全,有无遗漏。
实操配分、评分标准:
评分人:年月日核分人:年月日。


滴定操作评分表
考试人:监考人:
1、EDTA的标定
用基准氧化锌(分子量81.38)标定未知浓度的EDTA标准溶液(浓度约0.01mol/L)。
步骤:利用电子天平准确称量适量基准氧化锌,用1:1盐酸溶解,用氨水调节溶液pH值为10左右,以铬黑T为终点指示剂,用EDTA标准溶液滴定,计算结果。
反应方程式如下:EDTA+ZnCl2=EDTA-Zn+2NaCl
要求:严格按照各种仪器设备的日常使用方法和步骤操作和维护仪器,平行滴定三次,计算三次测定的相对平均偏差。
2、硫酸标准溶液的标定
用基准碳酸钠(分子量105.98)标定未知浓度的硫酸标准溶液(浓度约0.08-0.12mol/L之间)。
步骤:利用电子天平准确称量适量基准碳酸钠,用50毫升水溶解,以甲基红-亚甲基兰为指示剂,硫酸标准溶液滴定,计算结果。
反应方程式如下:
Na2CO3+H2SO4= Na2 SO4+ H2O+ CO2
要求:严格按照各种仪器设备的日常使用方法和步骤操作和维护仪器,平行滴定三次,计算三次测定的相对平均偏差。
3、硝酸银标准溶液标定
用基准氯化钠(分子量58.45)标定未知浓度的硝酸银标准溶液(浓度T=0.8-1.2mg/mL)。
步骤:利用电子天平准确称量1.648克基准氯化钠,溶解并稀释至1000毫升,配成
1mg/mLCl—的标准溶液。
取10毫升氯化钠标准溶液,用90毫升水稀释,10%铬酸钾为指示剂,以硝酸银标准溶液滴定,计算结果。
反应方程式如下:
AgNO3+ NaCl = NaNO3 +AgCl
要求:严格按照各种仪器设备的日常使用方法和步骤操作和维护仪器,平行滴定三次,计算三次测定的相对平均偏差。