专题9-化学反应速率和化学平衡图像和图表
- 格式:doc
- 大小:471.00 KB
- 文档页数:13


化学反应速率和化学平衡图像图像分析要领2SO2(g)+O2(g)2SO3(g) t随后逐渐增加,说明改变的条件是增加反应物的浓度。
CH4(g)+H2O(g)CO(g)+3H2(g)ΔH>0tmA(g)+nB(g)qC(g)+pD(g) “定一议二”。
m+n>q+p时2NO(g) + 2CO(g)N2(g)+2CO2(g) 先拐先平,先平者高。
T投料比图2SO2(g)+O2(g)2SO3(g) △H<01.b应对应物质的化学计量数之n2.T3.平衡向右移动,分数先增大后减小定位题组1.对于可逆反应:2SO 2(g)+O 2(g)2SO 3(g)△H<0,下列研究目的和示意图相符的是2.工业上可利用CH 4(g)+H 2O(g)CO(g)+3H 2(g)反应生产合成氨原料气H 2。
已知温度、压强和水碳比[)()(42CH n O H n ]对甲烷蒸汽转化反应的影响如下图:图1(水碳比为3) 图2(水碳比为3) 图3(800℃)(1)降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);升高温度,平衡向____________方向移动(选正反应或逆反应)。
(2)图2中,两条曲线所示温度的关系是:t 1_____t 2(选填>、=或<);图1中,在800℃、2MPa 比1MPa 时的甲烷含量_______(选填高、低或不变),3.甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH 4和H 2O 为原料来制备甲醇。
(1)将1.0 mol CH 4和2.0 mol H 2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH 4(g)+H 2O(g) CO(g)+3H 2(g)……Ⅰ,CH 4的转化率与温度、压强的关系如图。
①已知100 ℃时达到平衡所需的时间为5 min 。
则用H 2表示的平均反应速率为________。

化学反应速率和化学平衡图象【考试大纲要求】1.了解化学反应的可逆性。
理解化学平衡的涵义。
掌握化学平衡与反应速率之间的内在联系。
2.理解勒沙特列原理的涵义。
掌握浓度、温度、压强等条件对化学平衡移动的影响。
3.能够通过对图形、图表的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆。
【知识规律总结】化学反应速率概念:用单位时间里反应物浓度的减少或生成物浓度的增加来表示。
1.表示方法:v=△c/△t2.单位:mol/(L·s);mol/(L·min);mol/L·H。
3.相互关系:4NH3+5O24NO+6H2O(g)v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6影响化学反应速率的因素1.内因:反应物本身的性质(如:硫在空气中和在氧气中燃烧的速率明显不同)。
2.外内:(1)浓度:浓度越大,分子之间距离越短,分子之间碰撞机会增大,发生化学反应的几率加大,化学反应速率就快;因此,化学反应速率与浓度有密切的关系,浓度越大,化学反应速率越快。
增大反应物的浓度,正反应速率加快。
(2)温度:温度越高,反应速率越快(正逆反应速率都加快)。
(3)压强:对于有气体参与的化学反应,通过改变容器体积而使压强变化的情况:PV=nRT, P=CRT。
压强增大,浓度增大(反应物和生成物的浓度都增大,正逆反应速率都增大,相反,亦然)。
(4)催化剂:改变化学反应速率(对于可逆的反应使用催化剂可以同等程度地改变正逆反应速率)。
化学平衡的概念:在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组在成分的含量保持不变的状态叫做化学平衡。
1.“等”——处于密闭体系的可逆反应,化学平衡状态建立的条件是正反应速率和逆反应速率相等。
即v(正)=v(逆)≠0。
这是可逆反应达到平衡状态的重要标志。
2.“定”——当一定条件下可逆反应一旦达平衡(可逆反应进行到最大的程度)状态时,在平衡体系的混合物中,各组成成分的含量(即反应物与生成物的物质的量,物质的量浓度,质量分数,体积分数等)保持一定而不变(即不随时间的改变而改变)。
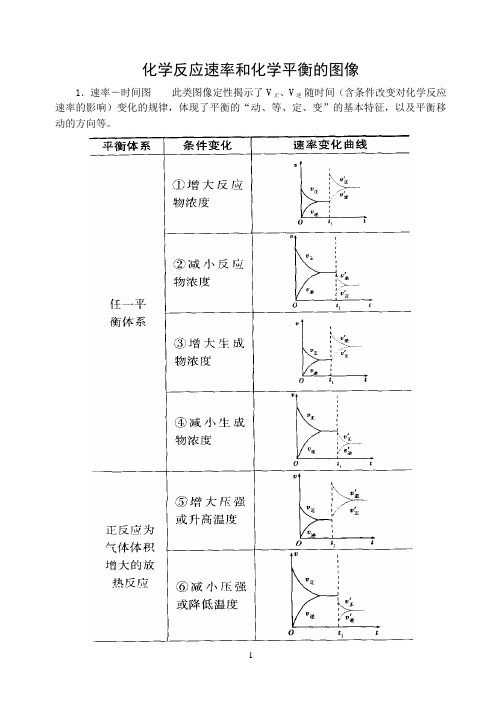
化学反应速率和化学平衡的图像
1.速率-时间图此类图像定性揭示了V正、V逆随时间(含条件改变对化学反应速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
2.含量―时间―温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。
3.恒压(温)线该类图像的纵坐标为物质的平衡浓度(c)或反应物的转化率( ),横坐标为温度(T)或压强(p),常见类型如下图:
小结
1.图像分析应注意“三看”
(1)看两轴:认清两坐标轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定一议二”的方式进行分析。

化学反应速率和平衡图像
一、回顾
1. 影响化学反应速率的外界因素
4.
若v 正在
1.可逆反应a X(g)+b Y(g)c Z(g)
在一定温度下的一密闭容器内达到平衡后,
t 0时改变某一外界条件,化学反应速率(v )
—时间(t )图象如图,则下列说法中正确的
是 ( )
A .若a +b =c ,则t 0时只能是增大了容器的压强
B .若a +b =c ,则t 0时只能是加入了催化剂
C .若a +b ≠c ,则t 0时只能是增大了容器的压强
D .若a +b ≠c ,则t 0时只能是加入了催化剂
【典例2】(2013·成都模拟)可逆反应N 2+3H 22NH 3是工业上合成氨的重要反应。
1)根据图1请写出合成氨的热化学方程式______________
________________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的___________条件,该条件的改变与图2中哪一时刻条件
的改变相同_________(用“t1…t6”表示)。
(3)图2中t3时刻改变的条件是_______________,t5时刻改变的条件是___________。
答案:(1)N2(g)+3H2(g)2NH3(g)ΔH=-2(E3-E1)kJ·mol-1
(2)催化剂t2…t3(3)减小压强升高温度。

专题9 化学反应速率、化学平衡的图像和图表学号 姓名1.(2018年11月浙江选考卷22题)已知2SO 2(g )+O 2(g ) ⇌2SO 3(g ) ΔH =-197.8 kJ ·molˉ1。
起始反应物为SO 2和O 2(物质的量之比为2∶1,且总物质的量不变)。
SO 2的平衡转化率(%)随温度和压强的变化如下表:温度/K 压强/(105 Pa )1.01 5.07 10.1 25.3 50.7 673 99.2 99.6 99.7 99.8 99.9 723 97.5 98.9 99.2 99.5 99.6 77393.596.997.898.699.0下列说法不正确...的是( ) A .一定压强下降低温度,SO 2的平衡转化率增大B .在不同温度、压强下,转化相同物质的量的SO 2所需要的时间相等C .使用催化剂可以缩短反应达到平衡所需的时间D .工业生产通常不采取加压措施是因为常压下SO 2的转化率已相当高 2.(2016四川卷)一定条件下,CH 4与H 2O (g )发生反应:CH 4(g )+H 2O (g )CO (g )+3H 2(g ),设起始 =Z ,在恒压下,平衡时ϕ (CH 4)的体积分数与Z 和T (温度)的关系如图所示。
下列说法正确的是 A .该反应的焓变ΔH >0 B .图中Z 的大小为a >3>bC .图中X 点对应的平衡混合物中 =3D .温度不变时,图中X 点对应的平衡在加压后ϕ (CH 4)减小3.(2015年安徽卷)汽车尾气中,产生NO 的反应为:N 2(g )+O 2(g )⇌ 2NO (g ),一定条件下,等物质的量的N 2(g )和O 2(g )在恒容密闭容器中反应,下图曲线a 表示该反应在温度T 下N 2的浓度随时间的变化,曲线b 表示该反应在某一起始条件改变时N 2的浓度随时间的变化。
下列叙述正确的是A .温度T 下,该反应的平衡常数K =21210)(4c c c - B .温度T 下,随着反应的进行,混合气体的密度减小24(H O))(CH n n 24(H O))(CH n nC.曲线b对应的条件改变可能是加入了催化剂D.若曲线b对应的条件改变是温度,可判断该反应的△H<04.(2015福建卷)在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。
下列判断不正确的是A.a=6.00B.同时改变反应温度和蔗糖的浓度,v可能不变C.b<318.2D.不同温度时,蔗糖浓度减少一半所需的时间相同5.(2015四川卷)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ⇌2CO(g)。
平衡时,体系中气体体积分数与温度的关系如下图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确的是A.550℃时,若充入惰性气体,ʋ正,ʋ逆均减小,平衡不移动B.650℃时,反应达平衡后CO2的转化率为25.0%C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K P=24.0P总6.(2015江苏卷)在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+c(s)⇌2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。
下列说法正确的是()A.反应CO2(g)+c(s)V2O5△高温、高压催化剂浓硫酸Δ180℃催化剂充电放电催化剂Δ2CO(g) △S>0、△H<0B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ)C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)D .逆反应速率V 逆:V 逆(状态Ⅰ)>V 逆(状态Ⅲ)7.(2018年江苏卷15题)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO 2(g )+ O 2(g )⇌ 2SO 3(g )(正反应放热),测得反应的相关数据如下:下列说法正确的是A .v 1< v 2,c 2< 2c 1B .K 1> K 3,p 2> 2p 3C .v 1< v 3,α1(SO 2 ) >α3(SO 2 )D .c 2> 2c 3,α2(SO 3 )+α3(SO 2 )<1 8.(2016年新课标3卷27题)煤燃烧排放的烟气含有SO 2和NO x ,形成酸雨、污染大气,采用NaClO 2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
回答下列问题:在不同温度下,NaClO 2溶液脱硫、脱硝的反应中,SO 2和NO 的平衡分压p e 如图所示。
由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
9.(2016北京卷26题(2))对于反应A 4HCl +O 22Cl 2+2H 2O,下图是4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1、]下,反应温度对HCl 平衡转化率影响的曲线。
400℃ CuO/CuCl2①曲线b对应的投料比是______________.②当曲线b, c, d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是_________________.③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______________. 10.(2018年北京卷27题(4))探究反应i SO2+4I-+4H+== S↓+2I2+2H2O、ii I2+2H2O+ SO2==SO42−+ 4H++2I-反应速率与SO2歧化反应速率的关系,实验如下:分别将18mL SO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。
(已知:I2易溶解在序号A B C D试剂组成0.4mol·L-1KIamol·L-1KI0.2mol·L-1 H2SO40.2mol·L-1H2SO40.2mol·L-1KI0.0002mol I2实验现象溶液变黄,一段时间后出现浑浊溶液变黄,出现浑浊较A快无明显现象溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
11(2010年广东卷31题(2)).在其他条件相同时,反应H3BO3 +3CH3OH⇌B(OCH3)3 +3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化见图12,由此图可得出:(1)温度对应该反应的反应速率和平衡移动的影响是____ ___(2)该反应的H∆_____0(填“<”、“=”或“>”).12.(2019年新课标3卷20题(3))CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:反应Ⅰ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH =41.2 kJ·mol−1反应Ⅱ:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。
其中:CH 3OCH 3的选择性=332CH OCH C 2O 的物质的量反应的的物质的量×100%①温度高于300 ℃,CO 2平衡转化率随温度升高而上升的原因是________。
②220 ℃时,在催化剂作用下CO 2与H 2反应一段时间后,测得CH 3OCH 3的选择性为48%(图中A 点)。
不改变反应时间和温度,一定能提高CH 3OCH 3选择性的措施有________。
13.(2017年新课标2卷(2))丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。
回答下列问题:正丁烷(C 4H 10)脱氢制1-丁烯(C 4H 8)的热化学方程式如下: ①C 4H 10(g )= C 4H 8(g )+H 2(g ) ΔH 1已知:②C 4H 10(g )+ 1/2O 2(g )= C 4H 8(g )+H 2O (g ) ΔH 2=−119 kJ ·mol −1 ③H 2(g )+1/2 O 2(g )= H 2O (g ) ΔH 3=−242 kJ ·mol −1 图(a )是反应①平衡转化率与反应温度及压强的关系图(1)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。
图(b )为丁烯产率与进料气中n (氢气)/n (丁烷)的关系。
图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(2)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。
丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
14.(2013年浙江理综卷27题(2))捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。
目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq) △H1反应Ⅱ:NH3(l)+H2O(l)+CO2(g)(NH4)2HCO3(aq) △H2反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2(NH4)2HCO3(aq) △H3请回答下列问题:为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。
然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。
则:①△H3 0(填>、=或<)。
②在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。
当时间到达t1时,将该反应体系温度上升到T2,并维持该温度。