化学反应速率平衡图像专题
- 格式:ppt
- 大小:757.00 KB
- 文档页数:20




化学反应速率和化学平衡图像图像分析要领2SO2(g)+O2(g)2SO3(g) t随后逐渐增加,说明改变的条件是增加反应物的浓度。
CH4(g)+H2O(g)CO(g)+3H2(g)ΔH>0tmA(g)+nB(g)qC(g)+pD(g) “定一议二”。
m+n>q+p时2NO(g) + 2CO(g)N2(g)+2CO2(g) 先拐先平,先平者高。
T投料比图2SO2(g)+O2(g)2SO3(g) △H<01.b应对应物质的化学计量数之n2.T3.平衡向右移动,分数先增大后减小定位题组1.对于可逆反应:2SO 2(g)+O 2(g)2SO 3(g)△H<0,下列研究目的和示意图相符的是2.工业上可利用CH 4(g)+H 2O(g)CO(g)+3H 2(g)反应生产合成氨原料气H 2。
已知温度、压强和水碳比[)()(42CH n O H n ]对甲烷蒸汽转化反应的影响如下图:图1(水碳比为3) 图2(水碳比为3) 图3(800℃)(1)降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);升高温度,平衡向____________方向移动(选正反应或逆反应)。
(2)图2中,两条曲线所示温度的关系是:t 1_____t 2(选填>、=或<);图1中,在800℃、2MPa 比1MPa 时的甲烷含量_______(选填高、低或不变),3.甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH 4和H 2O 为原料来制备甲醇。
(1)将1.0 mol CH 4和2.0 mol H 2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH 4(g)+H 2O(g) CO(g)+3H 2(g)……Ⅰ,CH 4的转化率与温度、压强的关系如图。
①已知100 ℃时达到平衡所需的时间为5 min 。
则用H 2表示的平均反应速率为________。

1.(2016·四川高考真题)一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g),设起始24(H O))(CHnn=Z,在恒压下,平衡时ϕ(CH4)的体积分数与Z和T(温度)的关系如图所示。
下列说法正确的是A.该反应的焓变ΔH>0B.图中Z的大小为a>3>bC.图中X点对应的平衡混合物中24(H O))(CHnn=3D.温度不变时,图中X点对应的平衡在加压后ϕ(CH4)减小2.(2015·安徽高考真题)汽车尾气中NO产生的反应为:N2(g)+O2(g)⇌2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是专题38 化学反应速率与平衡图像问题A .温度T 下,该反应的平衡常数201214()c c K c B .温度T 下,随着反应的进行,混合气体的密度减小C .曲线b 对应的条件改变可能是加入了催化剂D .若曲线b 对应的条件改变是温度,可判断该反应的△H <03.(2015·四川高考真题)一定量的CO 2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO 2(g)2CO(g)。
平衡时,体系中气体体积分数与温度的关系如下图所示:已知:气体分压(P 分)=气体总压(P 总)×体积分数。
下列说法正确的是A .550℃时,若充入惰性气体,ʋ正,ʋ逆 均减小,平衡不移动B .650℃时,反应达平衡后CO 2的转化率为25.0%C .T ℃时,若充入等体积的CO 2和CO ,平衡向逆反应方向移动D .925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K P =24.0P 总4.(2009·安徽高考真题)汽车尾气净化中的一个反应如下:NO(g)+CO(g)⇌12N 2(g)+CO 2(g) △H=-373.4KJ/mol 。

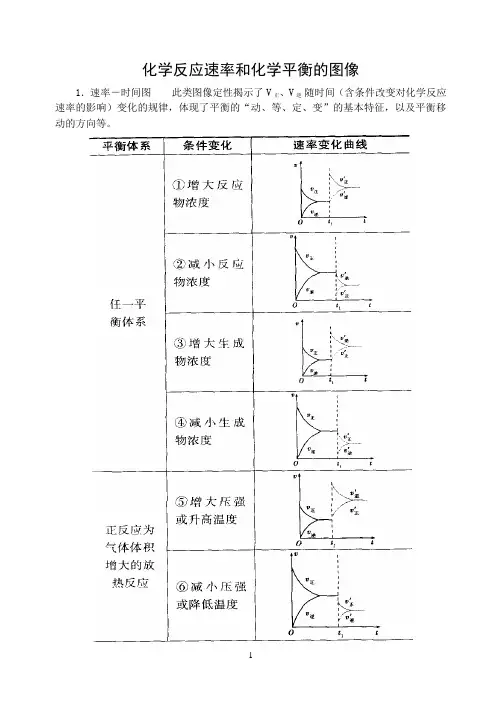
化学反应速率和化学平衡的图像
1.速率-时间图此类图像定性揭示了V正、V逆随时间(含条件改变对化学反应速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
2.含量―时间―温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。
3.恒压(温)线该类图像的纵坐标为物质的平衡浓度(c)或反应物的转化率( ),横坐标为温度(T)或压强(p),常见类型如下图:
小结
1.图像分析应注意“三看”
(1)看两轴:认清两坐标轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定一议二”的方式进行分析。

V 正 V 逆 Vttt 高二化学 化学反应速率与平衡图像专题反应速率图像1.认清坐标系,搞清纵、横坐标所代表的意义。
2.看清起点,分清反应物、生成物,浓度减小的是反应物,浓度增大的是生成物。
一般生成物多数以原点为起点。
3.注意终点。
例如在浓度-时间图上,一定要看清终点时反应物的消耗量、生成物的增加量,并结合有关原理进行推理判断。
4.抓住变化趋势。
升高温度时,v(吸)>v(放);在速率-时间图上,要注意看清曲线是连续的还是跳跃的,分轻渐变和突变,大变和小变。
例如,升高温度,v(吸)大增,v(放)小增;增大反应物浓度,v(正)突变,v(逆)渐变。
例1:以mA (g )+nB (g )qC (g );.若增大压强,或升高温度,重新达到平衡v 正、v 逆变化如图, 则△H___ 0,m+n___ q 解析:分清正反应和逆反应; 分清放热反应和吸热反应; 分清“突变”和“渐变” 化学平衡图像1.认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。
2.紧扣可逆反应的特征,搞清正反应方向是吸热还是放热、体积增大还是减小、不变、有无固体、纯液体物质参加或生成等。
3.看清速率的变化及变化量的大小,在条件与变化之间搭桥。
4.看清起点、拐点、终点,看清曲线的变化趋势。
5.先拐先平。
例如,在转化率-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
6.定一议二。
当图像中有三个量时,先确定一个量不变在讨论另外两个量的关系。
例2:如图所示,图中a 曲线表示 X(g) +Y(g)2Z(g)+ W(s) ΔH>0的反应过程,若使a 曲线变为b 曲线,可采取的措施是( ) A. 加入催化剂 B. 增大Y 的浓度 C. 降低温度 D. 增大体系压强n /molNM 8 4 6 【巩固练习】1、对达到平衡状态的可逆反应X +YZ +W ,在其他条件不变的情况下,增大压强,反应速率变化图象如右图所示,则图象中关于X 、Y 、Z 、W 四种物质的聚集状态为( )A Z 、W 均为气体,X 、Y 中有一种是气体B Z 、W 中有一种是气体,X 、Y 皆非气体C X 、Y 、Z 、W 皆非气体D X 、Y 均为气体,Z 、W 中有一种为气体2、 右图表示反应N 2(g )+3H 2(g )2NH 3(g );ΔH=-92.2kJ/mol 。

专题15 化学反应的速率和平衡图像题的分析化学反应速率和化学平衡图像题是化学试题中的一类特殊题型,其特点为图像是题目的主要组成部分,把所要考查的化学知识寓于图中曲线上,具有简明、直观、形象的特点。
化学反应速率和化学平衡图像题分析方法如下。
1.看图像(1)看面,弄清楚横、纵坐标所表示的含义;(2)看线,弄清楚线的走向和变化趋势;(3)看点,弄清楚曲线上点的含义,特别是曲线上的折点、交点、最高点、最低点等;(4)看辅助线,作横轴或纵轴的垂直线(如等温线、等压线、平衡线等);(5)看量的变化,弄清楚是物质的量的变化、浓度的变化,还是转化率的变化。
2.想规律如各物质的转化量之比与化学计量数之比的关系,各物质的化学反应速率之比与化学计量数之比的关系,外界条件的改变对化学反应速率的影响规律以及反应达到平衡时,外界条件的改变对正、逆反应速率的影响规律等。
3.作判断利用有关规律,结合图像,通过对比分析,作出正确判断。
例1.(2022·河南·高一期中)在恒温恒容条件下,发生反应2A(g)+xB(g)2C(g),反应体系中某物质的浓度c随时间的变化如图中曲线甲、乙所示,已知x为整数。
下列说法正确的是A.x=3B .曲线乙表示的是物质A 在反应进程中的浓度变化C .10~30min 内v(C)=0.05mol·L -1·min -1D .c 点对应物质的浓度与d 点对应物质的浓度相等【答案】A【解析】A .由分析可知x=3,A 正确;B .由分析可知曲线乙表示的是物质C 在反应进程中的浓度变化,B 错误;C .10~30min 内,-1-1(B)=(2-1)mol L =1mol L c ⋅⋅∆,-1-11mo/L v(B)==0.05mol L 20min ⋅,v(B):v(c)=3:2,则-122v(c)=v(B)=0.05mol L 33⨯⋅,C 错误;D .由图可知c 对应物质的浓度为1.6 mol·L -1,d 点对应物质的浓度为0.6 mol·L -1,D 错误;故选A 。

专题五 化学反应的速率 化学平衡图像一、化学反应速率1、意义:衡量化学反应进行快慢程度的物理量。
2、表示方法:用单位时间内反应物 的减少或生成物 的增加来表示。
3、表达式:4、单位:5、注意事项:(1)为标量,取正值,是平均速率。
(如何判断瞬时速率的相对大小?)(2)对于同一反应,用不同物质表示的反应速率数值可能不同,但意义相同。
故描述反应速率时应指明物质种类,比较速率大小时要转化成同一物质(统一单位)。
(3)用不同物质表示的速率之比等于方程式计量数之比。
(4)不能用固体或纯液体表示反应速率。
(5)可逆反应中v 的意义。
(区别正、逆反应速率和净速率)62、外界条件的改变不能改变物质本身性质,如铁与稀硫酸制氢气,改用浓硫酸不能加快制氢速率。
3、升高温度,无论吸热还是放热反应,反应速率一定加快,只是加快程度不相同;温度每升高10℃,反应速率会变成原来2--4倍。
4、压强对速率的改变本质是对 的改变。
总结压强对反应速率的影响:5、催化剂在反应前后组成、质量和化学性质不变,而非不参与反应;对于可逆反应,催化剂能同等程度(倍数)改变正、逆反应速率。
催化剂不改变反应的方向、不改变转化率、不改变平衡常数、不改变反应的热效应,只是能缩短达到平衡所需的时间。
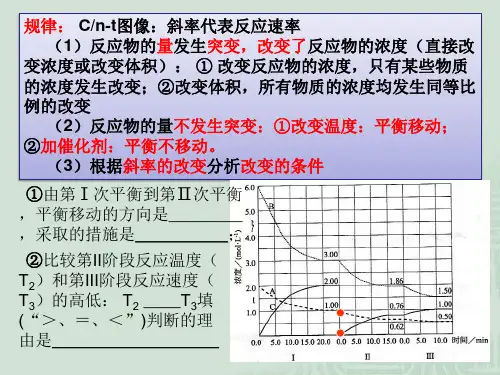
例:某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);ΔH <0。
下图表示该反应的速率(v )随时间(t )变化的关系,t 2、t 3、t 5时刻外界条件有所改变,但都没有改变各物质的加入量。
下列说法中正确的是A .t 2时加入了催化剂B .t 3时降低了温度C .t 5时增大了压强D .t 4~t 5时间内转化率最低练1:在某个容积为2.0 L 的密闭容器内,在T ℃时按下图1所示发生反应:mA(g)+nB(g)pD(g)+qE(s)+Q (Q >0)(m 、n 、p 、q 为最简整数比)。
(1)据图1所示,反应开始至达到平衡时,用D 物质表示的该反应速率为____ _;(2)根据上图可求得方程式中m :n :p :q = ,该反应的化学平衡常数的表达式K= ,升高温度,反应的化学平衡常数K (填“增大”、“减小”或“不变”,下同),B 的反应速率 。
2021-2022学年高一化学期末复习重点专题突破专题08 化学反应速率及平衡图像问题的分析方法探究一、化学平衡建立过程中反应速率变化图像根据图像可进行如下分析:二、化学平衡建立过程中物质的量变化图像根据图像可进行如下分析:1.分清反应物和生成物,物质的量减小的是反应物,物质的量增加的是生成物,生成物多数是以原点为起点。
2.根据相同时间内反应物和生成物的物质的量变化,可计算各物质的化学反应速率,再根据化学反应速率之比等于各自的化学计量数之比,可推出反应的化学方程式。
3.找出反应达到平衡的时间点,进而通过图中数据,可计算得到反应达到一定时间下,反应物的物质的量、生成物的物质的量以及反应物的转化率等。
三、有关化学反应速率和化学平衡的计算解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、变化量及平衡量,再根据题设其他条件和定律列方程求解。
如:m A(g)+n B(g)p C(g)+q D(g)起始/mol a b0 0转化/mol mx nx px qx平衡/mol a−mx b−nx px qx(1)关于反应物转化率的计算A的转化率=AA的转化量的起始量×100%(计算式中A的量可以指反应物的物质的量、质量、浓度、体积等)(2)关于某气体组分的体积分数的计算气体A的体积分数=A体系中的物质的量体系中气体总的物质的量×100%四、解答化学反应速率及化学平衡图像题的方法技巧化学反应速率及化学平衡的图像,能直观描述反应进行的快慢、反应进行的程度等问题。
图像题是化学中常见的一种题目,做这类题既要读文字内容,又要读图。
解答化学反应速率图像题三步曲:“一看”、“二想”、“三判断”;“一看”——看图像①看坐标轴:弄清纵、横坐标表示的含义;②看线:弄清线的走向、趋势;③看点:弄清曲线上点的含义,特别是一些特殊点,如曲线的折点、交点、最高点与最低点等;④看量的变化:弄清是物质的量的变化、浓度的变化还是转化率的变化等。