化学反应速率和化学平衡图像练习题
- 格式:doc
- 大小:227.50 KB
- 文档页数:9

高二化学(必修一)化学平衡图象练习题(含答案解析)学校:___________姓名:___________班级:___________一、单选题1.在2A(g)+B(g)=3C(g)+5D(g)反应中,表示该反应速率最快的是()A.v(A)=2mol·L-1·min-1B.v(B)=0.3mol·L-1·s-1C.v(C)=0.8mol·L-1·s-1D.v(D)=1mol·L-1·s-12.a A(g)+b B(g)⇌c C(g)+d D(g)Δ H=Q,同时符合两图中各曲线规律的是()A.a+b>c+d T1>T2 Q>0B.a+b>c+d T1>T2 Q<0C.a+b>c+d T1<T2 Q<0D.a+b<c+d T1<T2 Q<03.CuCl2溶液中存在平衡:[Cu(H2O)4]2+(蓝色)+4Cl-⇌[CuCl4]2-(黄色)+4H2O,下列说法中错误的是()A.[CuCl4]2-中铜的化合价是+2价B.1mol[Cu(H2O)4]2+中σ键的物质的量为12molC.向溶液中加入AgNO3可使黄绿色的CuCl2溶液变成蓝色D.若升高CuCl2溶液温度,溶液pH不变4.在某恒容密闭容器中充入一定量的O2(g)和O3(g),发生反应2O3(g)3O2(g) △H<0,下列说法正确的是()A.若混合气体的密度不再随时间而改变,则该反应达到平衡B.加入合适的催化剂,反应达到平衡后,O2的体积分数增大C.该反应的生成物的总能量大于反应物的总能量D.若起始时充入少量的稀有气体,则该反应的反应速率保持不变5.中国科学技术大学设计出一种“松果结构”的铂金属催化剂,在催化电解水制氢效果不变的情况下,铂金属的用量降低到传统商业催化剂的175,下列说法不正确的是()A.催化剂的结构会影响催化效果B.使用“松果结构”的铂金属催化剂能够极大提高水的转化率C.使用铂金属催化剂能够降低电解水的活化能D.氢能是一种高能、洁净的可再生能源6.以Cu/Zn O/Al2O3为催化剂,乙醇直接合成乙酸乙酯过程中发生的可逆反应如下:C2H5OH(g)=CH3CHO(g)+H2(g);Δ H=59kJ·mol-12CH3CHO(g)+H2O(g)=C2H5OH(g)+CH3COOH(g);Δ H=-86kJ·mol-1CH3COOH(g)+C2H5OH(g)=CH3COOC2H5(g)+H2O(g);Δ H=-25kJ·mol-12C2H5OH(g)=C2H5OC2H5(g)+H2O(g);Δ H=-44kJ·mol-1其他条件相同,将无水乙醇经预热气化后以一定流速通过装有催化剂的反应管,将出口处收集到的乙酸乙酯、乙醛、乙醚、乙酸、乙醇冷凝,测得部分有机物占全部有机物的质量分数与反应温度的关系如图所示。

高中化学《化学反应速率与化学平衡》练习题(附答案解析)学校:___________姓名:___________班级:___________一、单选题1.对于在恒容密闭容器中进行的反应()()()()22C s +H O g CO g +H g ,下列说法错误的是 ( )A .其他条件不变,充入少量He ,则反应速率增大B .若()()2正逆v CO =v H O ,则反应达到平衡状态C .其他条件不变,增加C(s)的质量,反应速率不变D .若混合气体的质量不再改变,则反应达到平衡状态 2.下列反应中,熵减小的是( ) A .2HI (g)=H 2 (g)+I 2 (g)B .NH 4NO 3爆炸:2NH 4NO 3 (s)=2N 2 (g)+4H 2O (g)+O 2 (g)C .2O 3 (g)=3O 2 (g)D .4NH 3 (g)+5O 2 (g)=4NO (g)+6H 2O (1)3.aA(g)+bB(g)⇌cC(g)+dD(g) ΔH=Q ,同时符合两图中各曲线规律的是( )A .a+b>c+d T 1>T 2 Q>0B .a+b>c+d T 1>T 2 Q<0C .a+b>c+d T 1<T 2 Q<0D .a+b <c+d T 1<T 2 Q<04.某对于平衡体系xA(g)+yB(g)mC(g)+nD(g),其他条件不变增大压强,C 的百分含量减少,则下列关系中正确的是( ) A .x +m<n B .x +y<m +n C .m +n>xD .m +n<y +x5.已知某反应中各物质的浓度数据如下: ()()-1-1mA g +nB g qC g /mol L 3.6 2.4 2.42s /mol L 2.41.64.0⋅⋅()起始浓度末浓度则m:n:q等于()A.3:2:2 B.3:2:3 C.3:2:4 D.3:2:56.化学知识和技术发展离不开伟大化学家,下列人物与其贡献不匹配的是()A.侯德榜——工业制备烧碱B.勒夏特列——化学平衡的移动C.李比希——元素定量分析D.盖斯——反应热的计算7.现有下列两个图象:下列反应中符合上述图象的是()A.N2(g)+3H2(g)2NH3(g) ΔH<0B.2SO3(g)2SO2(g)+O2(g) ΔH>0C.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0D.H2S(g)H2(g)+S(s) ΔH>0,10min 8.将1mol X和3mol Y在2L的恒容密闭容器中混合,一定条件下发生反应X(s)3Y(g)2Z(g)时测得Y的物质的量为2.4mol,下列说法正确的是()A.10min内,X的平均反应速率为0.01mol/(L·min)B.第10min时,Z的浓度为0.4mol/LC.10min时,X的转化率为20%D.反应时,向容器中通入He,容器内压强增大,反应速率加快9.下列说法正确的是()A.活化分子间的碰撞一定能发生化学反应B.增大浓度时,化学反应速率加快,主要原因是反应物活化分子百分数增大,单位时间内有效碰撞次数增多C.△H<0的反应均是自发反应D.反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向10.下图是可逆反应X 2+3Y 22Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是( )A .t 1、t 2时,用不同物质表示正、逆反应速率有2v(X 2)=v(Z)B .t 2时,反应已达到了一定限度C .t 2~t 3,反应不再发生D .t 2~t 3,各物质的浓度不再发生变化 11.已知298K 时,2SO 2(g)+O 2(g)2SO 3(g);△H=-197kJ ·mol -1。

专题42化学反应速率与平衡图像问题1.【2022年湖南卷】向体积均为1L 的两恒容容器中分别充入2mol X 和1mol Y 发生反应:2X(g)+Y(g)Z(g) ΔH ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
下列说法正确的是A .ΔH>0B .气体的总物质的量:a c n <nC .a 点平衡常数:K>12D .反应速率:a b v <v 正正【答案】BC 【解析】A .甲容器在绝热条件下,随着反应的进行,压强先增大后减小,根据理想气体状态方程PV=nRT 可知,刚开始压强增大的原因是因为容器温度升高,则说明上述反应过程放热,即H ∆<0,故A 错误;B .根据A 项分析可知,上述密闭溶液中的反应为放热反应,图中a 点和c 点的压强相等,因甲容器为绝热过程,乙容器为恒温过程,若两者气体物质的量相等,则甲容器压强大于乙容器压强,则说明甲容器中气体的总物质的量此时相比乙容器在减小即气体总物质的量:n a <n c ,故B 正确;C .a 点为平衡点,此时容器的总压为p ,根据理想气体状态方程PV=nRT 可知,在恒容条件下进行,气体的物质的量之比等于P T整体之比,根据A 项分析可知,绝热条件下,反应到平衡状态放热,所以T a >T 始,压强:Pa=12P 始,则n a <12n 始,可设Y 转化的物质的量浓度为xmol∙L −1,则列出三段式如下:02X(g)+Y(g)Z(g)2102x xx 22x 1x x c cc ∆-- 平,则有[(22x)(1x)x]mol -+-+<13mol 2⨯,计算得到x >0.75,那么化学平衡常数K=2c(Z)c (X)c(Y)⋅>20.75120.50.25=⨯,故C 正确;D .根据图像可知,甲容器达到平衡的时间短,温度高,所以达到平衡的速率相对乙容器的快,即V a 正>V b 正,故D 错误。


化学反应平衡图像同步练习 (答题时间:40分钟)一、选择题1. 汽车尾气中NO 产生的反应为:N 2(g )+O 2(g )⇌2NO (g )。
一定条件下,等物质的量的N 2(g )和O 2(g )在恒容密闭容器中反应,如图曲线a 表示该反应在温度T 下N 2的浓度随时间的变化,曲线b 表示该反应在某一起始反应条件改变时N 2的浓度随时间的变化。
下列叙述正确的是( )A. 温度T 下,该反应的平衡常数K =21210)(4c c c - B. 温度T 下,随着反应的进行,混合气体的密度减小 C. 曲线b 对应的条件改变可能是加入了催化剂D. 若曲线b 对应的条件改变是温度,可判断该反应的ΔH <02. 在恒容密闭容器中通入X 并发生反应:2X (g )⇌Y (g ),温度T 1、T 2下X 的物质的量浓度c (X )随时间t 变化的曲线如图所示,下列叙述正确的是( )A. 该反应进行到M 点放出的热量大于进行到W 点放出的热量B. T 2下,在0~t 1时间内,v (Y )=1t ba -mol·L -1·min -1 C. M 点的正反应速率v 正大于N 点的逆反应速率v 逆 D. M 点时再加入一定量X ,平衡后X 的转化率减小3. 已知:CO 2(g )+3H 2(g )⇌CH 3OH (g )+H 2O (g ) ΔH =-49. 0 kJ·mol -1。
一定条件下,向体积为1 L 的恒容密闭容器中充入1 mol CO 2和3 mol H 2,测得CO 2和CH 3OH (g )的浓度随时间变化曲线如图所示。
下列叙述中正确的是( )A. 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率B. 从反应开始到平衡,用H2表示的平均反应速率v(H2)=0. 225 mol·L-1·min-1C. 13 min时,向容器中充入2 mol氦气,该反应的化学反应速率增加D. 13 min时,向容器中充入2 mol氦气,CO2的转化率增加4. 有如下可逆反应:A(g)+B(s)⇌C(s)+D(g)ΔH>0。

高考化学二轮备考高频考点知识讲解与训练化学反应速率、平衡图像1.臭氧在烟气脱硝中的反应为2NO 2(g)+O 3(g)N 2O 5(g)+O 2(g)。
若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是( )AB平衡后升温,NO 2含量降低0~2 s 内,v (O 3)=0.2 mol ·L -1·s -1CDv 正:b 点>a 点b 点:v 逆>v 正恒温,t 1时再充入O 3答案 C解析 由图可知该反应为放热反应,平衡后升高温度,NO 2含量升高,A 项错误;0~2 s 内,v (O 3)=0.1 mol ·L -1·s -1,B 项错误;NO 2含量相同时,升高温度,速率增大,v 正:b 点>a 点,b 点反应逆向进行,故v 逆>v 正,C 项正确;t 1时再充入O 3,平衡正向移动,v正>v 逆,D 项错误。
2.在恒容密闭容器中进行反应:2CO 2(g)+6H 2(g)C 2H 5OH(g)+3H 2O(g) ΔH 。
在某压强下起始时按不同氢碳比⎣⎢⎡⎦⎥⎤n (H 2)n (CO 2)投料(如图中曲线①②③),测得CO 2的平衡转化率与温度的关系如图所示,下列有关说法正确的是( )A .该反应的ΔH >0B .氢碳比:①<②<③C .其他条件不变的情况下,增大容器的体积可提高CO 2的转化率D .若起始CO 2的浓度为2 mol ·L -1、H 2为4 mol ·L -1,在图中曲线③氢碳比条件下进行,则400 K 时该反应的平衡常数数值约为1.7 答案 D解析 根据图像可知,在氢碳比相等的条件下,随着温度的升高,CO 2的转化率降低,说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应,ΔH <0,A 错误;氢碳比越大,CO2的转化率越高,根据图像可知,在温度相等的条件下,CO2的转化率:①>②>③,则氢碳比:①>②>③,B错误;正反应是气体体积减小的反应,因此其他条件不变的情况下,缩小容器的体积,压强增大,平衡向正反应方向移动,可提高CO2的转化率,C错误;根据图像可知,400 K时曲线③中CO2的转化率是50%,这说明消耗CO21 mol·L-1,则消耗氢气3 mol·L-1,生成乙醇和水蒸气分别是0.5 mol·L-1、1.5 mol·L-1,剩余CO2和氢气分别是1 mol·L-1、1 mol·L-1,该温度下平衡常数K=0.5×1.5312×16≈1.7,D正确。

热点题型9化学反应速率与化学平衡图像题热点一利用速率-时间图像的“断点”探究外因对化学反应速率和化学平衡的影响1.当可逆反应达到一种平衡后,若某一时刻外界条件发生改变,都可能使速率-时间图像的曲线出现不连续的情况,根据出现“断点”前后的速率大小,即可对外界条件的变化情况作出判断。
2.速率-时间图像(1)改变反应物的浓度(无断点)(2)改变生成物的浓度(无断点)(3)改变气体体系的压强(有断点)①对于正反应方向为气体体积增大(或减小)的反应②对于反应前后气体体积不变的反应(4)改变温度(有断点)对于正反应放热(或吸热)的反应(5)加催化剂(有断点)(1)条件增强,曲线在原图像的上方;条件减弱,曲线在原图像的下方。
(2)浓度改变时,图像曲线一条无断点,一条有断点;其他条件改变时,图像曲线均有断点。
1.对于反应2SO2(g)+O2(g)2SO3(g)ΔH<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响。
下列条件与图像不相符的是(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)()解析:选C。
分析时要注意改变条件瞬间v正、v逆的变化。
增加氧气的浓度,v正增大,v逆瞬间不变,A项正确;增大压强,v正、v逆都增大,v正增大的倍数大于v逆,B项正确;升高温度,v正、v逆都瞬间增大,v逆增大的倍数大于v正,C项错误;加入催化剂,v正、v逆同时同等倍数增大,D项正确。
2.在一密闭容器中发生反应N2(g)+3H2(g)2NH3(g)ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:(1)处于平衡状态的时间段是________(填字母,下同)。
A.t0~t1B.t1~t2C.t2~t3 D.t3~t4E.t4~t5F.t5~t6(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强B.减小压强C.升高温度D.降低温度E.加催化剂F.充入氮气t1时刻________;t3时刻________;t4时刻________。


高考化学复习考点题型讲解与练习命题角度1 有关速率的图像问题1.(2022·陕西交大附中分校高三月考)下列图示与对应的叙述相符的是()A.图1表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为吸热反应B.图2中a、b曲线均表示反应CO(g)+2H2(g)CH3OH(g)的物质能量与反应过程的变化关系,b曲线可能使用了催化剂C.图3表示25℃时用0.1000mol·L-1醋酸滴定40.00mL0.1000mol·L-1NaOH溶液得到的滴定曲线D.图4表示向2mL5%的H2O2溶液中分别滴加0.1mol·L-1Fe3+和Cu2+(两溶液的阴离子相同)各1mL,生成氧气的体积随时间的变化,表明Cu2+能使反应更快2.(2022·杭州高级中学高三月考)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气进行回收,使SO2转化生成S。
催化剂不同,其他条件相同(浓度、温度、压强)情况下,相同时间内SO2的转化率随反应温度的变化如下图,下列说法不正确的是()A.不考虑催化剂价格因素,选择Fe2O3作催化剂可以节约能源B.选择Fe2O3作催化剂,最适宜温度为340℃左右C.a点后SO2的转化率减小的原因可能是温度升高催化剂活性降低了D.其他条件相同的情况下,选择Cr2O3作催化剂,SO2的平衡转化率最小3.(2022·南京师大附中高三期末)下列图示与对应的叙述相符的是()A.图甲表示镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高B.图乙表示室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO2-4)的关系曲线,说明溶液中c(SO2-4)越大c(Ba2+)越小C.图丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数w(B)>w(A)D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0命题角度2有关化学平衡的图像问题4.(2022·潍坊模拟)乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)C2H5OH(g)ΔH。

第1页共16页2023年高考化学总复习:化学反应速率与化学平衡图像
1.(2020江苏南京金陵中学高二上学情调研,)某温度下,在2L 恒容密闭容器中投入一定量的A、B 发生反应:3A (g )+b B (g
)c C (g )ΔH =-Q kJ/mol (Q >0),12s 时生成C 的物质的量为0.8mol (反应进程如图所示)。
下列说法正确的是(
)
A.图中交点时A 的消耗速率等于A 的生成速率
B.0~2s 内,用A 表示的反应速率为0.15mol/(L·s )
C.化学计量数之比b ∶c =1∶4
D.12s 内,反应放出0.2Q kJ 热量
2.(2021江苏南通高级中学高二上月考,)一定温度下,向容积为4L 的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,下列对反应的推断合理的是(
)
A.该反应的化学方程式为3B+4C
6A+3D
B.反应进行到1s 时,v (A )=v (D )
C.反应进行到6s 时,B 的平均反应速率为0.025mol·L -1·s
-1。
2025届高考化学复习:历年优质真题、模拟题专项(化学反应速率及化学平衡图像分析)阶梯练习 1.[2024ꞏ重庆市质量检测]顺1,2-二甲基环丙烷(A)和反1,2-二甲基环丙烷(B)可发生如下异构化反应,图甲~丁为在压强恒定为100 kPa时,不同条件下进行该异构化反应过程中A、B的物质的量分数与反应时间的关系图(图中“○”表示A,“◇”表示B)。
下列说法正确的是()A.图甲达到平衡时,A的转化率αA=50%B.四幅图中,图乙的化学平衡常数K最大C.图丙和图丁的反应温度相同D.图丁达到平衡后,增大压强能提高B的物质的量分数2.[2024ꞏ专题综合测试]下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是()A.①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p23.[2024ꞏ安徽卷]室温下,为探究纳米铁去除水样中SeO2-4的影响因素,测得不同条件下SeO2-4浓度随时间变化关系如图。
实验序号水样体积/mL 纳米铁质量/mg 水样初始pH①50 8 6②50 2 6③50 2 8下列说法正确的是()A.实验①中,0~2小时内平均反应速率v(SeO2-4)=2.0 molꞏL-1ꞏh-1B.实验③中,反应的离子方程式为:2Fe+SeO2-4+8H+===2Fe3++Se+4H2OC.其他条件相同时,适当增加纳米铁质量可加快反应速率D.其他条件相同时,水样初始pH越小,SeO2-4的去除效果越好4.一定量的CO2与足量的碳在容积可变的恒压密闭容器中发生反应:C(s)+CO2(g)⇌2CO(g)。
平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(p分)=气体总压(p总)×体积分数。
题型03 化学反应速率和化学平衡图像分析一、选择题1.(2023-2024高二上·陕西渭南·期中)在密闭容器中进行反应:X(g)+3Y(g)ƒ2Z(g),有关下列图像的说法错误的是A.依据图a可判断逆反应ΔH>0B.在图b中,虚线可表示使用了催化剂C.图c可表示增大压强对正逆化学反应速率变化D<0D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的H2.(2023-2024高二上·陕西·期中)某温度下,在2 L恒容密闭容器中投入一定量的A、B,发生反应:()()()()ƒ,12 s时生成C的物质的量为0.8 mol(反应进程如图所示)。
下列说法中正确3A g+bB g cC g+2D s的是A.12 s时,B的转化率为40%B.0∼2 s内,D的平均反应速率为0.2 mol⋅L1-⋅s1-v B=2v CC.化学计量系数之比b:c=1:2,且()()D.图中两曲线相交时,A的消耗速率等于A的生成速率3.(2023-2024高二上·福建三明·期中)下列叙述与图中甲、乙、丙、丁相符合的是甲:FeCl3+3KSCNƒFe(SCN)3+3KCl乙:CO2(g)+3H2(g)ƒCH3OH(g)+H2O(g)丙:H 2(g)+I 2(g)ƒ2HI(g)丁:2SO 2(g)+O 2(g)ƒ2SO 3(g)A .图甲是向平衡后的溶液中加入少量KCl 晶体,反应速率随时间变化的图像B .图乙恒容密闭容器中,若起始量相同达平衡时转化率:α(Ⅰ)<α(Ⅱ)C .图丙中a 改变的条件一定是加入催化剂D .图丁中K 为化学平衡常数,P 点处化学反应速率v 正>v 逆4.(2023-2024高二上·宁夏吴忠·期中)反应mA(g)+nB(g)ƒpC(g)+qD(g)的图像如下:A .m+n>p+qB .m+n<p+qC .m >p+qD .ΔH<05.(2023-2024高二上·山东威海·期中)对于可逆反应()()()223N g 3H g 2NH g Δ0H +<ƒ,下列研究目的和示意图相符的是A .研究压强对反应的影响()21p p >B .研究温度对反应的影响22mol NO ,发生反应:()()()()2222C s 2NO g N g 2CO g ++ƒ,在相同时间内测得各容器中2NO 的转化率与容器体积的关系如图所示。
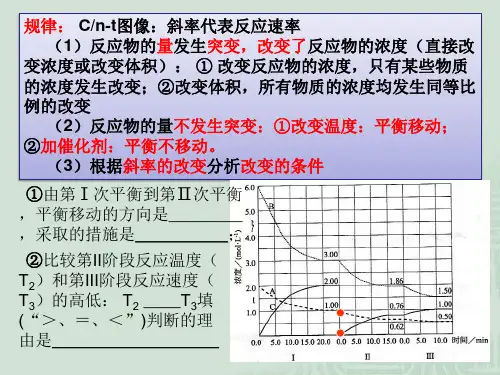
化学反应速率和化学平衡图像
班别姓名学号1、速率——时间图
此类图像定性揭示了V
正、V
逆
,对于条件的改变随时间变化的规律,体现了平
衡移动的方向和平衡的特征。
认识此类图像的关键:若改变单一物质的浓度,图像是连续的,若改变体系的温度和压强,则图像不连续。
对于反应:
mA(气)+nB(气)pC(气)+qD(气) +Q,请根据提示完成以下的图像(→表示平衡向正反应方向移动,←表示平衡向逆反应方向移动)。
( )( )( )(1)增大反应物浓度(2)减少生成物浓度(3)增大生成物浓度
()( )()(4)减少反应物浓度(5)升高温度(Q>0)(6)降低温度(Q>0)
()()
()
(7)升高温度(Q<0)(8)降低温度(Q<0)(9)加压(m+n=p+q)
()( )( ) (10)减压(m+n=p+q) (11)加压(m+n>p+q) (12)减压(m+n>p+q)
()()() (13)加压(m+n<p+q)(14)减压(m+n<p+q)(15)加入催化剂2、浓度(物质的量)—时间图
此类图像能说明平衡体系中各组分的浓度(或物质的量)在反应过程中的变化情况,根据图像可看出反应物和生成物,以及浓度的改变推出各组分的计量数之间的关系,进而推写化学方程式。
对于图(16):
(16)
(17)
(1)、该反应的化学方程式;
(2)、反应开始至3min末,Y的反应速率为;
(3)、该反应是由开始的(正反应、逆反应、正逆么应同时)
3、全程速率—时间图
此类图像的分析要抓住各个阶段的主要矛盾——影响速率的主要因素。
如Z n与足量的盐酸反应,反应速率随时间的变化情况如图(17)所示。
其中A~B速率变化的原因是;B~C速率变化的原因是。
4、含量(或转化率)—时间—温度(或压强)图
此类图像的分析应注意3个方面的问题:
(1)纵坐标表示的意义;即是反应物还是生成物的含量,还是反应物的转化率?(2)达平衡的时间:温度越高(或压强越大),反应的速率越大,达到平衡的时间越短。
(3)平衡线的高低:根据纵坐标的含义与反应方程式的特点(放热或吸热以及反应前后气体分子数的关系)来判断平衡线的高低。
以反应mA(气)+nB(气)pC(气)+qD(气)+Q为例,图示如下:
(18)当P一定,则Q (19)当T一定,则m+np+q
(20)当T一定,则m+n p+q (21)当T一定,则m+n p+q
(22)当P一定,则Q (23)当P一定,则Q
(24)当T一定,则m+n p+q (25)当T一定,则m+n p+q
5、恒温(或恒压)线
此类图像的分析应注意以下3个方面:
(1) 纵坐标所表示的意义:是百分含量还是转化率;
(2) 根据横轴与反应方程式的特点判断曲线的走向;
(3)作纵轴的平行线,依据反应方程式的特点与坐标的含义来判断平衡线的相对位置。
+nB(气)pC(气)+qD(气) +Q为例,图示如下:以反应mA(
气)
(26)当Q>0,则m+np+q (27)当Q<0,则m+np+q
(28)当m+n< p+q,则Q0(29)当m+n> p+q,则Q 0
(30)当Q<0,则m+n p+q
六、速率—温度(或压强)图
此类图像的分析应注意条件的变化与正逆反应速率变化的关系,即升高温度(增大压强)正逆反应都增大,只是增大的程度应依据反应方程式的特点来确定。
以反应mA(
+nB(气)pC(气)+qD(气)+Q为例,图示如下:
气)
(31)Q 0 (32)Q 0
化学平衡图形题练习:
1、右图表示外界(温度、压强)的变化对下列反应
的影响L(s)+3G(g)2R(g)(正反应为热反应),
在图中,y轴是指
A、平衡混合物中R的百分含量
B、平衡混合物中G的百分含量
C、G的转化率D、L的物质的量
2、反应A(g)+B(g)C(g)在密闭容器中进行。
若存在三种情况:①200℃,无催化剂;②500℃无催化
剂;③500℃有催化剂;情况①是曲线,情况②
是曲线,情况③是曲线,
3、右图是关于反应A2(g)+3B2(g)2C(g)(正反应
为放热反应)的平衡移动图形,影响平衡移动的原因是
A、升高温度,同时加压
B、降低温度,同时减压
C、增大反应物浓度,同时使用催化剂
D、增大反应物浓度,同时减小生成物浓度
4、可逆反应A(g)+B(g)2C(g)在不同的温度下经过一时
间,混合物中C的体积分数与温度的关系如图所示,那么:⑴反
应在温度下达到平衡。
⑵此反应的正反应为热反
应;⑶由T1向T2变化时正反应速率逆反应速率(填>、
向T4变化时正反应速率逆反应速率
<、=);⑷由T
3
5、有一化学平衡mA(g)+nB(g)PC(g)+qD(g),右图表
示的转化率与压强、温度的关系。
由此得出的正确结论是
A、正反应是吸热反应,(m+n)>(p+q)
B、正反应是吸热反应,(m+n)<(p+q)
C、正反应是放热反应,(m+n)>(p+q)
D、正反应是放热反应,(m+n)<(p+q)
6、对可逆反应A(g)+B(g)===C(g)(正反应为吸热反应),下列图像正确的是
7、对于2A(g)+B(g)2C(g)(正反应为放热反应),符合该反应的下列图象:
8、右图中a曲线表示一定条件下可逆反应
X(g)+Y(g)2Z(g)+W(S)(正反应为放热反应)的反应
过程。
若使a曲线变为b曲线,可采用的措施是
A、加入催化剂
B、增大Y的浓度
C、降低温度
D、增大体系压强
9、下图表示平衡混合物中X的体积分数在不同的压强下随
温度变化的情况,在下述的平衡体系中,X可以代表横线标明的物质(反应中各物质均为气态)是( )
A、N2+3H2 2NH3 正反应为放热反应
B、H2+I22HI 正反应为放热
反应
C、2SO3 2SO2+O2正反应为吸热反应
D、4NH3+5O24NO+6H2O 正反应为吸热反
应
10、可逆反应L(S)+G(g)2R(g)由右图分析Y所
表示的量反应的能量变化为( )
A、R的体积分数,正反应为放热反应
B、G的体积分数,正反应为吸热反应
C、G的转化率,正反应为放热反应
D、R的分解率,正反应为放热反应
11、可逆反应2A+B 2C(g)正反应为放热反应,随温度变
化气体平衡相对分子质量如图所示。
则下列叙述正确的是
A、A和B可能都是固体
B、A和B一定都是固体
C、若B为固体则A一定为气体
D、A和B可能都是气体
12、在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L。
此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是( )
A、正反应为吸热反应L是气体
B、正反应为放热反应L是气体
C、正反应为吸热反应L是固体
D、正反应为放热反应L是固体或液体
13、在一定条件下,将X和Y两种物质按不同的比
例放入密闭容器中反应,达到平衡后,测得X,Y的
转化率与起始时两物质的物质的量之比nx:ny的
关系如图所示,则X和Y的反应方程式可表示为
()
A、3X+Y Z
B、2X+Y Z
C、X+3Y Z
D、3X+Y2Z
14、今有X(g)+Y(g)2Z(g)正反应为放热反
应,从反应开始经过t1S后达到平衡状态t2S时,由于
条件改变,平衡受到破坏,在t
S时又到平衡。
根据
3
右图回答:从t2S到t3S间的曲线变化是由哪种条
件引起的
A、增大X或Y的浓度B、增在压强
C、增大Z的浓度D、升高温
度
15、下图表示反应:N2+3H2 2NH3建立平衡的过程,如果用纵坐标表示物质的量浓度,横坐标表示时间来绘制这一反应的图形,则下列图形中一举正确的是
16、在一密闭容器中进行如下反应:
A(g)+B(g)2C(g)+2D,此反应符合右图
(其中C%是混合物中C的质量分数,t为反应时
间)对此反应的叙述正确的是
A、正反应为吸热反应,D是固体
B、正反应为吸热反应,D是气体
C、正反应为放热反应,D是固体或液体
D、正反应为放热反应,D是气体。