第4章 线性扫描伏安法分析
- 格式:ppt
- 大小:631.50 KB
- 文档页数:24

循环伏安法原理:循环伏安法(CV)是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63-在电极上还原,反应为:Fe(CN)63-+e-→Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为:Fe(CN)64--e-→Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依据Faraday定律估算,, 其中m为反应的摩尔量, n为电极反应中的得失电子数,F为图2 氧化还原cv曲线图图1 cv图中电势~时间关系图3 Ag在Pt电极上电结晶过程的CV图0.01mol/LagNO3+0.1mol/LKNO3Faraday常数(96485 C.molmnFidtQt==∫0-1)。


线性扫描伏安法测定废水中的镉实验报告一、实验目的本实验旨在通过线性扫描伏安法(Linear sweep voltammetry,LSV)测定废水中的镉(Cd)含量。
线性扫描伏安法是一种常用的电化学分析方法,具有高灵敏度、高选择性以及快速测量的优点。
通过本实验,能够提高对电化学分析方法的理解,掌握线性扫描伏安法的操作流程,并学会用该方法测定废水中的重金属离子。
二、实验原理线性扫描伏安法是一种在电极上施加线性电压扫描的电化学分析方法。
在一定的电位范围内,随着电压的改变,电流也会发生相应的变化。
本实验中,我们将使用此方法测定镉离子在电极上的氧化还原反应。
当电压逐渐增加时,镉离子会从溶液中还原并沉积在电极上,产生电流响应。
通过测量电流响应值,可以推算镉离子的浓度。
三、实验步骤1.准备实验仪器和试剂:线性扫描伏安仪、废水样品、镉标准溶液、恒电位仪、电解电极、磁力搅拌器等。
2.配制镉标准溶液:准确称取一定量的镉标准物质,用超纯水配制成浓度为1000mg/L的镉标准溶液。
3.绘制标准曲线:分别取适量的镉标准溶液,用超纯水稀释至不同浓度,分别为0.1mg/L、0.5mg/L、1.0mg/L、2.5mg/L、5.0mg/L。
在相同的实验条件下,利用线性扫描伏安仪进行测量,绘制电流响应值与镉浓度的关系曲线。
4.测定废水样品:将废水样品进行稀释,使其中镉离子浓度处于标准曲线范围内。
然后,用线性扫描伏安仪进行测量,记录电流响应值。
5.数据处理:根据测量的电流响应值和标准曲线,推算废水样品中镉离子的浓度。
四、实验结果及数据分析1.标准曲线数据:通过线性扫描伏安法测量不同浓度的镉标准溶液,得到电流响应值与镉浓度的关系曲线。
根据曲线拟合得到方程为:y = 0.113x +0.028 (R² = 0.995),其中y为电流响应值,x为镉浓度(单位:mg/L)。
2.废水样品测量结果:通过测量废水样品,得到电流响应值为0.45μA。

线性扫描伏安法与循环伏安法实验**大学本科实验报告专用纸课程名称 仪器分析实验 成绩评定 实验项目名称 线性扫描伏安法与循环伏安法实验 指导教师 实验项目编号 实验项目类型 实验地点 学生姓名 学号 学院 系 化学系 专业 实验时间2015年11月13日下午~11月13日下午 温度 ℃湿度一.实验目的1.掌握线性扫描伏安法及循环伏安法的原理;2.掌握微机电化学分析系统的使用及维护。
3.掌握利用线性扫描伏安法进行定量分析及利用循环伏安法判断电极反应过程。
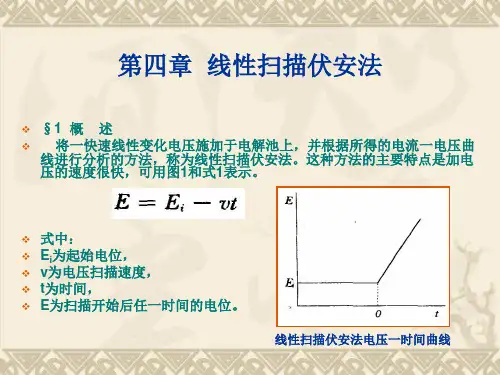
二.实验原理1. 线性扫描伏安法:线性扫描伏安法是在电极上施加一个线性变化的电压,记录工作电极上的电解电流的方法。
记录的电流随电极电位变化的曲线称为线性扫描伏安图。
⑴可逆电极反应的峰电流如下:c v AD n i p 121351069.2⨯=式中,n 为电子交换数;A 为电极有效面积;D 为反应物的扩散系数;v 为电位扫描速度;c 为反应物(氧化态)的本体浓度。
当电极的有效面积A 不变时,上式可简化为:c Kv i p 1=即峰电流与电位扫描速度v 的1/2次方成正比,与反应物的本体浓度成正比。
这就是线性扫描伏安法定量分析的依据。
⑵可逆电极反应,峰电位与扫描速度无关,nF RT E E p /1.121±=电极反应为不可逆时,峰电位p E 随扫描速度v 增大而负(或正)移。
2. 循环伏安法:循环伏安法的原理与线性扫描伏安法相同,只是比线性扫描伏安法多了一个回扫,所以称为循环伏安法。
循环伏安法是电化学方法中最常用的实验技术,也是电化学表征的主要方法。
循环伏安法有两个重要的实验参数,一是峰电流之比,二是峰电位之差。
对于可逆电极反应,峰电流之比pa pc i i /(阴极峰电流pc i 与阳极峰电流pa i 之比)的绝对值约等于1。
峰电位之差p E ∆(阴极峰电位pc E 与阳极峰电位pa E 之差)约为60mV(25℃),即 nF RT E p /22.2=∆。

电化学测试锂离子电池稳态测量技术-线性电势扫描伏安法
(LSVCV)
锂离子电池电极材料在电池充放电过程中一般经历以下几个步骤:①溶剂化的锂离子从电解液内迁移到电解液/固体电极的两相界面;②溶剂化的锂离子吸附在电解液/固体电极的两相界面;③去溶剂化;④电荷转移,电子注入电极材料的导带,吸附态的锂离子从电解液相迁移至活性材料表面晶格;⑤锂离子从活性材料表面晶格向内部扩散或迁移;⑥电子从集流体向活性材料的迁移。
线性电势扫描法在电化学测量中有着广泛的应用,常用于:①判断电极体系中可能发生的电化学反应;②判断电极过程的可逆性;③判断电极反应的反应物来源;
④研究电极活性物质的吸脱附过程。
锂离子电池基础科学问题(Ⅻ Ⅰ)——电化学测量方法. 凌仕刚,吴娇杨,张舒,高健,王少飞,李泓.
Das S R,Majumder S B,Katiyar R S. Kinetic analysis of the Li ionintercalation behavior of solution derived nano-crystalline lithiummanganate thin films[J]. Journal of Power Sources,2005,139:261-268.
Tang S B,Lai M O,Lu L. Li-ion diffusion in highly (003) oriented LiCoO2 thin film cathode prepared by pulsed laser deposition[J]. Journal of Alloys and Compounds,2008,449(1-2):300-303.。


•由于电压扫描速度很快且消除了部分充电电流,线性扫描极谱的灵敏度为10-6~10-7mol/L1/21/2p 1/2p 1/22/31/6Ilkovic 605Randles-Sevcik / 3.3d d i n m τA i Kn i i D υcD cn ===经典直流极谱方程:线性扫描极谱方程pc 1/2pa 1/228mV 28mV pc cathode peak pa anode peak E E nE E n=-=+线性扫描极谱峰电位与经典直流极谱半波电位的关系:表示阴极()峰()表示阳极()峰()•分辨率高,两种物质的半波电位相差100 mV即可以分辨•消除前波对后波的影响•如果线性扫描达到一定电位后,以相同的扫描速度回到原来的起始电位,情况会怎样?•相当于单向扫描变为往返扫描循环伏安(CV,Cyclic Voltammetry)•三角波扫描E24681012141618Time (s)pc 1/2pa 1/2p pa pc 1/21/21/c2p p a p p 2828 (mV) (mV)56Δ (mV)1; υυE E E E n nE E E ni KnD A i c i i =-+=-=≈==循环伏安阴极峰与阳极峰电位关系阴极峰与阳极峰电位关系与线性扫描伏安类;受扩散控制时,循环伏安的峰电流与似描度:扫速成正比循环伏安法的应用•循环伏安作为一种成分分析方法并不比线性扫描伏安法优越(因为循环伏安只是多了一次回扫,灵敏度并没有提高)•但循环伏安是电极过程机理研究的重要手段•可用于研究电极反应的性质、机理及电极过程动力学参数等•对于可逆电极过程来说,循环伏安阳极峰和阴极峰的电位差:p pa pc 56Δ (mV) E E En=-=•实际情况下,△E p 与循环电压扫描中换向时的电位有关,也与实验条件有一定的关系,其值会在一定范围内变化。
一般认为当△E p 为55/n ~65/n mV 时,该电极反应是可逆过程。

循环伏安法原理:循环伏安法(CV )是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多 研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为:Fe(CN)63-+e - → Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为: Fe(CN)64- - e - → Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV 研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依据Faraday 定律估算,, 其中m 为反应的摩尔量, n 为电极反应中的得失电子数,F 为 图2 氧化还原cv 曲线图图1 cv 图中电势~时间关系图3 Ag在Pt电极上电结晶过程的CV图0.01mol/LagNO3+0.1mol/LKNO3Faraday常数(96485 C.molmnFidtQt==∫0-1)。


电池单体研发测试设备中的电化学性能分析方法随着电动汽车和可再生能源等领域的快速发展,电池技术作为能源存储和使用的核心,受到了越来越多的关注和研究。
为了评估电池单体的性能,并提高其电化学性能,研发测试设备中的电化学性能分析方法变得非常重要。
本文将介绍一种常用的电化学性能分析方法,以帮助研究人员更好地评估电池单体的性能。
1. 循环伏安法 (Cyclic Voltammetry, CV)循环伏安法是一种常用的电化学测试方法,通过在一定电流范围内改变电压,测量所施加电压和电流之间的关系。
其原理基于电池单体的电位变化和电流响应,进而分析单体的电化学反应和能量特性。
CV可以提供电池单体的电流密度、容量和电位等关键参数,帮助研究人员评估电池的性能和稳定性。
2. 恒流充放电法 (Galvanostatic Charge-Discharge, GCD)恒流充放电法通过在电池单体上施加恒定电流,测量电压随时间的变化情况,以获取电池单体的充放电曲线。
通过分析充放电过程中的电压变化,可以获得电池单体的容量、效率和能量损失等信息。
GCD方法可用于评估电池单体的充电和放电效果,了解其性能的稳定性和循环寿命。
3. 交流阻抗法 (Electrochemical Impedance Spectroscopy, EIS)交流阻抗法是一种通过施加交流电信号测量电池单体的电阻和电容等参量的方法。
该方法可以获取电极和电解液之间的界面阻抗,以及电池单体的内部电阻和电化学反应速率等信息。
EIS方法可以提供电池单体的内部结构和界面特性,用于评估电池的性能和循环寿命。
此外,EIS还可以用于检测电池单体的容量衰减和界面损伤等问题。
4. 差示脉冲伏安法 (Differential Pulse Voltammetry, DPV)差示脉冲伏安法是一种适用于电池单体较小变动的电化学分析方法。
通过施加一系列尖锐的脉冲电压,测量电化学反应的峰值电流和电位,以获取电池单体的反应速率和电化学活性等信息。
循环伏安法原理:循环伏安法(CV )是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多 研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为:Fe(CN)63-+e - → Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为: Fe(CN)64- - e - → Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV 研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依图2 氧化还原cv 曲线图图1 cv 图中电势~时间关系据Faraday 定律估算,, 其中m 为反应的摩尔量, n 为电极反应中的得失电子数,F 为Faraday 常数(96485 C.molmnFidtQt==∫0-1)。
如图3的CV 图中,阴影部分对应的是铂上满单层氢脱附的电量,为210 μC/cm 2。