第4章线性扫描伏安法讲述资料
- 格式:ppt
- 大小:688.50 KB
- 文档页数:26

循环伏安法原理:循环伏安法(CV)是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63-在电极上还原,反应为:Fe(CN)63-+e-→Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为:Fe(CN)64--e-→Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依据Faraday定律估算,, 其中m为反应的摩尔量, n为电极反应中的得失电子数,F为图2 氧化还原cv曲线图图1 cv图中电势~时间关系图3 Ag在Pt电极上电结晶过程的CV图0.01mol/LagNO3+0.1mol/LKNO3Faraday常数(96485 C.molmnFidtQt==∫0-1)。

电化学中lsv曲线正扫和负扫全文共四篇示例,供读者参考第一篇示例:电化学领域中的线性扫描伏安法(Linear Sweep Voltammetry,LSV)是一种常用的实验手段,通过在电化学反应中施加线性变化的电位来研究物质在电解质溶液中的电化学行为。
在LSV实验中,正扫和负扫是两种常见的扫描方式,它们分别在不同条件下提供了关于化学反应动力学和热力学的重要信息。
在正扫过程中,电化学反应通过在电极表面施加逐渐增加的电位而进行。
在此过程中,电极上的电子转移过程被激发,并且在电位达到一定值后,氧化还原峰开始出现在LSV曲线上。
这些峰的位置和形状提供了关于反应物种和反应机理的信息。
通过测定氧化还原峰的峰电位和峰电流,可以确定物质的氧化还原动力学参数,例如反应速率常数和传递系数。
正扫过程还可以用来研究电极表面的催化活性以及化学反应的动力学响应。
在实际应用中,研究正扫和负扫过程的选择取决于所研究的体系和目标。
一般来说,正扫过程更适合研究电化学反应的动力学特性,而负扫过程更适合研究反应物种的浓度和电极材料的稳定性。
正扫和负扫还可以结合起来进行实验,通过比较两种扫描过程的结果,可以更全面地理解电化学反应的机理和动力学特性。
除了正扫和负扫过程之外,LSV实验还可以通过改变扫描速度、扫描范围和电解质条件来进一步优化实验结果。
通过调整扫描速度,可以研究电化学反应的动力学响应速率;通过改变扫描范围,可以观察氧化还原峰的变化和电化学反应的过程;通过调整电解质条件,可以改变反应物种的浓度和电解质的离子传递速率,进而影响反应过程。
正扫和负扫是LSV实验中重要的两种扫描方式,它们可以提供关于电化学反应的不同信息,从而深入理解反应机理和动力学特性。
通过综合应用正扫、负扫和其他优化方法,可以更准确地研究电化学反应中的各种化学过程,为电化学研究和应用提供重要的理论基础和实验指导。
【The article is about the positive and negative sweep in LSV curve for 2000 words】.第二篇示例:电化学中的LSV曲线是一种常用的实验手段,用于研究电极的电化学行为。

线性扫描极谱和伏安分析特点由于电压扫描速度很快且消除了部分充电电流,线性扫描极谱的灵敏度为10-6~10-7mol/L1/21/2p 1/2p 1/22/31/6Ilkovic 605Randles-Sevcik / 3.3d d i n m τA i Kn i i D υcD cn ===经典直流极谱⽅程:线性扫描极谱⽅程pc 1/2pa 1/228mV 28mV pc cathode peak pa anode peak E E nE E n=-=+线性扫描极谱峰电位与经典直流极谱半波电位的关系:表⽰阴极()峰()表⽰阳极()峰()分辨率⾼,两种物质的半波电位相差100 mV即可以分辨消除前波对后波的影响如果线性扫描达到⼀定电位后,以相同的扫描速度回到原来的起始电位,情况会怎样?相当于单向扫描变为往返扫描循环伏安(CV,Cyclic Voltammetry)?三⾓波扫描E24681012141618Time (s)pc 1/2pa 1/2p pa pc 1/21/21/c2p p a p p 2828 (mV) (mV)56Δ (mV)1; υυE E E E n nE E E ni KnD A i c i i =-+=-=≈==循环伏安阴极峰与阳极峰电位关系阴极峰与阳极峰电位关系与线性扫描伏安类;受扩散控制时,循环伏安的峰电流与似描度:扫速成正⽐循环伏安法的应⽤循环伏安作为⼀种成分分析⽅法并不⽐线性扫描伏安法优越(因为循环伏安只是多了⼀次回扫,灵敏度并没有提⾼)但循环伏安是电极过程机理研究的重要⼿段可⽤于研究电极反应的性质、机理及电极过程动⼒学参数等对于可逆电极过程来说,循环伏安阳极峰和阴极峰的电位差:p pa pc 56Δ (mV) E E En=-=实际情况下,△E p 与循环电压扫描中换向时的电位有关,也与实验条件有⼀定的关系,其值会在⼀定范围内变化。
⼀般认为当△E p 为55/n ~65/n mV 时,该电极反应是可逆过程。
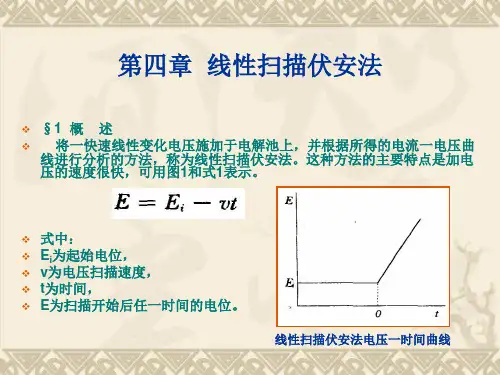


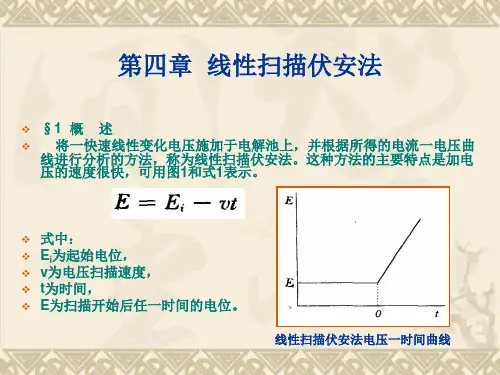
实验二线性扫描伏安法测定镉离子一、实验原理:线性扫描伏安法是将线性增加的电位(电位与时间呈线性关系)施加于电解池的工作电极和参比电极之间。
工作电极是可极化的微电极,如悬汞电极或其他固体电极;辅助电极为Pt电极;参比电极为Ag/AgCl电极。
辅助电极和参比电极具有相对较大的表面积,不可极化。
通常电位扫描速率介于0.001~ 0.1 V/ s,可进行单次扫描或多次扫描。
线性扫描伏安法尤其适用于有吸附性能物质的测定。
镉是对人体健康威胁最大的有害元素之一。
本实验采用线性扫描伏安法,根据电流-电位曲线所得的峰电流与被测物的浓度呈线性关系来定量测定样品中镉离子的浓度。
Cd2+在多种底液中都有良好的极谱波。
本实验采用0.2 mol/L KCl作底液,在-0.3 ~ -0.8V进行线性扫描。
Cd2+在悬汞电极上发生如下电极反应:Cd2+ + 2e+ Hg = Cd(Hg)电流峰高与浓度成正比,即I p=Kc,据此进行定量分析。
由于线性扫描法的电位扫描速度较快,不可逆的氧波影响不大,当被测物质浓度较大时不需要除氧。
二、实验目的:1、学习MEC-12B电化学分析仪的操作以及悬汞电极的使用;2、掌握线性扫描伏安法的基本原理。
三、仪器和试剂:1. 仪器:MEC-12B电化学分析仪。
三电极系统:悬汞电极为工作电极;Ag/AgCl电极为参比电极,Pt 电极为辅助电极。
2. 试剂:汞(A.R. );0.2 mol/L KCl溶液;1 mg/mL(即1000ppm)Cd2+贮备液;Cd2+样品溶液(已含0.2 mol/L KCl)四、分析步骤:MEC-12B电化学分析仪的操作方法:依次打开计算机、电化学工作站主机、搅拌器的电源。
将工作电极、参比电极和辅助电极的导线与电化学检测池对应的电极正确连接。
电化学工作站预热10 min。
双击Windows 桌面上的“Mec-12B 多功能分析系统”图标。
1、参数设置:参数设置→采样参数→线性扫描,具体参数如下:2、测量:数据采样→联机采样→保存于12 mL 0.2 mol/L KCl溶液中依次加入0.2 mL 1000 ppm Cd2+贮备液,共加4次。

大 学 化 学Univ. Chem. 2021, 36 (4), 2005071 (1 of 7)收稿:2020-05-27;录用:2020-07-08;网络出版:2020-07-13*通讯作者:cghu@•知识介绍• doi: 10.3866/PKU.DXHX202005071 线性扫描伏安法的基本原理与伏安图解析胡成国*,华雨彤武汉大学化学与分子科学学院,武汉 430072摘要:从线性扫描伏安法的定义和原理出发,通过考察伏安测试的装置和电极反应过程,推测出影响线性扫描伏安图形状的基本要素,即电极反应过程中的异相电子转移与液相传质之间的物质“供求关系”,决定了线性扫描伏安图的形状特征。
在此基础上,结合一系列不同电化学测试条件下的伏安行为,如常规电极与超微电极、可逆与不可逆电极过程、静止电极与旋转圆盘电极以及电催化等,阐述了该“供求关系”对伏安图形状影响的基本规律,为理解线性扫描伏安法的基本原理和数据解析提供参考。
关键词:线性扫描伏安法原理;电极反应过程;伏安图解析;常规与超微电极;可逆性;旋转圆盘电极;电催化反应中图分类号:G64;O6Principles of Linear Sweep Voltammetry and Interpretations ofVoltammogramsChengguo Hu *, Yutong HuaCollege of Chemistry and Molecular Sciences, Wuhan University, Wuhan 430072, China.Abstract: In this paper, we discussed the basic elements which affect the shape of linear sweep voltammograms in the reaction process on the electrode surface, that is, heterogeneous electron transfer and mass transfer in liquid phase. Derived from the basic definition and principle of voltammetry, the “supply-demand” mode between electron and mass transfer determines the characteristics of voltammograms. A series of voltammetric behaviors under different electrochemical testing conditions were discussed, including conventional electrodes and microelectrodes, reversible and irreversible electrode processes, stationary and rotating disk electrodes, and electrocatalysis. The basic laws that affect the shape of voltammograms provide a reference for understanding the fundamental principles of linear sweep voltammetry and data analysis.Key Words: Principle of linear sweep voltammetry; Electrode reaction process;Interpretation of voltammograms; Macro- and ultramicro- electrodes; Reversibility;Rotating disk electrode; Electrocatalytic reaction作为一种重要的电化学测试技术,伏安法是分析学科中最常用的分析方法之一,在食品、环境、材料、能源和生物医学等诸多领域具有非常广泛的应用。

循环伏安法原理:循环伏安法(CV )是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多 研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为:Fe(CN)63-+e - → Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为: Fe(CN)64- - e - → Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV 研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依据Faraday 定律估算,, 其中m 为反应的摩尔量, n 为电极反应中的得失电子数,F 为 图2 氧化还原cv 曲线图图1 cv 图中电势~时间关系图3 Ag在Pt电极上电结晶过程的CV图0.01mol/LagNO3+0.1mol/LKNO3Faraday常数(96485 C.molmnFidtQt==∫0-1)。


循环伏安法原理:循环伏安法(CV )是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多 研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为:Fe(CN)63-+e - → Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为: Fe(CN)64- - e - → Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV 研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依图2 氧化还原cv 曲线图图1 cv 图中电势~时间关系据Faraday 定律估算,, 其中m 为反应的摩尔量, n 为电极反应中的得失电子数,F 为Faraday 常数(96485 C.molmnFidtQt==∫0-1)。
如图3的CV 图中,阴影部分对应的是铂上满单层氢脱附的电量,为210 μC/cm 2。
脉冲技术实验八水中铅、镉离子的电化学检测一、实验目的1、学会用脉冲技术测定微量离子的方法;2、熟悉电化学工作站的使用方法一、实验原理差分脉冲极谱法又称为微分脉冲极谱法,它施加于电化学池的电压和时序关系如图所示。
(a)(b)工作电极的电位首先保持在E i,维持τ`秒,此时不发生电极反应,没有法拉第电流流过。
在τ`秒时,电极电位突然阶跃至E值,维持40—60ms。
在加脉冲期间,在脉冲末期一预定时刻τ开始记录通过电化学池的电流。
脉冲结束时工作电极电位又回复到起始电位,开始下一个脉冲周期。
每个周期的电极电位保持在E i的时间及加脉冲的时间,采样电流的时间和脉冲结束的时间完全相同,仅脉冲电压较前一周期增加△EmV。
记录电流的方法有两种,一是在加脉冲后的预定时刻τ至脉冲结束前的一极短时间间隔内记录电流的积分值,由此称为积分极谱。
二是加脉冲后的时间τ的电流和加脉冲前瞬间(τ`)的电流的差值。
LK2006A 型记录电流的方式为后者。
二、仪器与试剂仪器LK2006A电化学工作站(天津兰力科化学电子高技术有限公司);三电极体系:工作电极为银基汞膜电极或已镀好汞膜的玻碳电极,参比电极为饱和甘汞电极,对电极为铂片电极。
试剂 1.00×10-3 mol·L-1Cd2+标准溶液,1.00×10-3 mol·L-1Pb2+标准溶液,4mol·L-1盐酸。
四、实验步骤1、汞膜电极用湿滤纸沾去污粉擦净电极(银丝)表面,用蒸馏水冲洗后浸入1:1HNO3中,待表面刚变白后立即用蒸馏水冲洗并沾汞。
初次沾汞往往浸润性不良,可用干滤纸将沾有少许汞的电极表面擦匀擦亮,再用1:1HNO3把此汞膜溶解,蒸馏水洗净后重新涂汞膜。
每次沾涂一滴汞(约4~5mg),涂汞需在Na2SO3除O2的氨水中进行。
新制备的汞膜电极应在0.1mol/L KCl(Na2SO3除O2)中于-1.8V(vs.Ag/AgCl电极)阴极化并正向扫描至-0.2V,如此反复扫描3次左右后电极便可使用。