第4章线性扫描伏安法资料
- 格式:ppt
- 大小:688.50 KB
- 文档页数:26

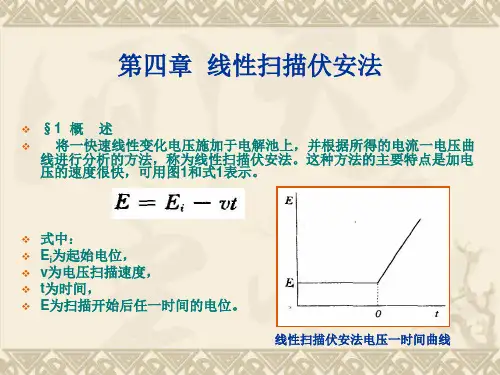
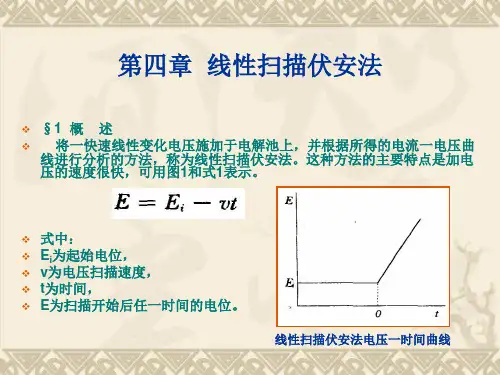
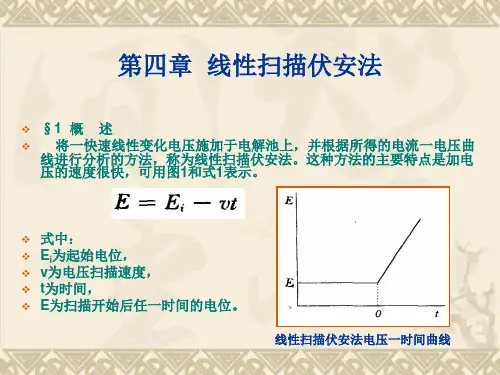
循环伏安法原理:循环伏安法(CV)是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63-在电极上还原,反应为:Fe(CN)63-+e-→Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为:Fe(CN)64--e-→Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依据Faraday定律估算,, 其中m为反应的摩尔量, n为电极反应中的得失电子数,F为图2 氧化还原cv曲线图图1 cv图中电势~时间关系图3 Ag在Pt电极上电结晶过程的CV图0.01mol/LagNO3+0.1mol/LKNO3Faraday常数(96485 C.molmnFidtQt==∫0-1)。

线性扫描伏安法测定水样中的微量铜1、实验目的(1)了解线性扫描伏安法测定的基本原理和方法;(2)学习相关伏安仪的使用方法;(3)学习和掌握标准加入法;2、实验原理与经典极谱法不同,线性扫描伏安法将一锯齿形脉冲电压加在电解池的工作电极上,电压扫描速度比经典极谱法快得多,一般为每秒几十到几百毫伏。
由于电压扫描速度特别快,当达到待测物质析出的电位时,该物质在电极上迅速还原,产生很大的电流。
随后,电位继续变负,电极表面待测物质浓度迅速降低,由于电解时间的增加,扩散层厚度迅速增大,从而导致电流迅速下降,电流~电压关系呈现峰形。
当底液及其它条件一定时,其峰电位E p与被测物的性质及底液有关,而其峰电流i p则与被测物质浓度呈线性关系:i p=Kc据此可进行定量分析。
本实验采用标准加入法,测定水样中微量铜的含量,即在未知浓度的含铜水样中,先加入一定浓度的NaNO3作为支持电解质,测量其峰电流,然后逐次加入一定浓度的标准铜,每加入一次铜测量一次峰电流,最后用峰电流对标准铜的浓度作图,得一直线,它的外延线与浓度轴的交点即为水样中铜的含量。
3、仪器与药品XJP-821(C)型新极谱仪;ATA-1B型旋转圆盘电极,ZF-10B数据采集存贮器;工作电极:玻碳电极;参比电极:饱和甘汞电极;辅助电极:Pt电极。
100微升微量移液器,10毫升量筒,5毫升移液管,电解池;Cu2+标准贮备液:准确配制1.00mg·mL-1的Cu2+标准贮备液;支持电解质溶液:1.0 mol·L-1 NaNO3+1.0 mol·L-1HNO3溶液;待测水样。
4、实验步骤1)将三根电极的导线分别与圆盘电极上的各电极连接,新极谱仪的输出连线与数据采集存贮器相联;2)参见新极谱仪面板示意图,熟悉仪器;3)将仪器开关(后面板上)置开,预热仪器10分钟;4)调节仪器参数:调节扫描速度14,使其为100mV/s,调节扫描上限4,使其为-500mV,调节扫描下限6,使其为+500mV,调节扫描起始5,使其为+500mV;将面板上各开关及旋钮设置如下:3置于“循环”,18置于“大电流量程”,17置于“50μA”,9置于“i-E”,11置于“断”。

RST3100电化学工作站使用说明整理表姓名:职业工种:申请级别:受理机构:填报日期:A4打印/ 修订/ 内容可编辑RST3100电化学工作站使用说明1.使用范围线性扫描伏安法、线性扫描溶出伏安法、线性扫描循环伏安法、阶梯伏安法、阶梯溶出伏安法、阶梯循环伏安法、方波伏安法、方波溶出伏安法、方波循环伏安法、差示脉冲伏安法、差示脉冲溶出伏安法、常规脉冲伏安法、差示常规脉冲伏安法、单电位阶跃计时电流法、单电位阶跃计时电量法。
二、操作步骤1.开机:打开电脑,开启RST3100电化学工作站电源开关,需稳定一段时间。
(注:绿色铁夹接工作电极,红色铁夹接对电极,黄色铁夹接参比电极。
)2、打开软件,运行程序。
3、选定电化学实验方法:例如:循环伏安测定,点击方法分类中的“线性扫描技术”,双击实验方法中的“循环伏安法”,出现循环伏安法参数设定菜单,初始电位和开关电位设定值一样,电流极性设为“氧化”,如实验出现电流溢出的现象(图像未出现峰,出现水平线),将灵敏度调高,其他设置随实验方法不同而改变。
1.打开“控制”下的“开始实验”,界面右上角出现“剩余时间”2.实验结束,“剩余时间”将消失,将实验结果另存为目标文件,此文件类型为工作站的默认类型,Excell无法打开。
3.打开目标文件下的实验图形,打开数据处理下的“查看数据”,选择显示曲线(不选第一次循环),确定。
出现数据列表对话框,点击保存,保存类型为Excel。
三、注意事项1.有时电脑用优盘时可能不太好用,重启一下可能就好了。
2.如对比电极有油腻粘上,用丙酮清洗,后分别用铬酸溶液和去离子水清洗干净。
3.工作站每隔半个月启动一次,时间为大于半个小时。
RST3100电化学工作站仪器规格说明生产厂家:郑州世瑞思仪科技有限公司产品型号:RST3100电化学工作站主要参数:电位扫描范围±12.8V电位分辩率0.1mV最大恒电流±250mA温度稳定性<10uV/℃输入阻抗//电容>1013Ω// <10pFCV和LSV扫描速率0.001~10000mV/sD/A分辨率16bitA/D分辨率24bit电位激励及测量精度0.2%电流激励及测量精度0.2%电流测量量程±100nA~±250mA共14档固定资产编号:无整理丨尼克本文档信息来自于网络,如您发现内容不准确或不完善,欢迎您联系我修正;如您发现内容涉嫌侵权,请与我们联系,我们将按照相关法律规定及时处理。


线性扫描伏安法测定废水中的镉实验报告一、实验目的本实验旨在通过线性扫描伏安法(Linear sweep voltammetry,LSV)测定废水中的镉(Cd)含量。
线性扫描伏安法是一种常用的电化学分析方法,具有高灵敏度、高选择性以及快速测量的优点。
通过本实验,能够提高对电化学分析方法的理解,掌握线性扫描伏安法的操作流程,并学会用该方法测定废水中的重金属离子。
二、实验原理线性扫描伏安法是一种在电极上施加线性电压扫描的电化学分析方法。
在一定的电位范围内,随着电压的改变,电流也会发生相应的变化。
本实验中,我们将使用此方法测定镉离子在电极上的氧化还原反应。
当电压逐渐增加时,镉离子会从溶液中还原并沉积在电极上,产生电流响应。
通过测量电流响应值,可以推算镉离子的浓度。
三、实验步骤1.准备实验仪器和试剂:线性扫描伏安仪、废水样品、镉标准溶液、恒电位仪、电解电极、磁力搅拌器等。
2.配制镉标准溶液:准确称取一定量的镉标准物质,用超纯水配制成浓度为1000mg/L的镉标准溶液。
3.绘制标准曲线:分别取适量的镉标准溶液,用超纯水稀释至不同浓度,分别为0.1mg/L、0.5mg/L、1.0mg/L、2.5mg/L、5.0mg/L。
在相同的实验条件下,利用线性扫描伏安仪进行测量,绘制电流响应值与镉浓度的关系曲线。
4.测定废水样品:将废水样品进行稀释,使其中镉离子浓度处于标准曲线范围内。
然后,用线性扫描伏安仪进行测量,记录电流响应值。
5.数据处理:根据测量的电流响应值和标准曲线,推算废水样品中镉离子的浓度。
四、实验结果及数据分析1.标准曲线数据:通过线性扫描伏安法测量不同浓度的镉标准溶液,得到电流响应值与镉浓度的关系曲线。
根据曲线拟合得到方程为:y = 0.113x +0.028 (R² = 0.995),其中y为电流响应值,x为镉浓度(单位:mg/L)。
2.废水样品测量结果:通过测量废水样品,得到电流响应值为0.45μA。

线性扫描伏安法与循环伏安法实验**大学本科实验报告专用纸课程名称 仪器分析实验 成绩评定 实验项目名称 线性扫描伏安法与循环伏安法实验 指导教师 实验项目编号 实验项目类型 实验地点 学生姓名 学号 学院 系 化学系 专业 实验时间2015年11月13日下午~11月13日下午 温度 ℃湿度一.实验目的1.掌握线性扫描伏安法及循环伏安法的原理;2.掌握微机电化学分析系统的使用及维护。
3.掌握利用线性扫描伏安法进行定量分析及利用循环伏安法判断电极反应过程。
二.实验原理1. 线性扫描伏安法:线性扫描伏安法是在电极上施加一个线性变化的电压,记录工作电极上的电解电流的方法。
记录的电流随电极电位变化的曲线称为线性扫描伏安图。
⑴可逆电极反应的峰电流如下:c v AD n i p 121351069.2⨯=式中,n 为电子交换数;A 为电极有效面积;D 为反应物的扩散系数;v 为电位扫描速度;c 为反应物(氧化态)的本体浓度。
当电极的有效面积A 不变时,上式可简化为:c Kv i p 1=即峰电流与电位扫描速度v 的1/2次方成正比,与反应物的本体浓度成正比。
这就是线性扫描伏安法定量分析的依据。
⑵可逆电极反应,峰电位与扫描速度无关,nF RT E E p /1.121±=电极反应为不可逆时,峰电位p E 随扫描速度v 增大而负(或正)移。
2. 循环伏安法:循环伏安法的原理与线性扫描伏安法相同,只是比线性扫描伏安法多了一个回扫,所以称为循环伏安法。
循环伏安法是电化学方法中最常用的实验技术,也是电化学表征的主要方法。
循环伏安法有两个重要的实验参数,一是峰电流之比,二是峰电位之差。
对于可逆电极反应,峰电流之比pa pc i i /(阴极峰电流pc i 与阳极峰电流pa i 之比)的绝对值约等于1。
峰电位之差p E ∆(阴极峰电位pc E 与阳极峰电位pa E 之差)约为60mV(25℃),即 nF RT E p /22.2=∆。

实验二线性扫描伏安法测定镉离子一、实验原理:线性扫描伏安法是将线性增加的电位(电位与时间呈线性关系)施加于电解池的工作电极和参比电极之间。
工作电极是可极化的微电极,如悬汞电极或其他固体电极;辅助电极为Pt电极;参比电极为Ag/AgCl电极。
辅助电极和参比电极具有相对较大的表面积,不可极化。
通常电位扫描速率介于0.001~ 0.1 V/ s,可进行单次扫描或多次扫描。
线性扫描伏安法尤其适用于有吸附性能物质的测定。
镉是对人体健康威胁最大的有害元素之一。
本实验采用线性扫描伏安法,根据电流-电位曲线所得的峰电流与被测物的浓度呈线性关系来定量测定样品中镉离子的浓度。
Cd2+在多种底液中都有良好的极谱波。
本实验采用0.2 mol/L KCl作底液,在-0.3 ~ -0.8V进行线性扫描。
Cd2+在悬汞电极上发生如下电极反应:Cd2+ + 2e+ Hg = Cd(Hg)电流峰高与浓度成正比,即I p=Kc,据此进行定量分析。
由于线性扫描法的电位扫描速度较快,不可逆的氧波影响不大,当被测物质浓度较大时不需要除氧。
二、实验目的:1、学习MEC-12B电化学分析仪的操作以及悬汞电极的使用;2、掌握线性扫描伏安法的基本原理。
三、仪器和试剂:1. 仪器:MEC-12B电化学分析仪。
三电极系统:悬汞电极为工作电极;Ag/AgCl电极为参比电极,Pt 电极为辅助电极。
2. 试剂:汞(A.R. );0.2 mol/L KCl溶液;1 mg/mL(即1000ppm)Cd2+贮备液;Cd2+样品溶液(已含0.2 mol/L KCl)四、分析步骤:MEC-12B电化学分析仪的操作方法:依次打开计算机、电化学工作站主机、搅拌器的电源。
将工作电极、参比电极和辅助电极的导线与电化学检测池对应的电极正确连接。
电化学工作站预热10 min。
双击Windows 桌面上的“Mec-12B 多功能分析系统”图标。
1、参数设置:参数设置→采样参数→线性扫描,具体参数如下:2、测量:数据采样→联机采样→保存于12 mL 0.2 mol/L KCl溶液中依次加入0.2 mL 1000 ppm Cd2+贮备液,共加4次。

**大学本科实验报告专用纸课程名称仪器分析实验成绩评定实验项目名称线性扫描伏安法与循环伏安法实验指导教师实验项目编号实验项目类型实验地点学生##学号学院系化学系 专业实验时间2015年11月13日下午~11月13日下午 温度℃湿度一.实验目的1.掌握线性扫描伏安法与循环伏安法的原理;2.掌握微机电化学分析系统的使用与维护.3.掌握利用线性扫描伏安法进行定量分析与利用循环伏安法判断电极反应过程.二.实验原理1.线性扫描伏安法:线性扫描伏安法是在电极上施加一个线性变化的电压,记录工作电极上的电解电流的方法.记录的电流随电极电位变化的曲线称为线性扫描伏安图.⑴可逆电极反应的峰电流如下:式中,n 为电子交换数;A 为电极有效面积;D 为反应物的扩散系数;v 为电位扫描速度;c 为反应物〔氧化态〕的本体浓度.当电极的有效面积A 不变时,上式可简化为:c Kv i p 21=即峰电流与电位扫描速度v 的1/2次方成正比,与反应物的本体浓度成正比.这就是线性扫描伏安法定量分析的依据.⑵可逆电极反应,峰电位与扫描速度无关,nF RT E E p /1.121±=电极反应为不可逆时,峰电位p E 随扫描速度v 增大而负〔或正〕移.2. 循环伏安法:循环伏安法的原理与线性扫描伏安法相同,只是比线性扫描伏安法多了一个回扫,所以称为循环伏安法.循环伏安法是电化学方法中最常用的实验技术,也是电化学表征的主要方法.循环伏安法有两个重要的实验参数,一是峰电流之比,二是峰电位之差.对于可逆电极反应,峰电流之比pa pc i i /〔阴极峰电流pc i 与阳极峰电流pa i 之比〕的绝对值约等于1.峰电位之差p E ∆〔阴极峰电位pc E 与阳极峰电位pa E 之差〕约为60mV<25℃>,即 nF RT E p /22.2=∆.**大学本科实验报告专用纸<附页>三.仪器与试剂1.仪器:电化学分析系统,三电极系统:玻碳电极为工作电极,饱和甘汞电极为参比电极,铂电极为辅助电极.2.试剂:3-100.1⨯mol/L K 3[Fe<CN>6]溶液〔含0.1mol/L 的KCl 的支持电解质〕.四.实验内容与步骤选择仪器使用方法:电位扫描技术—线性扫描伏安法或循环伏安法.参数设置:线性扫描伏安法—初始电位,0.60V ;终止电位,-0.12V ;扫描速度根据实验需要设定;灵敏度选择10-4A ;滤波参数,50Hz ;放大倍数,1.循环伏安法—初始电位,0.60V ;终止电位,0.60V ;扫描速度根据实验需要设定;灵敏度选择10-4A ;滤波参数,50Hz ;放大倍数,1.1.线性扫描伏安法实验:⑴ 以3-100.1⨯mol/L K 3[Fe<CN>6]溶液为实验溶液.分别设定扫描速度<V/s>为:0.02、0.05、0.10、0.20、0.30、0.40、0.50和0.60,记录线性扫描伏安图,将从上面各图中得到的实验记录结果填入表1.扫描速度为0.30V/s 的伏安图如图2所示.表1 数据记录图1 线性扫描伏安图**大学本科实验报告专用纸<附页> 扫描速度〔V/s 〕 0.02 0.05 0.10 0.20 0.30 0.40 0.50 0.60 峰电流<ip>/A μ12.71 20.17 28.08 38.94 46.89 53.41 59.01 63.72 峰电位〔E p 〕/V0.141 0.139 0.132 0.133 0.132 0.129 0.126 0.123图2 0.30V/s 线性扫描伏安图⑵ 配制系列浓度的K 3[Fe<CN>6]溶液〔mol/L 〕〔含0.1mol/L 的KCl 〕:3-100.1⨯、3-100.2⨯、3-100.4⨯、3-100.6⨯、3-100.8⨯、2-100.1⨯.固定扫描速度为0.10V/s,记录各个溶液的线性扫描图.将各实验结果填入表2中.表2 数据记录图3 0.10V/s 线性扫描伏安图**大学本科实验报告专用纸<附页>2.循环伏安法实验:以3-100.1⨯mol/L K 3[Fe<CN>6]溶液为实验溶液,改变扫描速度,将实验结果填入表3中.扫描速度为0.10V/s 的循环伏安图如图5所示.图4 循环伏安图 浓度/〔mol/L 〕3-100.1⨯3-100.2⨯ 3-100.4⨯ 3-100.6⨯ 3-100.8⨯ 2-100.1⨯ 峰电流<ip>/A μ 28.08 55.23 105.1 151.4 194.0 234.3表3 数据记录**大学本科实验报告专用纸<附页>五.数据处理与结果分析1.将表1中的峰电流对扫描速度v的2/1次方作图〔21vip-〕得到一条直线,说明什么问题?峰电流与扫描速度v的2/1次方成正比,说明电极电流是扩散控制.2.将表1中的峰电位对扫描速度作图〔EP-v〕,并根据曲线解释电极过程.峰电位EP随扫描速度增大而负移,说明电极反应为不可逆过程.3.将表2中的峰电流对浓度作图〔ip-c〕将得到一条直线.试解释之.扫描速度〔V/s〕0.02 0.05 0.10 0.20 0.30 0.40 0.50 0.60 峰电流之比〔i p/i pa〕/Aμ 1.008 1.015 1.013 1.012 1.013 1.022 1.019 1.016 峰电位之差〔pE∆〕/mV 68 68 76 81 86 94 98 96在一定的扫描速度下,峰电流与浓度成正比,灵敏度高.4.表3中的峰电流之比值几乎不随扫描速度的变化而变化.并且接近于1,为什么?**大学本科实验报告专用纸<附页> 还原峰电流i pc 与氧化峰电流i pa 之比i pc /i pa ≈1,可判断此反应为可逆反应.5.以表3中的峰电位之差值对扫描速度作图〔p E ∆-v 〕,从图上能说明什么问题?p E ∆远大于60mV,故判断此反应不可逆.六.思考题1.请就图5简述循环伏安法的原理,步骤与各部分曲线的含义.答:电流电压曲线包括两个分支,前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,后半部分电位向阳极方向扫描时,还原产物又重新在电极上氧化,产生氧化波.因此一次三角波扫描,完成一个还原和氧化过程的循环,该法称为循环伏安法,其电流—电压曲线称为循环伏安图.如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差.2.简述可逆电极过程的诊断标准.答:还原峰电流i pc 与氧化峰电流i pa 之比i pc /i pa ≈1,氧化峰与还原峰峰电位之差p E ∆约为60mV 〔25℃〕,则电极反应为可逆过程.3.简述利用线性扫描伏安法进行定量分析的理论依据.答:可逆电极反应的峰电流如下:c v AD n i p 121351069.2⨯=式中,n 为电子交换数;A 为电极有效面积;D 为反应物的扩散系数;v 为电位扫描速度;c 为反应物〔氧化态〕的本体浓度.当电极的有效面积A 不变时,上式可简化为:c Kv i p 21=即峰电流与电位扫描速度v 的1/2次方成正比,与反应物的本体浓度成正比.这就是线性扫描伏安法定量分析的依据.。
循环伏安法
循环伏安法(CV)是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。
图1 循环伏安法的典型激发信号
当工作电极被施加的扫描电压激发时,其上将产生响应电流,以电流对电位作图,称为循环伏安图(如图2所示)。
图2 典型的循环伏安图 从循环伏安图中可得到几个重要的参数:阳极峰电流(i pa )、阳极峰(E pa )、阴极峰电流( i pc )、阴极峰电位(E pc )。
对可逆氧化还原电对的式量电位E θ’与E pc 和E pa 的关系为:
E θ’ = 2pc
pa E E (1)
而两峰之间的电位差值为:
ΔE p = E pa - E pc ≈ n
0592.0 (2) 对铁氰化钾电对,其反应为单电子过程,ΔE p 是多少?从实验求出来与理论值比较。
对可逆体系的正向峰电流,由Randles –Savcik 方程可表示为:
i p = 2.69×105n 3/2AD 1/2υ1/2c (3)
扫描电压(V)
时间/s
式中:i p为峰电流(A),n为电子转移数,A为电极面积(cm2),D为扩散系数(cm2/s),υ为扫描速度(V/s),c为浓度(mol/L)。
根据上式,i p与υ1/2和c都是直线关系,对研究电极反应过程具有重要意义。
在可逆电极反应过程中:
i pa / i pc≈ 1 (4)
对一个简单的电极反应过程,式(2)和式(4)是判别电极反应是否可逆体系的重要依据。
循环伏安法原理:循环伏安法(CV )是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多 研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为:Fe(CN)63-+e - → Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为: Fe(CN)64- - e - → Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV 研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依据Faraday 定律估算,, 其中m 为反应的摩尔量, n 为电极反应中的得失电子数,F 为 图2 氧化还原cv 曲线图图1 cv 图中电势~时间关系图3 Ag在Pt电极上电结晶过程的CV图0.01mol/LagNO3+0.1mol/LKNO3Faraday常数(96485 C.molmnFidtQt==∫0-1)。
循环伏安法原理:循环伏安法(CV )是最重要的电分析化学研究方法之一。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多 研究领域被广泛应用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),一支参比电极(监测工作电极的电势),一支辅助(对)电极。
外加电压加在工作电极与辅助电极之间,反应电流通过工作电极与辅助电极。
对可逆电极过程(电荷交换速度很快),如一定条件下的Fe(CN)63-/4-氧化还原体系,当电压负向扫描时,Fe(CN)63- 在电极上还原,反应为:Fe(CN)63-+e - → Fe(CN)64-得到一个还原电流峰。
当电压正向扫描时,Fe(CN)64-在电极上氧化,反应为: Fe(CN)64- - e - → Fe(CN)63-得到一个氧化电流峰。
所以,电压完成一次循环扫描后,将记录出一个如图2所示的氧化还原曲线。
扫描电压呈等腰三角形。
如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。
因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。
应用领域:循环伏安法能迅速提供电活性物质电极反应的可逆性,化学反应历程,电活性物质的吸附等许多信息。
循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一。
如通过对未知研究体系的CV 研究,可以获研究对象的反应电位或和平衡电位, 估算反应物种的量,以及判断反应的可逆性。
电化学反应中物种反应的量可以依图2 氧化还原cv 曲线图图1 cv 图中电势~时间关系据Faraday 定律估算,, 其中m 为反应的摩尔量, n 为电极反应中的得失电子数,F 为Faraday 常数(96485 C.molmnFidtQt==∫0-1)。
如图3的CV 图中,阴影部分对应的是铂上满单层氢脱附的电量,为210 μC/cm 2。