高一化学金属的化学性质2(1)(中学课件2019)
- 格式:ppt
- 大小:307.00 KB
- 文档页数:14




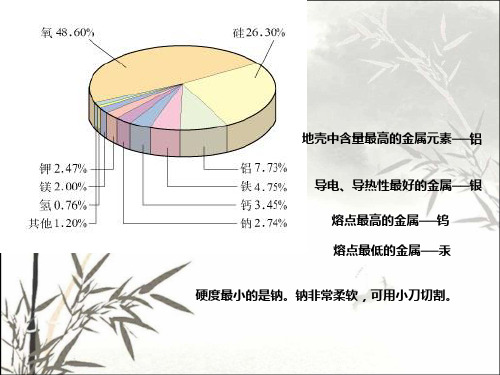

高中化学金属的化学性质1. 金属的导电性金属是一类具有良好导电性能的物质。
金属中的电子以海洋模型存在,无定形地分布在金属离子之间。
这种电子的无序运动使得金属具有优良的电导性能。
金属的导电性表现为:•电导率高:金属的电导率远远高于非金属物质。
在常温下,金属大部分都能够导电,且电导率随温度的升高而增大。
•欧姆定律成立:金属遵循欧姆定律,即在电流通过金属时,电流与电压成正比,阻抗恒定。
这是由于金属的电子自由度高,不受阻碍地移动。
•优良的热导性:金属不仅具有良好的电导性,也具有优秀的热导性。
金属中电子的无序运动不仅能够传导电流,也能够传导热量。
2. 金属的反应性金属的反应性主要体现在金属在化学反应中能够失去电子,形成正离子。
金属的反应性表现为:•金属与非金属发生反应:金属能够与非金属元素发生反应,形成离子化合物。
例如,钠与氯气反应生成氯化钠:2Na + Cl2 → 2NaCl。
•金属与非金属离子发生反应:金属能够与非金属离子发生置换反应,形成新的金属化合物。
例如,铜能够与银离子发生反应生成银金属:Cu +2Ag+ → Cu2+ + 2Ag。
•金属与酸反应:金属能够与酸反应,生成盐和氢气。
通常,活泼金属与酸反应较为剧烈,产生较多的氢气。
例如,锌与盐酸反应生成氯化锌和氢气:Zn + 2HCl → ZnCl2 + H2。
•金属与水反应:金属能够与水反应生成金属氢氧化物和氢气。
不同金属的反应性不同,有些金属在常温下可与水直接反应,有些金属只能在高温下或与蒸汽反应。
例如,钠与水反应生成氢氧化钠和氢气:2Na + 2H2O →2NaOH + H2。
3. 金属的氧化性金属的氧化性表现为金属能够失去电子形成阳离子,与氧气或氧化剂发生反应。
金属的氧化性取决于其在电位表中的位置,越靠下的金属越容易氧化。
金属的氧化性表现为:•金属与氧气反应:金属能够与氧气反应生成金属氧化物。
不同金属的氧化性不同,有些金属在常温下即可与氧气反应生成氧化物。