(LORU)烯烃分离基础理论知识培训解析
- 格式:ppt
- 大小:1.26 MB
- 文档页数:35



第05课烯烃1.认识烯烃的结构、通式和主要性质。
一、烯烃的结构与性质1.烯烃及其结构(1)烯烃:含有碳碳双键的烃类化合物。
(2)官能团:名称为碳碳双键,结构简式为。
(3)分类①单烯烃:分子中含有一个碳碳双键①多烯烃:分子中含有两个及以上碳碳双键①二烯烃:分子中含有二个碳碳双键。
二烯烃又可分为累积二烯烃、孤立二烯烃和共轭二烯烃;累积二烯烃的结构特点是双键连在一起;共轭二烯烃的结构特点是单、双键交替排列;孤立二烯烃的结构特点是在二个双键之间相隔二个或二个以上的单键(4)通式:烯烃只含有一个碳碳双键时,其通式一般表示为C n H2n(n≥2)(5)乙烯的分子结构:乙烯分子中含有1个碳碳双键和4个碳氢单键,相邻的2个键的夹角接近120°,乙烯分子中的6个原子共平面,即与双键(包括碳碳双键、碳氧双键、碳硫双键等)相连的所有原子在同一个平面内。
2.物理性质(1)状态:一般情况下,2~4个碳原子烯烃(烃)为气态,5~16个碳原子为液态,16个碳原子以上为固态。
(2)溶解性:烯烃都难溶于水,易溶于有机溶剂。
(3)熔沸点:随着碳原子数增多,熔沸点升高;分子式相同的烯烃,支链越多,熔沸点越低。
(4)密度:随着碳原子数的递增,密度逐渐增大,但比水的小。
3.烯烃的化学性质:烯烃的官能团是碳碳双键(),决定了烯烃的主要化学性质,化学性质与乙烯相似(1)氧化反应①+3n O 点燃丙烯燃烧的反应方程式:2CH 3CH===CH 2+9O 2−−→−点燃6CO 2+6H 2O①烯烃能使酸性高锰酸钾溶液褪色,KMnO 4溶液氧化产物的确定规律,可用于烯烃结构的测定:3)氧化,氧化产物的确定规律,可用于烯烃结构的测定;HCHO、卤化氢、氰化氢(HCN)等在适宜的条件①与溴水加成:CH 2==CH CH 3+Br 2CH 2BrCHBr CH 3 (1,2—二溴丙烷)①与H 2加成:CH 2==CH CH 3+H 2∆−−→−催化剂CH 3CH 2CH 3 (丙烷) ①与HCl 加成:CH 2==CH CH 3+HCl ∆−−→−催化剂CH 3CHClCH 3(主要)或CH 3CH 2CH 2Cl (次要) 【名师拓展】马氏规则:凡是不对称结构的烯烃和酸(HX)加成时,酸的负基(X —)主要加到含氢原子较少的双键碳原子上,称为马尔科夫尼科夫规则,也就是马氏规则 (氢加氢多,卤加氢少)。


第三节 乙烯 烯烃●教学目的:1、了解乙烯的物理性质和主要用途,掌握乙烯的化学性质和实验室制法。
2、使学生了解加成反应和聚合反应以及不饱和烃的概念。
3、使学生了解烯烃在组成、结构、主要化学性质上的共同点,以及物理性质随碳原子数的增加而变化的规律。
●教学重点:乙烯的化学性质。
●教学难点:乙烯的结构以及与化学性质的关系。
教学过程:[引入]何谓烷烃?其通式如何?它属于何类烃?(饱和链烃)与此相对应就应该有不饱和烃。
另外有机物之所以种类繁多,除了存在大量的同分异构现象,在有机物中碳原子除了可以形成C —C ,还可能形成 或 —C ≡C — ,从而使得碳原子上的氢原子数少于饱和链烃里的氢原子数。
这样的烃叫做不饱和烃。
[板书]不饱和烃:烃分子里含有碳碳双键或碳碳三键,碳原子所结合的氢原子数少于饱和链烃里的氢原子数,这样的烃叫做不饱和烃。
[讲解] 根据烃分子中碳原子的连接方式不同,烃可以分为如下类别:饱和烃——烷烃 链烃 烯烃烃 不饱和烃炔烃 环烃[过渡]今天我们来学习最简单的烯烃——乙烯。
一、 乙烯来源及用途CC二、 乙烯的分子组成和结构1、[设问]:(1)把乙烷C 2H 6中H 原子去掉两个就变成了乙烯C 2H 4,根据每个原子通过共用电子对达到饱和的原理,试推导C 2H 4中共价键是怎样组成的? 电子式:分子式:C 2H 4 最简式:CH 2 结构简式:CH 2=CH 2 结构式:(2)展示乙烯和乙烷的球棍模型,对比两者有何不同?2、[[设问](1)乙烯中C==C 双键可否认为是两个C —C 的加和?不能,因为C==C 键能小于C —C 单键键能的2倍,615<2×384=768 (2)通过键能大小来看,乙烯和乙烷哪个化学性质较活泼?C C H H H H乙烯为平面分子,键角为120°,“C==C”中有一个碳碳键等同于C—C,叫δ键,另一个碳碳键键能小于C—C,叫π键,π键稳定性较差。

烯烃含量怎么降低的原理烯烃是一类含有碳碳双键的有机化合物。
在某些情况下,烯烃的存在可能对许多工业和燃料应用造成不利影响。
因此,减少烯烃的含量对于一些工业生产过程以及环境保护是非常重要的。
本文将详细介绍降低烯烃含量的原理。
降低烯烃含量的方法可以从多个角度来考虑。
下面将分别介绍物理方法、化学方法和技术方法这三种降低烯烃含量的原理。
一、物理方法1. 蒸馏分离:蒸馏是一种常见的纯化方法,可将混合物中分子量不同的化合物分离开来。
烯烃的沸点通常较低,因此可以通过蒸馏将其从混合物中分离出来。
这种方法在石油炼制过程中的初步分离中广泛应用。
例如,原油经过常压蒸馏可以分离为多个馏分,其中某些馏分可能富含烯烃。
2. 吸附:吸附是一种基于化学吸附原理的分离技术。
通过使用适当的吸附剂,可以将烯烃从混合物中选择性地吸附出来。
例如,分子筛和活性炭等材料常被用作吸附剂,能够将烯烃从液体或气体中分离出来。
3. 膜分离:膜分离是利用不同物质对于特定膜的渗透性不同来实现分离的方法。
特定的膜可以对烯烃具有较高的渗透性,因此可以通过膜分离将烯烃和其他物质分离出来。
膜分离技术广泛应用于石化工业中的气体混合物分离。
二、化学方法1. 加氢反应:加氢反应是将氢气添加到分子中破坏碳碳双键的化学反应。
烯烃在加氢反应中会被还原为饱和烃。
例如,通过在适当的催化剂存在下,可以将乙烯(一个重要的烯烃)加氢生成乙烷。
加氢反应通常需要在高压和适当的温度下进行。
2. 氧化反应:氧化反应是将氧气添加到分子中破坏碳碳双键的化学反应。
烯烃在氧化反应中会被氧化为醇、酮或醛等含有羰基的化合物。
例如,丙烯(一种重要的烯烃)可以通过氧化反应转化为丙酮。
氧化反应通常需要在适当的温度和催化剂的存在下进行。
3. 合成反应:一些合成反应可以将烯烃转化为其他有用的化合物。
例如,从烯烃合成且不含烯烃的生产化合物,从而降低烯烃含量。
一种常用的方法是用丙烯合成聚丙烯。
在聚合反应中,烯烃分子中的双键被破坏并与其他烯烃分子连接,生成高分子量的聚合物。


② 碎瓷片的作用 防止液体剧烈跳动(防止煮沸)。
第三节乙烯烯烃【知识讲解】一、乙烯的分子结构(与乙烷比较)、乙烯的实验室制法1试剂:乙醇(酒精)和浓硫酸按体积比1: 3混合2、反应原理CH 2=CH 2 f 十场 04、 集气方法:排水集气法5、 几个应该注意的问题① 浓硫酸的作用 催化和脱水3、气体发生装置:術液亠气”的装置(与制 CI2相似)③反应温度应控制在170C,若温度过低(140C)将发生副反应,而生成乙醚;若温度过高,则乙醇易被浓HzSQ氧化。
为了控制温度,应将温度计的水银球插在液面下。
以准确测定反应液体的温度。
④ 反应后液体易变黑,且有刺激性气味气体产生。
这是由于浓硫酸的强氧化性将乙醇氧化生成C和CQ,且硫酸被还原成SQ2所致。
其反应方程式可表示为:CH^CHzOHTH汩0斗味)一t 乂。
2 I十CRHQ若要净化乙烯,可将其通过NaQH溶液除去SQ、CQ。
三、乙烯的性质通常情况下,乙烯是无色,稍有气味的气体,密度与空气相近,难溶于水。
乙烯化学性较活泼,易发生如下反应:1、加成反应:有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成别的物质的反应。
①与卤素加成:CH=CH+B「2T CH2Br —CHB r (使溴水褪色,可用于检验乙烯或除去乙烯)CHa=C盼饗岁CHa-CJS②与氢气加成:③与卤化氢HX加成:氐十HClf (可用于制氯乙烷)④与水加成:加热加压(可用于工业上制酒精)2、氧化反应①燃烧:“*—"』」;”—L(火焰明亮有黑烟)②可与强氧化剂反应:使酸性KMnQ溶液褪色(可用于检验乙烯)3、加聚反应:"CH尸耳一十耳-田岛(可用于制聚乙烯塑料)加聚反应是指不饱和单体通过加成反应互相结合成高分子化合物的反应。
四、烯烃:含有碳碳双键的一类链烃1、烯烃的结构特点是具有碳碳双键。
烯烃的通式为GH2n (n》2)。
2、烯烃同系物的结构相似,化学性质与乙烯相似,易发生加成、氧化和加聚反应,其 物理性质随着碳原子数增多、分子量增大,分子间作用力增大,熔点、沸点依次升高。


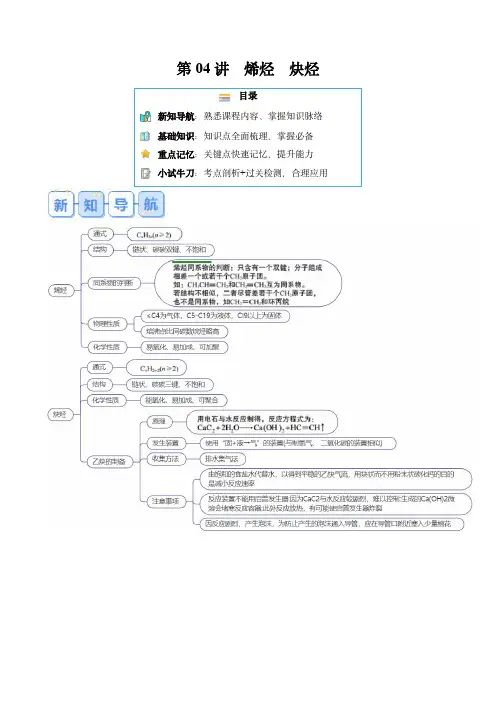
第04讲烯烃炔烃目录新知导航:熟悉课程内容、掌握知识脉络基础知识:知识点全面梳理,掌握必备重点记忆:关键点快速记忆,提升能力小试牛刀:考点剖析+过关检测,合理应用课时1烯烃一.烯烃的结构和性质1.烯烃及其结构(1)烯烃:含有碳碳双键的烃类化合物。
(2)官能团:名称为碳碳双键,结构简式为。
(3)通式:烯烃只含有一个碳碳双键时,其通式一般表示为C n H 2n (n ≥2)。
(4)乙烯的结构特点分子中碳原子采取sp 2杂化,碳原子与氢原子间均形成单键(σ键),碳原子与碳原子间以双键相连(1个σ键,1个π键),键角约为120°,分子中所有原子都处于同一平面内。
2.烯烃的物理性质(1)沸点:随碳原子数的递增而逐渐升高。
(2)状态:常温下由气态逐渐过渡到液态、固态,当烯烃分子中碳原子数≤4时,常温下呈气态。
(3)溶解性和密度:难溶于水,易溶于有机溶剂,密度比水小。
3.烯烃的化学性质——与乙烯相似(1)氧化反应①烯烃能使酸性高锰酸钾溶液褪色。
②可燃性燃烧通式为C n H 2n +3n 2O 2――→点燃n CO 2+n H 2O 。
(2)加成反应①烯烃能与H 2、X 2、HX 、H 2O 等发生加成反应,写出下列有关反应的化学方程式:a .丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷:CH 2==CHCH 3+Br 2―→。
b .乙烯制乙醇:CH 2==CH 2+H 2O――→催化剂△CH 3CH 2OH 。
c .乙烯制氯乙烷:CH 2==CH 2+HCl――→催化剂△CH 3CH 2Cl 。
d .丙烯转化为丙烷:CH 2==CHCH 3+H 2――→催化剂△CH 3CH 2CH 3。
(3)加聚反应丙烯发生加聚反应的化学方程式:n CH 2==CHCH 3――→催化剂。
4.二烯烃的加成反应(1)定义:分子中含有两个碳碳双键的烯烃称为二烯烃,如1,3-丁二烯的结构简式为CH 2==CH—CH==CH 2。