第一章 化学热力学基础
●在确定条件下,变化是自发还是非自发?变化的 限度?从确定的自发变化可以获得多少功?要实现 确定的非自发变化,必须注入多少功?
三峡大坝 发电机组
化学电池 化学激光 ……
农田灌溉
电解反应 光化学反应 ……
§1.1 热力学基本概念
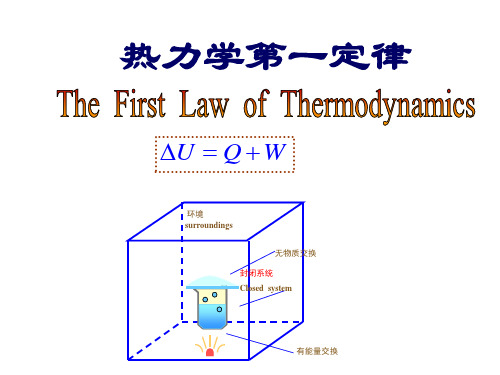
1.系统和环境
系统(system) ——热力学研究的对象,包括指定的物质和空间。
非均相系统(多相系统)
(heterogeneous system)
CaCO3 (s) =CaO(s)+CO2(g) NH4HCO3 (s) = NH3(g) + H2O(g) + CO2(g)
相变(phase transformation)
——物质从一种聚集形态转变为另一种聚集形态。
气体
液化
升华
√
封闭系统(Closed system) ×
√
隔离系统(Isolated system) ×
×
2.描述系统状态的热力学函数
抽开插板
n,p,V,T
n, p,V,T
Sy(I)
Sy(II)
强度性质函数(intensive properties) 数值大小与系统中所含物质的量无关, 无加和性(如 p,T);
p、V、T 变化过程 相变化过程 化学变化过程
典型p、V、T变化过程
① 定温过程:T1=T2=Tsu ② 定压过程: p1= p2= psu ③ 定容过程: V1=V2 ④ 绝热过程: Q = 0 ⑤ 对抗恒外压过程:psu=常数(包括0)
p1,T1 psu
⑥ 循环过程 :系统的始态和终态为同一状态。
1、苯的正常沸点为80.1 ℃。你知道苯在80.1 ℃ 的饱和蒸汽压吗?