物质在水中的分散状况
- 格式:doc
- 大小:35.50 KB
- 文档页数:2

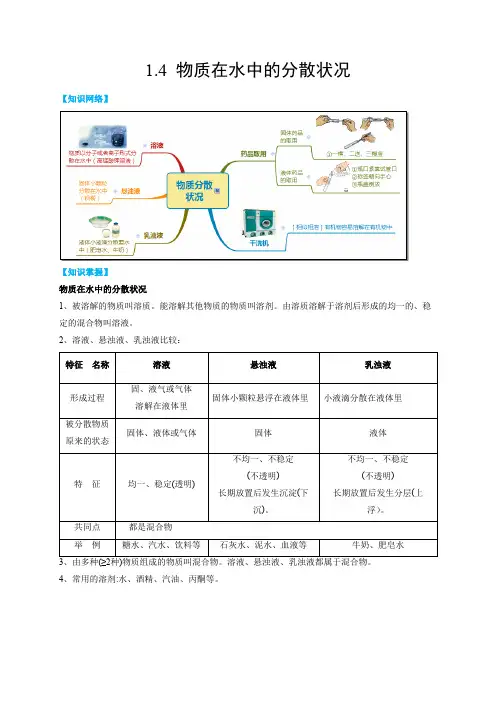
1.4 物质在水中的分散状况【知识网络】【知识掌握】物质在水中的分散状况1、被溶解的物质叫溶质。
能溶解其他物质的物质叫溶剂。
由溶质溶解于溶剂后形成的均一的、稳定的混合物叫溶液。
2、溶液、悬浊液、乳浊液比较:4、常用的溶剂:水、酒精、汽油、丙酮等。
【例题精析】例1.下列是我们生活中常见的几种物质,其中属于悬浊液的是()A.肥皂水B.矿泉水C.牛奶D.泥浆水【解答】解:A、肥皂水是不溶性液态小液滴分散到水中形成的,属于乳浊液,故A错误;B、矿泉水是均一、稳定的混合物,属于溶液,故B错误;C、牛奶是不溶性液态小液滴分散到水中形成的,属于乳浊液,故C错误;D、泥浆水是不溶性固体小颗粒分散到水中形成的,属于悬浊液,故D正确。
故选:D。
例2.以下关于溶液的描述不正确的是()A.放置一段时间后无明显变化B.溶液一定是混合物C.溶液都是无色透明的D.溶液中各部分的液体密度都相同【解答】解:A、溶液具有稳定性,放置一段时间后无明显变化,故A说法正确;B、溶液中含有溶质和溶剂,最少含有两种物质,属于混合物,故B说法正确;C、溶液可以有颜色,例如硫酸铜溶液是蓝色,故C说法错误;D、溶液具有均一性,各部分的液体密度都相同,故D说法正确。
故选:C。
例3.下列是生活中出现的液体,其中属于溶液的是()A.盐水B.牛奶C.肥皂水D.泥水【解答】解:A、盐水是均一、稳定的混合物,属于溶液,故A正确;B、牛奶不均一、不稳定,属于乳浊液,故B错;C、肥皂水是不均一、不稳定的悬浊液,故C错;D、泥水是不均一、不稳定的悬浊液,故D错。
故选:A。
例4.下列关于溶液、悬浊液、乳浊液的说法:①溶液一定是无色透明的液体;②溶液是纯净物,而浊液是混合物;③在条件不变的情况下,溶液静置多久都不分层;④泥浆水是乳浊液,其中正确的是()A.①②③④B.①②③C.③D.②③④【解答】解:①溶液不一定是无色透明的液体,例如硫酸铜溶液是蓝色溶液,该说法不正确;②溶液、浊液(包括悬浊液和乳浊液)都是混合物,该说法不正确;③溶液是均一、稳定的混合物,在条件不变的情况下,溶液静置多久都不分层,该说法正确;④泥浆水是不溶于液体的固体物质分散到液体中形成的不均一、不稳定的混合物是悬浊液,该说法不正确。


物质在水中的分散状况的教案设计一、教学目标1. 让学生了解物质在水中的分散现象,掌握溶液、悬浊液和乳浊液的概念。
2. 培养学生观察、实验和分析问题的能力。
3. 引导学生运用所学知识解决实际问题,提高学生的实践能力。
二、教学内容1. 物质在水中的分散现象2. 溶液的概念及特点3. 悬浊液的概念及特点4. 乳浊液的概念及特点5. 分散系及其分类三、教学重点与难点1. 教学重点:物质在水中的分散现象,溶液、悬浊液和乳浊液的概念及特点。
2. 教学难点:分散系的概念及分类。
四、教学方法1. 采用问题驱动法,引导学生思考和探讨问题。
2. 利用实验法和观察法,让学生直观地了解物质在水中的分散现象。
3. 采用案例分析法,提高学生的实践能力。
五、教学准备1. 实验器材:烧杯、玻璃棒、滴管、试剂瓶等。
2. 实验试剂:食盐、蔗糖、植物油、牛奶等。
3. 课件和教学素材。
教案一、导入新课1. 提问:同学们,你们在日常生活中是否遇到过物质在水中的分散现象?2. 引导学生思考和探讨物质在水中的分散现象及特点。
二、探究物质在水中的分散现象1. 实验一:观察食盐在水中的溶解过程。
(1)将适量的食盐放入烧杯中。
(2)加入适量的水,用玻璃棒搅拌。
(3)观察食盐在水中的溶解过程,记录现象。
2. 实验二:观察蔗糖在水中的溶解过程。
(1)将适量的蔗糖放入烧杯中。
(2)加入适量的水,用玻璃棒搅拌。
(3)观察蔗糖在水中的溶解过程,记录现象。
3. 实验三:观察植物油在水中的分散现象。
(1)将适量的植物油放入烧杯中。
(2)加入适量的水,用玻璃棒搅拌。
(3)观察植物油在水中的分散现象,记录现象。
4. 实验四:观察牛奶在水中的分散现象。
(1)将适量的牛奶放入烧杯中。
(2)加入适量的水,用玻璃棒搅拌。
(3)观察牛奶在水中的分散现象,记录现象。
2. 讲解溶液、悬浊液和乳浊液的概念及特点。
3. 讲解分散系的概念及分类。
四、课堂练习1. 根据所学内容,完成课后练习题。


《物质在水中的分散状况》导学案《物质在水中的分离状况》导学案导学目标:通过本节课的进修,学生将掌握物质在水中的分离状况,了解溶解、悬浮、沉淀等观点,并能够应用到实际生活中。
一、导入引言请同砚们回答以下问题:在平时生活中,我们经常看到水中的物质是如何存在的?有哪些不同的分离状况?我们如何能够区分它们呢?二、观点诠释1. 溶解:指溶质分子散布在溶剂分子之间,形成均匀通明的溶液。
常见的溶解现象有糖溶解在水中、盐溶解在水中等。
2. 悬浮:指固体颗粒悬浮在液体中,形成不均匀的混合物。
常见的悬浮现象有沙子悬浮在水中、泥浆悬浮在水中等。
3. 沉淀:指在溶液中形成固体颗粒沉积的现象。
常见的沉淀现象有盐类沉淀、金属氧化物沉淀等。
三、实验探究1. 实验一:制备食盐水溶液材料:食盐、水、容器、勺子步骤:将适量的食盐加入容器中,加入适量的水搅拌至食盐完全溶解。
观察:观察食盐是否完全溶解在水中,形成通明的溶液。
2. 实验二:观察沙子在水中的悬浮现象材料:沙子、水、容器步骤:将适量的沙子加入容器中,加入适量的水搅拌均匀。
观察:观察沙子是否悬浮在水中,形成不均匀的混合物。
3. 实验三:观察沉淀现象材料:铁盐溶液、氢氧化钠溶液步骤:将铁盐溶液和氢氧化钠溶液缓缓混合。
观察:观察是否在混合液中形成沉淀,沉淀颜色及形状是什么。
四、讨论与总结1. 请同砚们讨论实验中观察到的现象,分析溶解、悬浮、沉淀之间的区别和联系。
2. 总结物质在水中的分离状况,提出在平时生活中如何应用这些知识。
五、拓展延伸1. 请同砚们自行设计一个实验,探究其他物质在水中的分离状况。
2. 请同砚们在平时生活中观察并记录物质在水中的分离状况,撰写实验报告并分享给同砚们。
六、作业安置1. 完成教室讨论的总结性报告。
2. 设计一个关于物质在水中的分离状况的实验,并撰写实验报告。
七、反馈评判请同砚们对本节课的进修进行反馈,提出自己的看法和建议。




物质在水中的分散状况教案第一章:物质与水的相互作用1.1 物质在水中的溶解1.1.1 溶解的概念:物质在溶剂中形成均一稳定的混合物。
1.1.2 溶解过程:溶质与溶剂之间的相互作用。
1.1.3 溶解度:物质在溶剂中溶解的能力。
1.2 物质在水中的悬浮1.2.1 悬浮的概念:微小颗粒物质在水中不溶解,呈悬浮状态。
1.2.2 悬浮颗粒的稳定性:重力与浮力的平衡。
1.2.3 絮凝:悬浮颗粒的聚集过程。
第二章:溶液的制备与浓度计算2.1 溶液的制备2.1.1 固体溶解:称量、溶解、冷却、储存。
2.1.2 液体稀释:计算、量取、混合。
2.2 溶液的浓度计算2.2.1 摩尔浓度:物质的量与溶液体积的比值。
2.2.2 质量分数:溶质质量与溶液总质量的比值。
2.2.3 物质的量浓度:物质的量与溶液体积的比值。
第三章:溶液的稀释与浓缩3.1 溶液的稀释3.1.1 稀释原理:加入溶剂降低溶液浓度。
3.1.2 稀释方法:体积比例法、质量比例法。
3.1.3 稀释计算:C1V1=C2V2。
3.2 溶液的浓缩3.2.1 浓缩原理:蒸发溶剂提高溶液浓度。
3.2.2 浓缩方法:蒸发皿、热板、旋转蒸发仪。
3.2.3 浓缩计算:初始体积×初始浓度=最终体积×最终浓度。
第四章:物质在水中的分散性与稳定性4.1 分散性4.1.1 分散系:分散相与连续相。
4.1.2 分散粒径:颗粒大小对分散体系的影响。
4.1.3 分散动力学:布朗运动与分散颗粒的运动。
4.2 稳定性4.2.1 稳定性的含义:分散体系在一定时间内的稳定性。
4.2.2 影响稳定性的因素:分散颗粒大小、表面电荷、溶液pH、分散剂。
4.2.3 稳定剂的选择与应用:高分子化合物、表面活性剂。
第五章:实验操作与技能5.1 溶液的配制与转移5.1.1 实验器材:烧杯、玻璃棒、容量瓶、移液器。
5.1.2 操作步骤:计算、称量、溶解、冷却、转移、洗涤、定容。
5.1.3 注意事项:避免溶液污染、保持容器清洁。

物质在水中的分散状况教案第一章:物质与水的相互作用1.1 物质的水溶性解释水溶性的概念,即物质在水中的溶解能力。
介绍溶解度的概念,即在一定温度下,物质在溶剂中达到饱和时的最大溶解量。
探讨溶解度的因素,如温度、压力和溶质与溶剂之间的相互作用。
1.2 物质的溶解过程解释溶解过程,即溶质从固态或液态转移到溶剂中的过程。
探讨溶解过程中的分子间作用力,如范德华力和氢键。
分析溶解过程中的能量变化,即溶解热和熵的变化。
第二章:溶液的性质与浓度2.1 溶液的性质介绍溶液的均匀性和稳定性。
探讨溶液的折射率和旋光性等物理性质。
解释溶液的沸点和凝固点与纯溶剂的差异。
2.2 溶液的浓度介绍溶液的浓度概念,即溶质在溶液中的质量或摩尔比例。
学习使用浓度公式和浓度计算方法。
探讨溶液的稀释和浓缩过程。
第三章:溶液的配制与稀释3.1 溶液的配制学习溶液的配制方法,包括固体溶解和液体稀释。
探讨溶液配制中的注意事项,如准确称量和避免溶液污染。
掌握溶液配制的基本技巧和实验操作。
3.2 溶液的稀释解释溶液稀释的概念,即增加溶剂的量以降低溶液的浓度。
学习溶液稀释的方法和技巧,如逐滴加入溶剂。
探讨溶液稀释中的注意事项,如避免剧烈搅拌和温度变化。
第四章:溶液的分离与纯化4.1 溶液的分离介绍溶液分离的方法,如过滤、离心和蒸馏。
探讨不同分离方法的适用范围和实验操作。
学习溶液分离中的注意事项,如避免溶液污染和保持实验数据的准确性。
4.2 溶液的纯化解释溶液纯化的概念,即去除溶液中的杂质和污染物。
学习溶液纯化的方法,如离子交换、吸附和结晶。
探讨溶液纯化中的注意事项,如选择合适的纯化方法和控制实验条件。
第五章:溶液的应用5.1 溶液的配位化学介绍溶液中的配位化学,即金属离子与配体之间的相互作用。
学习配位化合物的结构和性质。
探讨配位化学在实际应用中的应用,如催化剂和药物。
5.2 溶液的反应动力学解释溶液中的反应动力学,即反应速率和反应机理。
学习反应动力学的基本原理和实验方法。
物质在水中的分散状况1、溶液: (1) 溶剂:能溶解其他物质的物质叫溶剂(如水、酒精等物质)(2) 溶质:被溶解的物质叫溶质。
(固、液、气体均可)(3)溶液(4)溶液的质量=溶质的质量+溶剂的质量2、3、溶液、悬浊液、乳浊液都属于混合物。
4、水是最常用的溶剂,有些物质不能溶解在水中,却能溶解在其他溶剂里。
常用的溶剂: 水、酒精、汽油、丙酮等。
5.给下列混合物归类:①食盐水,②钡餐,③牛奶,④血液,⑤肥皂水,⑥泥水,⑦色拉油溶于水,⑧色拉油溶于汽油。
属于溶液的是,属于乳浊液的是。
6.有10%的食盐水100亳升,其密度为1.03克/厘米3.现从中取出食盐水10亳升,那么这些食盐水的质量分数为,密度为千克/米3。
二、课堂练习1.将下列四种家庭常用的调味品分别放入水中,不能形成溶液的是( )A.食盐 B.芝麻油C.味精 D.蔗糖2.组成溶液的溶质( )。
A.只能是气体 B.只能是液体C.只能是固体 D.可以是气体、液体或固体3.下列物质不属于混合物的是( )A.空气 B.碘酒 C.冰水 D.牛奶4.一杯食盐溶液,实验测得其上部密度为ag/cm3,下部密度为bg/cm3,则a与b的关系是( )A.a<b B.a=bC.a>b D.无法确走5.溶液区别于悬浊液、乳浊液的根本之处是 ( )A.溶液无色透明 B.溶液稳定、均一C.溶液可能有颜色 D.溶液没有气味6.下列说法不正确的是( )A.酒精溶于水,酒精是溶质B.河水可以养鱼,说明河水中溶解有氧气C.少量高锰酸钾溶于水形成的稀溶液,常作消毒杀菌剂D.碘不能溶于酒精中,碘与酒精不能形成溶液7.日常生活中,时刻离不开溶液,腌咸蛋用的盐水是氯化钠溶液,其中溶质是,溶剂是;汽水是二氧化碳气体、蔗糖、香精的水溶液,其中溶质是,溶剂是___ _;药用2%的碘酒溶液,其中溶质是,溶剂是;家用米醋的溶质主要是,溶剂是。
8.请你各举一个实例,说明下列有关溶液的叙述是错误的。
《物质在水中的分散状况》教学设计一、【教材分析】《物质在水中的分散状况》这节课是8年级上第一章第4节的内容,主要介绍了溶液、悬浊液、乳浊液三种混合态的特点以及常见的溶剂,是在学生学完水的组成、水的浮力后,对水的一些特性的首次学习,也是从物理知识向化学知识的过渡,同时为以后物质的溶解性、溶质质量分数等有关知识的学习打下良好的基础。
学生通过小学科学的学习已经知道了液体之间的溶解现象,而平时的生活经验也让学生对溶液、悬浊液、乳浊液有了较为直观的认识,但是区分它们则需用到比较、分类、猜想和实验探究等多种科学方法,是一堂与生活实际结合比较紧密的课,教材的这个编法符合学生的认知层次,是一种螺旋式上升的科学规律,我个人觉得是比较好的。
二、【学情分析】经过七年级及小学的科学学习,他们对科学探究一般步骤已比较熟悉,在加上八年级学生的认知特点,学生已经初步具备实验观察的能力,以及能细心观察实验,描述出实验现象,并归纳总结。
同时学生对课堂自主、民主的要求较为强烈,所以此节课设计以学生猜想、比较和实验探究的形式为载体来形成学生的知识体系,是受学生欢迎的。
三、【教学目标】(一)知识与技能:1、掌握溶液的概念,能区别溶液、悬浊液、乳浊液。
2、了解溶液的组成,学会分析溶液中的溶剂和溶质。
3、了解其他常见的溶剂。
(二)过程与方法1、运用实验探究方法来区别溶液、悬浊液、乳浊液。
2、培养学生运用科学知识分析日常生活有关现象的能力。
(三)情感态度与价值观1、培养学生细心的好习惯,让学生知道生活中只要你细心观察,你会发现很多有趣的现象,使学生对生活充满乐观的态度。
2、让学生养成积极探索、勇于创新的好习惯。
四、【教学重点及难点】重点:溶液、悬浊液、乳浊液的特征及其区分;溶液中溶质、溶剂的判断。
难点:溶液概念的理解;准确区别悬浊液、乳浊液与溶液。
五、【教学过程】(一)图片导入,提出问题1、出示下列图片,提出问题:同学们平时所喝的这三种饮料味道一样吗?图1 牛奶图2 橙汁图3雪碧2、这些饮料中有什么物质?它们是如何形成的呢?由此引导学生认识:这些饮料都是水和其他物质混合在一起的,其他物质分散在水的各处。
第周上课时间月日(星期)本学期累计教案个
第六节物质在水中的分散状况
教学目标:1、掌握溶液的概念,能区别溶液、悬浊液、乳浊液。
2、了解溶液的组成,学会分析溶液中的溶剂和溶质。
3、了解及其他常见的溶剂。
教学重点:重点:物质的溶解性
教学难点:溶解的概念
教学用具:多媒体PPT
教学过程:
【引入】
生活中,将蔗糖放入水中,发现蔗糖,水变成了,说明,蔗糖在中了。
通过实验还会发现许多物质能溶解在其它物质中。
【实验】
1、将深紫色的高锰酸钾(或硫酸铜)晶体放如水中,有什么现象?
――高锰酸钾固体不见了,得到紫红色的液体
2、将固体碘(黑紫色)加入酒精中,又有什么现象?
――碘消失,得到暗黄的液体
结论:高锰酸钾固体能溶解在水中,碘能溶解在酒精中。
一、溶液
1、溶质:被溶解的物质称为溶质(可以是固体、液体、气体)
2、溶剂:能溶解其他物质的物质
3、溶液:溶质在溶剂中溶解后得到的物质(混合物)(碘酒、高锰酸钾溶液、糖水、盐水)【思考】以上溶质是固体,那么溶质可否是液体或气体呢?
――可以。
举例:酒精中的水是溶剂,乙醇是溶质;汽水中溶有二氧化碳;泉水中溶有矿物质外,还溶有氧气、二氧化碳等。
【思考】:1、果汁能溶于水中,果汁是溶质吗?
――不是,果汁中已经溶有许多物质,本身就是溶液
2、河水中溶解了哪些物质,能用来养鱼。
――河水中溶有矿物质,还溶有氧气等,冷开水中的氧气、矿物质很少,不能提供鱼生活所必需得物质。
在我们的现实生活中,处处离不开溶液:①把两种能够起反应的固体物质混合在一起,反应进行得很慢,但如果把这两种物质分别配成溶液,然后把两种溶液混合,反应进行得快。
②人和动物、植物摄取养料,必须溶液才能吸收。
③生活中的酒、醋、酱油以及众多的饮料都是溶液。
【实验】准备一杯泥浆水,一杯植物油和水的混合物,观察,让学生描述现象
二、悬浊液和乳浊液
1、悬浊液:固体小颗粒悬浮在液体里形成的物质。
有些药水如“钡餐”服用时需要摇匀,液体会变得混浊不透明,就是悬浊液。
2、乳浊液:小液滴分散在(不相溶的)液体里形成的物质。
牛奶,乳白色,不透明,放的时间长一些,会出现一层白色油脂。
这就是乳浊液。
3、混合物:有多种物质组成的物质。
生活中很多象糖水一样的物质,它们有很多的成分混合在一起,就是混合物。
溶液、悬浊液、乳浊液都是混合物。
【思考】将泥浆水、牛奶与高锰酸钾水溶液、蔗糖溶液情况比较,能不能说出溶液、悬浊液、乳浊液的区别与联系?
【实验】P30物质的混合,把洗衣粉、食盐、色拉油、粉笔灰等分别放入4个装有清水的小烧杯中。
用放大镜观察并记录现象,再用玻璃棒搅拌、静置。
请学生叙述现象,找出各自的特点:食盐不断地向水中扩散,溶解在水中。
洗衣粉和色拉油与水形成的混合物浑浊、不均匀,静置后分层.色拉油在汽油中形成溶液。
讨论后得出:
【总结】:(1)溶液有均一、稳定(放置一段时间也不会分层)的特点。
(2)溶液、悬浊液和乳浊液本质区别是在水里颗粒的大小不同。
(3)色拉油在汽油中形成溶液。
说明,同一物质在不同的溶剂中的溶解能力是不同的。
【讨论】生活中常接触的有哪些溶液,哪些悬浊液和乳浊液,它们之间有什么不同。
三、常用的溶剂(水溶剂、有机溶剂)
水能溶解很多种物质,是最常用的较好的溶剂。
常用的溶剂还有酒精、汽油、香蕉水等。
实例:碘酒溶液中酒精是溶剂;油漆中的香蕉水是有机溶剂。
一种液体溶解在另一种液体中,量少的一种为溶质。
如果有一种液体为水,不管水量的多少,都把水作溶剂。
95%的酒精中5%的水是溶剂
【思考】1、衣服上沾上了油怎么办?――用汽油擦
2、联系生活,介绍干洗原理。
――我们穿的有些衣服的衣料是由天然纤维,如羊毛、真丝等制造的,湿水后会缩水、变形甚至退色。
遇到这类衣服或衣物沾上墨汁、指甲油等用水难洗的污渍,就需要干洗。
干洗时,干洗店使用一些有机溶剂作为干洗液,八油性污渍洗掉。
由于干洗溶剂都是一些致癌物质或具有中度毒性,对人体有害。
所以,拿去干洗的衣物要相隔数天才可领回,时残留的干洗溶剂先挥发掉。
【课堂小结】让学生谈谈本节课体会
【教学后记】本节课充分了利用多媒体的优势,学生学的轻松,在这个基础上再辅以一些演示实验,效果更好,唯一难的是所教的学生来自农村,接触面和知识面不宽,导致有些物体是怎么样都都搞不清楚,更谈不上思考它在水中是什么液了,比如色拉油,学生就没见过。