原子轨道空间分布图的描绘
- 格式:ppt
- 大小:7.58 MB
- 文档页数:11

实习1 原子轨道空间分布图的描绘一、目的1. 通过计算和绘制ψ2pz 的空间分布图并讨论它的各种性质2. 加深对原子结构的理解,为进一步学习化学键理论打下基础。
二、步骤解氢原子的S chro ding er 方程,可得原子轨道的数学表达式。
例如θπψcos )/()24(02/01302a r pz ea r a --=(1.1)根据ψ的数学表达式,即可描绘出ψ的空间分布图。
1.1 作ψ-r 图取a 0作为r 的单位,π241作为的单位,则可以简化为 θψcos 2/2r pz re -= (1.2)(1) 按(1.2)式计算下表所规定的r 、θ值时的ψ2pz 值。
(2) 根据下表所列数据,对每个θ值作一条y2pz -r 的关系曲线(以ψ2pz 为纵坐标,r 为横坐标)。
6条曲线画在同一张坐标纸上,得ψ2pz -r 图1.2 作ψ空间分布图(1) 根据所画ψ2pz -r 的图,读出下表所需的数据,对应于每个θ、ψ2pz ,值应读出两个r 值。
(2) 在直角坐标纸上选取横轴为x 轴,纵轴为z 轴,原点为原子核位置;从原点出发,按上表θ值作辐射线。
根据表中所列的r ,θ和ψ的数据,标出各个ψ值相同的坐标位置,画出各条ψ的等值线并标明ψ值。
(3) 将θ值从90°扩充到180°,表明ψ的正负号。
(4) 求出最大|y|的坐标位置及该点的数值,并在图上表明。
1.3讨论(1)从上述平面图形出发,讨论ψ2pz的空间分布图形。
[从图形对x轴、y轴、z轴、xy平面的对称性、节面以及图形的大小(|y|=0.1为界面)等方面进行讨论]。
(2)与ψ2pz等值线图形对比,讨论ψ22pz的等值线图形。
(3)与ψ2pz图形对比讨论y2pz和ψ22pz的空间分布图。

原子轨道表示式轨道表示式,是表示原子核外电子排布的图式之一,又称电子排布图。
用一个方框、圆圈或两条短线表示一个给定量子数n、l、m的轨道,用箭头“↑”或“↓”来区别ms的不同电子。
可以反映粒子的电子层、电子亚层和自旋方向。
但无法体现伸展方向。
可体现泡利不相容原理、能量最低原理和洪特规则。
【遵守原则】1、泡利不相容原理可以简单叙述为:一个原子轨道中最多只能容纳两个电子,并且这两个电子的自旋方向必须相反。
因而可知s亚层只有一个轨道,因而最多只能容纳两个电子,p亚层有三个轨道,最多可容纳六个电子也可以得知,第一电子层K层中因只有1s亚层,所以最多可容纳两个电子,而第二电子层L层中有2s和2p亚层,总共可以容纳八个电子,可的第n层中最多可容纳的电子数为2乘以n的平方个电子。
2、能量最低原理自然界一个普遍的规律是“能量越低越稳定”。
原子中的电子也是如此。
在不违反泡利原理的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态。
3、洪特规则从光谱实验结果总结出来的洪特规则有两方面的含义:一是对于基态原子,电子在能量相同的轨道排布时,将尽可能分占不同的轨道并且自旋方向相同;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于全满(s2、p6、d10、f14)半满(s1、p3、d5、f7)全空(s0、p0、d0、f0)时比较稳定。
【书写方法】利用能量最低原理、泡利不相容原理和洪特规则,参考基态原子的核外电子在原子轨道上的排布顺序,首先应确定原子核外电子的数目,再确定其排布顺序,最后根据泡利不相容原理和洪特规则写出其轨道表示式。
值得说明的是,因元素的化学性质与价电子的数目密切相关,因而多数情况下,为了便于研究化学性质与价电子的数目之间的关系,常常只写出原子的价电子的轨道表示式,而内层电子的轨道的表示则可以简化表示,即用相应的稀有气体的元素符号加方括号表示。
【关系】原子的轨道表示式与核外电子排布式描述的内容是完全相同的,相对而言,轨道表示式要更加详细一些,它既能明确表示出原子的核外电子排布在哪些电子层、电子亚层上,还能表示出这些电子是处于自旋相同还是自旋相反的状态,而核外电子排布式不具备后一项功能。

第一章原子结构第三节氢原子结构的量子力学描述1.3.4 原子轨道与电子云的空间图像由于ψ(n, l, m)(x, y, z) 是一个三维空间的函数,我们很难用适当的、简单的图形表示清楚。
因此,在数学上,我们借助球坐标,作相应的变换,(x, y, z) 变换为ψ(r, q, ϕ)。
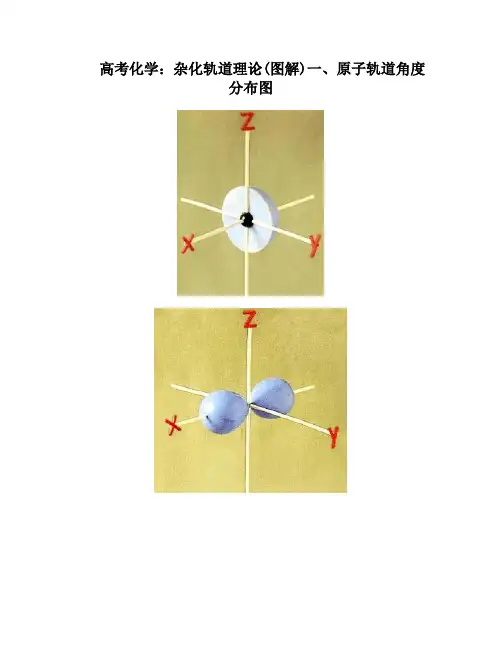
使ψ(n, l, m)x = r⋅sin q⋅cosϕy = r⋅sin q⋅sinϕz = r⋅cos qr = (x2 + y2 + z2)½经过坐标变换后,ψ(r, θ, ϕ) 可以分解为:(n, l, m)◆ψ(n, l, m)(r, θ, ϕ) = R(n, l)(r)⋅Y(l, m)(q, ϕ)◆R(n, l)(r):波函数的径向部分,由n, l 决定◆Y(l, m)(q, ϕ):波函数的角度部分,由l, m 决定原子轨道的角度分布图原子轨道的角度分布图(q, ϕ) 随q, ϕ变化的角度分布图表示不同方位上Ψ的相对大小,即Y(l, m)图像(径向部分视为常量)作图方法:①原子核为原点,引出方向为(q, ϕ)的向量;②从原点起,沿此向量方向截取| 的线段;长度= | Y l, m(q, ϕ)③所有这些向量的端点在空间组成一个立体曲面,就是波函数的角度分布图。
q q φq cos A cos π43),(==Y 为例:以z p 2角度函数Y l, m (q , φ)随q , φ变化的图象:S 轨道: 00012s Y Y π==s, p, d 原子轨道角度分布图(剖面正视图)s, p, d 原子轨道角度分布图(立体视图)原子轨道的角度分布图突出表示:◆原子轨道在空间伸展的极大值方向◆原子轨道的正负号(对称性)◆这些对讨论化学键形成时的轨道重叠最大方向有极其重要作用。
原子轨道的径向分布图原子轨道的径向分布图原子轨道的径向分布图:波函数径向部分R(r) 随r 变化所作的图作图方法:(r)的表达式。
写出Rn, l例. 氢原子波函数ψ( r, q, ϕ)(1s原子轨道)的径向部分为:100R10(r) = 2(1/a03)1/2 exp(-r/a0)求出不同r对应的R(r)值,并以r为横标、 R(r)为纵标作图。


高考化学:杂化轨道理论(图解)一、原子轨道角度分布图S PxPy Pz dz2dx2-y2dxy dxz dyz二、共价键理论和分子结构㈠、共价键理论简介1、经典的化学键电子理论:1916年德国化学家柯塞尔(Kossel)和1919年美国化学家路易斯(Lewis)等提出了化学键的电子理论。
他们根据稀有气体原子的电子层结构特别稳定这一事实,提出各元素原子总是力图(通过得失电子或共用电子对)使其最外层具有8电子的稳定结构。
柯塞尔用电子的得失解释正负离子的结合。
路易斯提出,原子通过共用电子对而形成的化学键称为共价键(covalent[k?u`veilent]bond[b?nd])。
用黑点代表价电子(即最外层s,p轨道上的电子),可以表示原子形成分子时共用一对或若干对电子以满足稀有气体原子的电子结构。
为了方便,常用短线代替黑点,用“-”表示共用1对电子形成的共价单键,用“=”表示2对电子形成的共价双键,“≡”表示3对电子形成的共价叁键。
原子单独拥有的未成键的电子对叫做孤对电子(lone[l?un]pair[pε?]e lectron[i`lektr?n])。
Lewis结构式的书写规则又称八隅规则(即8电子结构)。
评价贡献:Lewis共价概念初步解释了一些简单非金属原子间形成共价分子的过程及其与离子键的区别。
局限性:①、未能阐明共价键的本质和特性;②、八隅规则的例外很多。
PCl5SF6BeCl2BF3NO,NO2…中心原子周围价电子数10 12 4 6 含奇数价电子的分子…③、不能解释某些分子的性质。
含有未成对电子的分子通常是顺磁性的(即它们在磁场中表现出磁性)例如O2。
2、1927年德国的海特勒Heitler和美籍德国人的伦敦London两位化学家建立了现代价键理论,简称VB理论(电子配对法)。
1931年,鲍林在电子配对的基础上提出了杂化轨道理论的概念,获1954年诺贝尔化学奖。
3、1928年-1932年,德国的洪特(F.Hund)和美国的马利肯(R.S.Mulliken)两位化学家提出分子轨道理论,简称MO理论。




高中杂化轨道理论(图解)一、原子轨道角度分布图二、共价键理论和分子结构价键法(VB法)价键理论一:1、要点:⑴、共价键的形成条件:①、先决条件:原子具有未成对电子;②、配对电子参与成键的原子轨道要满足对称匹配、能量相近以及最大重叠的原则;③、两原子具有成单的自旋相反的电子配对,服从保里不相容原理。
⑵、共价键的本质:是由于原子相互接近时轨道重叠,原子间通过共用自旋相反的电子使能量降低而成键。
⑶、共价键的特征:①、饱和性,一个原子有几个未成对电子(包括激发后形成的未成对电子),便和几个自旋相反的电子配对成键;而未成对电子数是有限的,故形成化学键的数目是有限的。
②、根据原子轨道最大重叠原理,原子轨道沿其角度分布最大值方向重叠,即共价键具有一定的方向性。
⑷、共价键的类型:单键、双键和叁键。
①、σ键和π键。
ⅰ、σ键:沿键轴方向重叠,呈圆柱形对称,称为σ轨道,生成的键称为σ键σ是希腊字母,相当于英文的s,是对称Symmetry[`simitri]这个字的第一个字母)。
σ键形成的方式:ⅱ、π键:两个p 轨道彼此平行地重叠起来,轨道的对称面是通过键轴的平面,这个对称面就叫节面,这样的轨道称为π轨道,生成的键称为π键(π相当于英文的p ,是平行parallel[`p ?r ?lel]的第一个字母)。
π键的形成过程:,σ键和π键的比较 σ键(共价键中都存在σ键) π键 (只存在不饱和共价键中)重叠方式 (成建方向)沿两电子云(原子轨道)的键轴方向以“头碰头”的方式遵循原子轨道最大程度重叠原理进行重叠两互相平行的电子云(原子轨道)以“肩并肩”的方式遵循原子轨道最大程度重叠原理进行重叠 重叠程度重叠程度较大 重叠程度较小 电子云形状共价键电子云(重叠部分)呈轴对称 共价键电子云(重叠部分)呈镜像对称 牢固程度强度较大,键能大,较牢固,不易断裂 强度较小,键能较小,不很牢固,易断裂 化学活泼性不活泼,比π键稳定 活泼,易发生化学反应健 型项 目类型s-s、s-p、、p-p、s-SP杂化轨道、s-SP2杂化轨道、s-SP3杂化轨道、杂化轨道间p-pπ键,、p-p大π键是否能旋转可绕键轴旋转不可旋转,存在的规律共价单键是σ键,共价双键有一个σ键,有一个π键;共价叁键有一个σ键,有两个π键。