杂化轨道详细解说
- 格式:doc
- 大小:28.50 KB
- 文档页数:7

杂化轨道理论(图解)一、原子轨道角度分布图二、共价键理论和分子结构㈠、共价键理论简介1、经典的化学键电子理论:1916年德国化学家柯塞尔(Kossel)和1919年美国化学家路易斯(Lewis)等提出了化学键的电子理论。
他们根据稀有气体原子的电子层结构特别稳定这一事实,提出各元素原子总是力图(通过得失电子或共用电子对)使其最外层具有8电子的稳定结构。
柯塞尔用电子的得失解释正负离子的结合。
路易斯提出,原子通过共用电子对而形成的化学键称为共价键(covalent [k?u`veilent]bond[b?nd])。
用黑点代表价电子(即最外层s,p轨道上的电子),可以表示原子形成分子时共用一对或若干对电子以满足稀有气体原子的电子结构。
为了方便,常用短线代替黑点,用“-”表示共用1对电子形成的共价单键,用“=”表示2对电子形成的共价双键,“≡”表示3对电子形成的共价叁键。
原子单独拥有的未成键的电子对叫做孤对电子(lone[l?un]pair[pε?]electron[i`lektr?n])。
Lewis结构式的书写规则又称八隅规则(即8电子结构)。
评价贡献:Lewis共价概念初步解释了一些简单非金属原子间形成共价分子的过程及其与离子键的区别。
局限性:①、未能阐明共价键的本质和特性;②、八隅规则的例外很多。
PCl5SF6BeCl2BF3NO,NO2…中心原子周围价电子数10 12 4 6 含奇数价电子的分子…③、不能解释某些分子的性质。
含有未成对电子的分子通常是顺磁性的(即它们在磁场中表现出磁性)例如O2。
2、1927年德国的海特勒Heitler和美籍德国人的伦敦London两位化学家建立了现代价键理论,简称VB理论(电子配对法)。
1931年,鲍林在电子配对的基础上提出了杂化轨道理论的概念,获1954年诺贝尔化学奖。
3、1928年-1932年马利肯由于建立和发展分子轨道理论荣获得1966年诺贝尔化学奖。
MO法和VB法是两种根本不同的物理方法;都是电子运动状态的近似描述;在一定条件下它们具有等价性。

高中化学7:杂化轨道1、概念理解原子在形成分子时,原子轨道不可能只重叠而本身不变,实际上个原子的价电子运动状态必然改变,而使成键能力尽可能增加,体系能量尽可能降低。
能量相近的不同原子轨道重新合成相同数目的新原子轨道。
通常有sp型、dsp型、spd型等。
杂化并非一个实际过程,而是一个数学概念。
为了得到波动方程有关价层电子的解,及波函数而采取的一个步骤。
和原有的s、p轨道相比,杂化轨道分布图具有一个肥大的正瓣,这一区域大大有利于成键轨道之间的重叠。
而且杂化轨道空间分布合理,降低了成键电子的排斥。
2个方面都有利于体系能量的下降。
2、价层电子对互斥理论(VSEPR理论)对轨道形状的推测2.1、价层电子对互斥理论(VSEPR理论):对于一个ABm型分子(或离子),围绕中心A原子的价层对子对(包括成键电子对和未成键的孤电子对)的空间分布是受静电相互作用所支配。
电子对之间尽可能互相远离,这样斥力小,体系趋于稳定。
2.2、A原子价层电子对数的确定:[A原子价层电子数 + B原子提供的用于形成共价单键的电子数(双剑、三键均按生成一个单键考虑)]/2若是阴离子,电子数要加阴离子电荷数,阳离子则要减去。
B是H或卤素元素,每个原子提供一个共用电子。
B若是是氧族元素,规定不提供共用电子。
四氯化碲TeCl4分子:Te有6个价层电子,加上4个Cl提供的共用电子,中心Te原子价层电子数等于10,对数为5。
SO42-离子:S有6个价层电子,规定O原子不提供共用电子,加上离子电荷数2,中心S 原子价层电子数等于8,对数为4。
2.3、VSEPR理论推测分子形状:判断非过渡元素化合物的分子(或离子)的几何构型是相当成功的。
价层电子对数在4以内,未发现例外;价层电子对数为5、6时,发现个别例外;价层电子对数为7以上时,中心不单一,出入较大;步骤:1、确定中心原子的价层电子对数2、确定价层电子对对应的最佳分布构型:2直线、3平面三角、4正四面体、5三角双锥体、6正八面体。

杂化轨道解释
杂化轨道是指原子中的各个电子轨道(s、p、d等)在化学键
形成过程中重新排列和重新组合形成的一系列新的轨道。
原子中的电子在形成化学键时,会发生轨道重叠,电子会重新排列在空间中形成新的轨道,这些轨道被称为杂化轨道。
杂化轨道的形成可以通过薛定谔方程进行计算。
在计算过程中,原子的电子云会被重新组合成一些新的轨道,这些新的轨道与原来的轨道具有不同的性质和形状。
最常见的杂化轨道包括sp、sp²和sp³轨道。
例如,在形成氨分子(NH₃)的化学键时,氮原子的一个2s
轨道和三个2p轨道会发生杂化,形成四个新的sp³杂化轨道,这四个轨道平面形成一个四面体。
杂化轨道的形成可以解释很多分子的几何结构和化学性质。
通过杂化轨道的探讨,可以帮助我们理解分子中原子之间的键合和空间排列。
杂化轨道理论在化学中得到广泛应用,是解释分子结构和反应机理的重要工具。




杂化轨道详细解说杂化轨道是天文物理学术语,指的是某物体以夸克和引力方式运动的特定轨道。
可以用高斯楔体系统来描述,这是由洛伦兹方程式和引力所建立的轨道,因此并不是真正的轨道。
这种轨道被用于高精确度的星表运动解算,也被应用于地球卫星和无人机轨道轨迹计算。
杂化轨道被认为是对对对象(星体或行星)运动进行模拟的最完美的方法,但只有在其非常复杂的情况下,例如兙形星系的坠落入中央星系的情况,杂化轨道才能从小 inner scale获得结果。
杂化轨道中包含的洛伦兹方程是一系列解方程,解决了一个或多个物体运动问题,其中包括引力。
引力是一种由物体产生的力量,这个力量源于物体之间的相互作用,它控制着物体之间的位置和运动的方向。
洛伦兹方程用数学的方式来描述引力,并且它可以计算出每个物体的轨道,而且它同时也被用在卫星轨道运行动态问题。
杂化轨道的基本原理是引力的关联,每一个将被计算的物体都会受到来自其它物体的引力影响。
因此,为了计算杂化轨道,需要首先对所有相关物体中互相施加引力的过程进行模拟,并将这些物体当做一个整体处理,同时考虑每个物体产生的力。
引力和速度是相关的,当引力边的物体运动速度增加,引力会更大。
最后,将物体的位置和速度转换成开普勒方程并使用数值积分技术来求解杂化轨道。
杂化轨道对计算实现复杂物体运动模拟时起着重要作用,许多复杂的运动,例如星系的坠入中央星系,星际尘埃行等,都需要杂化轨道来模拟。
这可以使模型更加精确,更加准确地预测物体的未来轨迹。
杂化轨道也被应用于宇宙学,如研究星系形状及宇宙射线源复杂的结构。
实际应用范围也包括日本和美国等各国的火星任务,用来预测他们飞行的轨道量。
而地球卫星运行也需要杂化轨道来模拟。
总的来说,杂化轨道是一种能够模拟复杂物体运动的非常有效的轨道建模方法,可以用来描述星系和宇宙结构、以及人造卫星的复杂轨道轨迹。
它可以帮助天文物理学家们更加精确地模拟宇宙结构,也被空间航天工程师们用来计算卫星轨道。



杂化轨道相关知识点
杂化轨道是化学中重要的概念之一,它是描述原子中电子轨道混合的一种方式。
杂化轨道可以解释分子的形状、键长和键角等性质,因此在化学中被广泛应用。
以下是杂化轨道相关的一些知识点:
1. 杂化轨道的定义:杂化轨道是由原子中不同的电子轨道混合形成的新的轨道。
2. 杂化轨道的类型:常见的杂化轨道有sp、sp2、sp3、sp3d、sp3d2等类型,它们分别由s、p、d电子轨道混合而成。
3. 杂化轨道的性质:杂化轨道的能量、形状和方向性都不同于原子中的电子轨道,它们可以描述分子中的sigma键和pi键。
4. 杂化轨道的应用:杂化轨道可以解释分子形状的异性体,例如乙烯和丙烯分子的C=C双键形成的sp2杂化轨道。
此外,杂化轨道还可以解释气体分子的氧化和还原反应。
5. 杂化轨道的局限性:杂化轨道是一种简化的模型,它没有考虑原子中电子运动的实际情况。
因此,它只是一种近似描述,不能完全解释分子中的所有性质。
总之,了解杂化轨道的基本概念和应用是化学学习中不可或缺的一部分,它可以帮助我们更好地理解分子的结构和性质。
- 1 -。
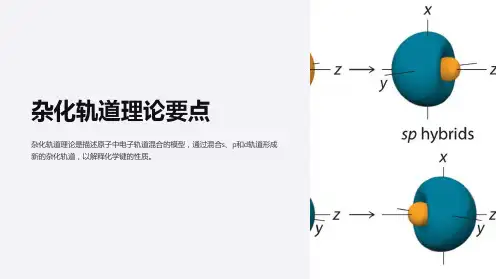
杂化轨道的类型与分子空间构型一、杂化类型有1)sp 杂化同一原子内由一个 ns 轨道和一个 np 轨道发生的杂化,称为 sp 杂化。
杂化后组成的轨道称为 sp 杂化轨道。
sp 杂化可以而且只能得到两个 sp 杂化轨道。
实验测知,气态 BeCl2 中的铍原子就是发生 sp 杂化,它是一个直线型的共价分子。
Be 原子位于两个 Cl 原子的中间,键角 180°,两个 Be-Cl 键的键长和键能都相等2)sp2 杂化同一原子内由一个 ns 轨道和二个 np 轨道发生的杂化,称为 sp2 杂化。
杂化后组成的轨道称为 sp2 杂化轨道。
气态氟化硼( BF3)中的硼原子就是 sp2 杂化,具有平面三角形的结构。
B 原子位于三角形的中心,三个 B-F 键是等同的,键角为 120°3)sp3 杂化可以而且只能得到四个 sp3 杂化轨道。
CH4 分子中的碳原子就是发生sp3 杂化,它的结构经实验测知为正四面体结构,四个 C-H 键均等同,键角为109°28。
′这样的实验结果,是电子配对法所难以解释的,但杂化轨道理论认为,激发态 C 原子( 2s12p3)的 2s 轨道与三个 2p 轨道可以发生 sp3 杂化,从而形成四个能量等同的 sp3 杂化轨道杂化类型参与杂化的原子轨道杂化轨道数杂化轨道间夹角空间构型实例二、σ键和π键sp 型的三种杂化sp sp2 sp31 个 s + 1 个 p 1 个 s +2 个 p 1 个 s +3 个 p2 个 sp 杂化轨道3 个 sp2杂化轨道4 个 sp3杂化轨道0 01090 ’180 120 28直线正三角形正四面体BeCl2 2H2BF3 2 4 CH4, CCl4 ,C , C Hσ键属于定域键,它可以是一般共价键,也可以是配位共价键。
一般的单键都是σ键。
原子轨道发生杂化后形成的共价键也是σ键。
由于σ键是沿轨道对称轴方向形成的,轨道间重叠程度大,所以,通常σ键的键能比较大,不易断裂,而且,由于有效重叠只有一次,所以两个原子间至多只能形成一条σ键。
杂化轨道知识点总结归纳杂化轨道是化学中一个非常重要的概念,它帮助我们理解分子的几何结构和键的性质。
本文将介绍杂化轨道的基本概念,包括杂化轨道的定义、杂化方式以及杂化轨道与分子几何结构的关系。
一、杂化轨道的定义杂化轨道是指在化学键形成过程中,原子轨道通过线性组合形成的新轨道。
原子轨道可以是具有不同能量和形状的s、p、d轨道,通过线性组合,就可以得到不同的杂化轨道。
二、杂化方式 1. sp杂化:最常见的杂化方式是sp杂化,它是s轨道和p轨道线性组合形成的。
这种杂化方式常见于碳原子的化学键形成过程中。
例如,在甲烷分子中,碳原子的一个2s轨道和三个2p轨道进行sp³杂化,形成四个sp³杂化轨道,用于与四个氢原子形成共价键。
2.sp²杂化:sp²杂化是指一个s轨道和两个p轨道的线性组合形成的。
这种杂化方式常见于碳原子形成双键的过程中。
例如,在乙烯分子中,碳原子的一个2s轨道和两个2p轨道进行sp²杂化,形成三个sp²杂化轨道,用于与两个碳原子和一个氢原子形成共价键。
3.sp杂化:sp杂化是指一个s轨道和一个p轨道的线性组合形成的。
这种杂化方式常见于碳原子形成三键的过程中。
例如,在乙炔分子中,碳原子的一个2s轨道和一个2p轨道进行sp杂化,形成两个sp杂化轨道,用于与一个碳原子和一个氢原子形成共价键。
三、杂化轨道与分子几何结构的关系杂化轨道的形成对分子的几何结构有重要的影响。
根据VSEPR理论,电子对排斥趋向于最大化分离,从而使得分子的几何结构更稳定。
通过杂化轨道的形成,原子之间形成更强的共价键,使得分子的几何结构更加稳定。
例如,在甲烷分子中,碳原子的四个sp³杂化轨道呈现出四面体的几何结构,使得四个氢原子均匀分布在碳原子周围。
这种排列方式最大化了电子对之间的排斥,使分子处于稳定状态。
在乙烯分子中,碳原子的三个sp²杂化轨道呈现出平面三角形的几何结构,使得两个碳原子之间形成双键,形成共面的平面结构。
杂化轨道详细解说杂化轨道理论是由鲍林(L. Pauling)于1931年提出的。
其是指在形成分子时,由于原子间的相互作用,同一原子中能量相近的某些原子轨道,在成键过程中重新分配能量和空间方向,组合成一系列形状、能量完全相同的新轨道而改变了原有轨道的状态,这一过程称为轨道杂化(Hybridization),所形成的新轨道叫作杂化轨道(Hybrid Orbit)。
根据参与杂化的原子轨道种类不同,杂化方式可分为sp型杂化、spd型杂化和dsp型杂化等。
根据杂化轨道是否完全相同又可分为等性杂化与不等性杂化。
其中sp型杂化可分为sp³杂化、sp²杂化和sp杂化,spd型杂化可分为sp²d杂化、sp³d杂化、sp³d²杂化等,dsp型杂化可分为dsp²杂化、dsp³杂化、d²sp³杂化等。
杂化轨道理论的提出丰富和发展了现代价键理论。
发展历程1861年,奥古斯特·凯库勒(August Kekule)提出在有机化合物中碳的四价概念。
1874年,范特霍夫(Vant Hoff)和勒贝尔(Lebel)提出了四面体学说,认为有机化合物中饱和碳原子上的4个共价键是以原子核为中心,指向正四面体的4个顶点。
1931年,鲍林(L. Pauling)和斯莱脱(Slater)在价键理论的基础上提出了杂化轨道理论,用数学方法建立了包括碳原子在内的许多原子轨道的立体模型,阐述了甲烷正四面体构型形成的理由。
1953年,中国化学家唐敖庆等统一处理了s、p、d、f轨道杂化,提出了杂化轨道一般方法,进一步丰富了杂化轨道理论的内容。
基本内容1.在形成分子时,由于原子间的相互作用,同一原子中能量相近的某些原子轨道,在成键过程中重新分配能量和空间方向,组合成一系列形状、能量完全相同的新轨道而改变了原有轨道的状态,这一过程称为轨道杂化,所形成的新轨道叫作杂化轨道,每个杂化轨道中均含有一个电子。
杂化轨道与分子的结构与性质杂化轨道是有机化学中一个重要的概念,它与分子的结构和性质密切相关。
通过杂化轨道的形成,原子可以重新排列其电子,从而形成新的分子,这对于理解化学反应和物质性质的变化非常重要。
一、杂化轨道的概念与形成杂化轨道是指原子轨道在空间上重新排列,形成新的轨道,这些新的轨道称为杂化轨道。
杂化轨道的形成是由于原子中的电子重新分布,以适应化学键的形成。
在形成杂化轨道时,原子的s轨道和p轨道可以相互混合,形成sp、sp2、sp3等不同类型的杂化轨道。
例如,碳原子的sp3杂化轨道是由一个s轨道和三个p轨道混合而成,形成一个四面体的结构。
这种杂化轨道的形成使得碳原子能够形成四个共价键,从而构成多种有机化合物。
二、杂化轨道与分子结构杂化轨道的形成对分子的结构起着重要的影响。
通过杂化轨道的混合,原子可以重新排列其电子,从而形成不同的分子结构。
以甲烷(CH4)为例,碳原子的sp3杂化轨道形成了四个等价的σ键,每个键与一个氢原子形成共价键。
这种结构使得甲烷呈现出四面体的形状,碳原子位于中心,四个氢原子均匀分布在四个顶点上。
这种结构使得甲烷分子稳定,不易发生化学反应。
另一方面,当碳原子的sp2杂化轨道形成时,它可以形成三个σ键和一个π键。
这种结构使得碳原子周围的原子排列在一个平面上,形成了类似于烯烃的结构。
例如,乙烯(C2H4)分子中的两个碳原子通过一个π键相连,使得分子呈现出平面结构。
三、杂化轨道与分子性质杂化轨道的形成对分子的性质也有很大的影响。
不同类型的杂化轨道会导致不同的化学性质。
以乙烯为例,由于其分子中存在π键,使得乙烯具有较高的反应活性。
乙烯可以发生加成反应、聚合反应等多种化学反应,形成不同的有机化合物。
这些反应活性与乙烯分子中的π键有关,而π键的形成正是由于碳原子的sp2杂化轨道。
另一方面,杂化轨道的形成也影响着分子的空间构型。
以氨气(NH3)为例,氮原子的sp3杂化轨道形成了三个σ键和一个孤对电子。
杂化轨道详细解说在成键过程中,由于原子间的相互影响,同一原子中几个能量相近的不同类型的原子轨道(即波函数),可以进行线性组合,重新分配能量和确定空间方向,组成数目相等的新的原子轨道,这种轨道重新组合的过程称为杂化(hybridization),杂化后形成的新轨道称为杂化轨道(hybrid orbital)。
杂化,是原子形成分子过程中的理论解释,具体有sp(如BeCl2)、sp(如BF3)、sp(如CH4)、spd(如PCl5)、spd(如SF)杂化等等。
核外电子在一般状态下总是处于一种较为稳定的状态,即基态。
而在某些外加作用下,电子也可以吸收能量变为一个较活跃的状态,即激发态。
在形成分子的过程中,由于原子间的相互影响,在能量相近的两个电子亚层中的单个原子中,能量较低的一个或多个电子会激发而变为激发态,进人能量较高的电子亚层中,即所谓的跃迁现象,从而形成一个或多个能量较高的电子亚层。
此时,这一个与多个原来处于较低能量的电子亚层的电子所具有的能量增加到和原来能量较高的电子亚层中的电子相同。
这样,这些电子的轨道便混杂在一起,这便是杂化,而这些电子的状态也就是所谓的杂化态。
简言之,即某原子成键时,在键合原子的作用下,价层中若干个能级相近的原子轨道有可能改变原有的状态,混杂起来并重新组合成一组有利于成键新轨道,称为杂化轨道。
这一过程称为原子轨道的杂化,简称杂化。
同一原子中能量相近的n个原子轨道。
组合后只能得到n个杂化轨道。
例如,同一原子的1个s轨道和1个p轨道,只能杂化成2个SP杂化轨道。
杂化轨道与原来的原子轨道相比,其角度分布及形状均发生了变化,— 1 —能量也趋于平均化。
但比原来未杂化的轨道成键能力强,形成的化学键的键能大,使生成的分子更稳定。
— 2 —。
高中化学7:杂化轨道1、概念理解原子在形成分子时,原子轨道不可能只重叠而本身不变,实际上个原子的价电子运动状态必然改变,而使成键能力尽可能增加,体系能量尽可能降低。
能量相近的不同原子轨道重新合成相同数目的新原子轨道。
通常有sp型、dsp型、spd型等。
杂化并非一个实际过程,而是一个数学概念。
为了得到波动方程有关价层电子的解,及波函数而采取的一个步骤。
和原有的s、p轨道相比,杂化轨道分布图具有一个肥大的正瓣,这一区域大大有利于成键轨道之间的重叠。
而且杂化轨道空间分布合理,降低了成键电子的排斥。
2个方面都有利于体系能量的下降。
2、价层电子对互斥理论(VSEPR理论)对轨道形状的推测、价层电子对互斥理论(VSEPR理论):对于一个ABm型分子(或离子),围绕中心A原子的价层对子对(包括成键电子对和未成键的孤电子对)的空间分布是受静电相互作用所支配。
电子对之间尽可能互相远离,这样斥力小,体系趋于稳定。
、A原子价层电子对数的确定:[A原子价层电子数 + B原子提供的用于形成共价单键的电子数(双剑、三键均按生成一个单键考虑)]/2若是阴离子,电子数要加阴离子电荷数,阳离子则要减去。
B是H或卤素元素,每个原子提供一个共用电子。
B若是是氧族元素,规定不提供共用电子。
四氯化碲TeCl4分子:Te有6个价层电子,加上4个Cl提供的共用电子,中心Te原子价层电子数等于10,对数为5。
SO42-离子:S有6个价层电子,规定O原子不提供共用电子,加上离子电荷数2,中心S原子价层电子数等于8,对数为4。
、VSEPR理论推测分子形状:判断非过渡元素化合物的分子(或离子)的几何构型是相当成功的。
价层电子对数在4以内,未发现例外;价层电子对数为5、6时,发现个别例外;价层电子对数为7以上时,中心不单一,出入较大;步骤:1、确定中心原子的价层电子对数2、确定价层电子对对应的最佳分布构型:2直线、3平面三角、4正四面体、5三角双锥体、6正八面体。
3、依据价层电子对相互作用斥力大小选出最稳定布局。
依此布局将配位原子排列在中心原子周围。
电子对之间斥力大小:孤-孤>孤-成>成-成按照力学分析,很好理解。
2个同等力作用1个点,稳定结构是直线,夹角180度。
3个同等力作用1个点,稳定结构是平面,夹角120度。
4个同等力作用1个点,稳定结构是(正四面体、平面正方体等),正四面体夹角度。
5个同等力作用1个点,稳定结构是三角双锥体6个同等力作用1个点,稳定结构是正八面体3、常见的sp杂化轨道、sp1杂化轨道:同层2个sp原子轨道(部分sp轨道)重新整合成2个等价轨道(2个轨道最合理的结构是组成一个平面,夹角180度,只能是直线型)。
同层2个电子,进行化合时,2个电子重新分布,典型化合物氯化铍BeCl2、sp2杂化轨道:同层3个sp原子轨道(部分sp轨道)重新整合成3个等价轨道(3个轨道最合理的结构是组成一个平面,夹角120度)。
同层2个电子,进行化合时,2个电子重新分布,典型化合物氯化铍BeCl2、sp3杂化轨道:同层4个sp原子轨道(全部sp轨道)重新整合成4个等价轨道(立体上,4个轨道最合理的结构是组成正四面体,夹角度,当有孤对电子时,由于作用力改变,夹角有稍小)。
同层4个电子,C元素,等性杂化。
典型化合物甲烷CH4,进行化合时,4个电子重新分布。
同层5个电子,N元素,不等性杂化。
典型化合物甲烷NH3,进行化合时,5个电子重新分布。
其中2个电子已经占有1个轨道,能量稍低,称孤对电子。
另外3个轨道形成3个N-H键。
孤对电子对其他3个轨道斥力较强,使3个键的夹角为度。
同层6个电子,O元素,不等性杂化。
典型化合物甲烷H2O,进行化合时,6个电子重新分布。
其中4个电子已经占有2个轨道,能量稍低,称孤对电子。
另外2个轨道形成2个O-H键。
孤对电子对其他2个轨道斥力较强,使2个键的夹角为105度左右。
杂化轨道判断公式如下:(括号内为举例,以下均以CO2为例)k=m+n当k=2 sp杂化k=3 sp2杂化k=4 sp3杂化其中n值为ABn中的n,与中心原子结合的原子数(此时n是CO2中的2)(中心原子:按字面意思理解,就是分子形成是被当做中心的原子,CO2的中心原子为C)m=(e-nd)/2m:孤电子对数(指未成键电子)e:中心原子价电子数(价电子数就是最外层电子数,C碳的e=4)n:和上面的n是同一个值d:与中心原子结合的原子最多能接收的电子数(与中心原子结合的原子指O氧原子,最外层差2 个电子排满,此处d=2)于是,CO2的k=2+(4-2*2)/2=2故CO2是sp杂化必须是ABx型才弄用此判断方法,金刚石Sp3 正四面体石墨sp2 平面六边形需要记住SO32-,中心原子S提供6个电子,氧不提供,两个负电荷等于两个电子,所以电子数为8,即为4对,sp3杂化硫酸根,分析步骤同上,也是sp3碳酸根,C提供4个,氧不提供,加两个负电荷,6电子,3对,sp2杂化硝酸根,N提供5个,氧不提供,加一个负电荷,6电子,3对,sp2杂化中心原子杂化轨道类型一、根据分子的空间构型判断根据杂化轨道理论,中心原子轨道采取一定的杂化方式后,其空间构型和键角如下:杂化轨道类型杂化轨道空间构型键角sp 直线形180°sp2 平面三角形120°sp3 正四面体109.5°由此,可以根据分子的空间构型或键角来判断中心原子轨道的杂化方式。
例如一些常见的简单分子的结构都是熟悉的,C2H2、CO2为直线型分子,键角为180°,推断其C 原子的杂化轨道类型为sp;C2H4 、C6H6为平面型分子,键角为120°,推断其C 原子的杂化轨道类型为sp2;CH4、CCl4为正四面体,键角109.5°,推断其C 原子的杂化轨道类型为sp3。
还可以扩展到以共价键形成的晶体,如:已知金刚石中的碳原子、晶体硅和石英中的硅原子,都是以正四面体结构形成共价键的,所以也都是采用sp3 杂化;已知石墨的二维结构平面内,每个碳原子与其它三个碳原子结合,形成六元环层,键角为120°,由此判断石墨的碳原子采用sp2 杂化。
二、根据价层电子对互斥理论判断教材(苏教版)的“拓展视野”中介绍了价层电子对互斥理论,根据该理论能够比较容易而准确地判断ABm型共价分子或离子的空间构型和中心原子杂化轨道类型。
中心原子的价电子对数与价电子对的几何分布、中心原子杂化轨道类型的对应关系如下表(价电子对数>4 的,高中阶段不作要求)。
中心原子价电子对数价电子对几何分布中心原子杂化类型2 直线形sp3 平面三角形sp24 正四面体sp3运用该理论的关键是能准确计算出中心原子的价电子对数,其计算方法是:1.价电子对数n =〔中心原子(A)的价电子数+配位原子(B)提供的价电子数×m〕÷2。
2.对于主族元素,中心原子(A)的价电子数=最外层电子数;配位原子中卤族原子、氢原子提供1 个价电子,氧族元素的原子按不提供电子计算;离子在计算价电子对数时,还应加上负离子的电荷数或减去正离子的电荷数。
3.中心原子孤电子对数=n(价电子对数)-m(配位原子B 数)。
4.杂化轨道由形成σ 键的电子对和孤电子对占据,因此分子或离子的空间构型为杂化轨道构型去掉孤电子对后剩余的形状。
例:指出下列分子或离子的中心原子的杂化轨道类型,并预测它们的空间构型:⑴BeCl2、H2O⑵SO3、NH3⑶NH4+、PO43-解析:第⑴组都是AB2型分子BeCl2的价电子对数n=(2+1×2)÷2=2,Be 采用sp 杂化,n-m=2-2=0,无孤对电子,故分子呈直线型;H2O 的价电子对数n=(6+1×2)÷2=4,O 采用sp3 杂化,n-m=4-2=2,有2 对孤电子对,故分子呈折线型。
第⑵组都是AB3型分子SO3的价电子对数n=(6+0×3)÷2=3,S 采用sp2 杂化,n-m=3-3=0,无孤对电子,故分子呈平面三角形;NH3的价电子对数n=(5+1×3)÷2=4,N 采用sp3 杂化,n-m=4-3=1,有1 对孤对电子,故分子呈三角锥型。
第⑶组都是AB4型离子NH4+的价电子对数n=(5+1×4-1)÷2=4,N 采用sp3 杂化,n-m=4-4=0,无孤对电子,故分子呈正四面体;PO43-的价电子对数n=(5+0×4+3)÷2=4,P 采用sp3 杂化,n-m=4-4=0,无孤对电子,分子呈正四面体结构。
三、根据σ 键数和孤电子对数逆向判断根据价层电子对互斥理论,中心原子价电子对数=σ 键数+孤电子对数,如果已知σ 键数和孤电子对数,就可以逆向判断出中心原子价电子对数,从而判断出杂化方式。
例:指出乙酸分子中原子的杂化轨道类型以及它们周围原子的空间分布情况。
解析:高能熟练书写有机分子的结构式,根据结构式就很容易得知σ 键数和孤对电子数,从而判断出杂化方式。
1号C形成4个σ 键,无孤对电子,所以有4个价电子对,C原子为sp3杂化,其周围3个H和1个C呈正四面体分布;2号C形成3个σ键,无孤对电子,所以有3个价电子对,C原子为sp2杂化,其周围的C、O、O呈正三角形分布;3号O形成2个σ键,2个孤对电子,所以有4个价电子对,C原子为sp3杂化,其周围的C和H呈折线形分布。
拿COOH来看,C和一个O形成双键,因而C是sp2杂化,因此可只是平面三角形。
脱去一个氢离子后形成一个三中心三电子的离域体系。
孤电子对:CH2O 中心原子是C原子,和2个氢原子和一个氧原子一共生成了4根键,所以已经把8个电子都形成共价键了,所以没有孤对电子了。
SO2 1个孤电子对,当然看分子中的在VSEPR模型价电子对计算理论可得SO2中心S原子的价电子对数=6/2=3,而S结合原子数为2,所以有一个孤电子对孤电子数=1/2*(a-xb) a为中心原子的价电子数x为与中心原子结合的原子数b为中心原子结合的原子最多能接受的电子数四、根据等电子原理判断教材的“资料卡”中介绍了等电子原理,即具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这里的结构特征包括中心原子的杂化轨道类型、分子的空间结构等。
因此,我们可以根据一些熟悉的分子的杂化轨道类型来判断与它互为等电子体的不熟悉的分子的杂化轨道类型。
例:指出N2O分子的空间构型和杂化轨道类型。
解析:教材中介绍的价层电子对互斥理论是比较浅显的,并没有介绍N作为配位原子应该如何计算价电子对数,在解决这样的题目时,可采用等电子原理巧解。
由于N2O与CO2互为等电子体,大家对于CO2的结构非常熟悉,直接根据直型,判断出sp杂化,当然也可以计算出CO2中的C原子的价电子对数n=(4+0×2)÷2=2,判断为sp杂化,直线型,故N2O也应为sp杂化,直线型。