单电子原子轨道
- 格式:ppt
- 大小:2.80 MB
- 文档页数:21

原子轨道的方向原子轨道是描述电子在原子中运动的概念,它的方向可以根据其主要特征进行分类。
下面将从不同的角度介绍几种原子轨道的方向。
1. s轨道s轨道是最基本的原子轨道,也是最简单的一种。
它的形状呈现为球对称,电子在这种轨道中的运动是均匀分布在空间中的。
s轨道的方向并没有明显的偏倚,可以看作是均匀分布在各个方向上。
2. p轨道p轨道是比较常见的原子轨道,它的形状呈现为两个互相垂直的球面。
根据p轨道的形状,可以将其分为三个不同的方向,分别是x 轴方向、y轴方向和z轴方向。
在每个方向上,电子的分布呈现出两个互相对称的区域,形状类似于一个沿着该轴的双叶风车。
3. d轨道d轨道是一种复杂的原子轨道,它的形状更加多样化。
根据d轨道的形状,可以将其分为五个不同的方向,分别是xy平面内的两个方向、xz平面内的两个方向和yz平面内的一个方向。
在每个方向上,电子的分布呈现出不同的形状,如四叶风车、八叶风车等。
4. f轨道f轨道是最复杂的原子轨道,它的形状更加多样且难以描述。
根据f轨道的形状,可以将其分为七个不同的方向,包括xyz三个平面内的方向以及斜对角线方向等。
在每个方向上,电子的分布呈现出复杂的形状,难以用简单的几何形状来描述。
总结起来,原子轨道的方向可以根据其形状和特征进行分类。
s轨道的方向是均匀分布在各个方向上;p轨道的方向可以分为x轴、y 轴和z轴三个方向;d轨道的方向可以分为xy平面内的两个方向、xz平面内的两个方向和yz平面内的一个方向;f轨道的方向更加复杂,可以分为xyz三个平面内的方向以及斜对角线方向等。
这些方向的不同反映了电子在原子中的运动轨迹和分布情况,对于理解原子的结构和性质具有重要的意义。

cr六个成单电子的四个量子数Cr元素是一种族17的元素,它的原子核由24个质子和24个中子构成。
它有6个成单电子,这些电子绕原子核自由运动,每个轨道有四个量子数。
本文将详细阐述Cr六个成单电子的四个量子数。
Cr元素的第一个电子轨道是1s2,该轨道有两个电子。
其四个量子数分别为:n(轨道量子数)=1,l(角量子数)=0,m(磁量子数)=+1/2和m(磁量子数)=-1/2。
第二个电子轨道是2s2,该轨道有两个电子。
其四个量子数分别为:n(轨道量子数)=2,l(角量子数)=0,m(磁量子数)=+1/2和m(磁量子数)=-1/2。
第三个电子轨道是2p6,该轨道有六个电子。
其四个量子数分别为:n(轨道量子数)=2,l(角量子数)=1,m(磁量子数)=+1,m(磁量子数)=0, m(磁量子数)=+1/2,m(磁量子数)=-1/2。
第四个电子轨道是3s2,该轨道有两个电子。
其四个量子数分别为:n(轨道量子数)=3,l(角量子数)=0,m(磁量子数)=+1/2和m(磁量子数)=-1/2。
第五个电子轨道是3p6,该轨道有六个电子。
其四个量子数分别为:n(轨道量子数)=3,l(角量子数)=1,m(磁量子数)=-1,m(磁量子数)=0, m(磁量子数)=+1/2,m(磁量子数)=-1/2。
最后一个电子轨道是3d10,该轨道有十个电子。
其四个量子数分别为:n(轨道量子数)=3,l(角量子数)=2,m(磁量子数)=-2,m(磁量子数)=-1,m (磁量子数)=-1,m(磁量子数)=0,m(磁量子数)=+1,m(磁量子数)=+1/2,m(磁量子数)=-1/2和m(磁量子数)=-1/2。
从上述可见,Cr六个成单电子的四个量子数主要分为n-轨道量子数、l-角量子数、m-磁量子数和m-磁量子数。
n表示当前电子位于第几个能级;l表示当前电子位于哪一类轨道,它可以是s轨道,p 轨道,d轨道或f轨道;m和m表示当前电子位于轨道轴上的正负磁量子数。

原子排列轨道原子排列轨道I. 前言随着科技的发展,人类对于自然界和宇宙中的奥秘有了更深入的探索和理解。
其中,原子结构是一个重要的研究领域之一。
本文将主要介绍原子排列轨道的相关知识。
II. 原子结构原子是构成物质的基本单位,由核和电子组成。
核心是由质子和中子组成,而电子绕核心运动。
原子的电子数目决定其化学性质,而电子轨道结构则决定其物理性质。
电子轨道是电子在原子核周围运动的区域,原子的不同能级对应着不同的轨道。
如图1所示,一般情况下,原子有四种不同的轨道,即:s轨道、p轨道、d轨道和f轨道。
III. s轨道s轨道是最接近原子核的轨道,对应着原子的基态能级。
在周期表中,第一周期的元素只有一个电子,它就在s轨道中。
如图2所示,s轨道是球形对称的,其形状呈现出圆形,原子中只会有一个s轨道。
因为电子在s轨道内运动的通量为零,所以s轨道内永远只有一个电子。
IV. p轨道p轨道则是第二个原子层及以后的轨道,图3展示了p轨道的形状。
p轨道有三种不同的取向,分别沿着x轴、y轴、z轴延伸,与s轨道不同的是,p轨道内最多可以容纳6个电子。
V. d轨道和f轨道在第三个原子层及更高的层次中,d轨道和f轨道也开始出现。
d轨道有5种不同的取向,最多可以容纳10个电子;f轨道有7种不同的取向,最多可以容纳14个电子。
但由于这些元素的外层电子的包容量已经达到饱和,因此他们的电子不太可能在这些轨道中,而主要在外层轨道中运动。
VI. 总结本文简要介绍了原子排列轨道的相关知识。
它们的形状和数量决定了原子的物理性质,这些性质又影响了原子的化学性质。
深入理解原子结构,对于我们探索物质世界和应用科技都有非常重要的意义。

原子轨道原子轨道(Atomic orbital)是单电子薛定谔方程的合理解ψ(x,y,z)。
若用球坐标来描述这组解,即ψ(r,θ,φ)=R(r)·Y(θ,φ),这里R(r)是与径向分布有关的函数,称为径向分布函数,用图形描述就是原子轨道的径向分布函数;Y(θ,φ)是与角度分布有关的函数,用图形描述就是角度分布函数。
1简介原子轨道(英语:atomic orbital),又称轨态,是以数学函数描述原子中电子似波行为[1][2]。
此波函数可用来计算在原子核外的特定空间中,找到原子中电子的机率,并指出电子在三维空间中的可能位置[1][3]。
“轨道”便是指在波函数界定下,电子在原子核外空间出现机率较大的区域。
具体而言,原子轨道是在环绕着一个原子的许多电子(电子云)中,个别电子可能的量子态,并以轨道波函数描述。
电子的原子与分子轨道,依照能阶排序现今普遍公认的原子结构是波耳氢原子模型:电子像行星,绕着原子核(太阳)运行。
然而,电子不能被视为形状固定的固体粒子,原子轨道也不像行星的椭圆形轨道。
更精确的比喻应是,大范围且形状特殊的“大气”(电子),分布于极小的星球(原子核)四周。
只有原子中存在唯一电子时,原子轨道才能精准符合“大气”的形状。
当原子中有越来越多电子时,电子越倾向均匀分布在原子核四周的空间体积中,因此“电子云”[4]越倾向分布在特定球形区域内(区域内电子出现机率较高)。
早在1904年,日本物理学家长冈半太郎首度发表电子以类似环绕轨道的方式在原子内运转的想法[5]。
1913年,丹麦物理学家尼尔斯·波耳提出理论,主张电子以固定的角动量环绕着体积极小的原子核运行[6]。
然而,一直到1926年、量子力学发展后,薛定谔方程式才解释了原子中的电子波动,定下关于新概念“轨道”的函数[1][7]。
由于这个新概念不同于古典物理学中的轨道想法,1932年美国化学家罗伯特·马利肯提出以“轨道”(orbital)取代“轨道”(orbit)一词[8]。
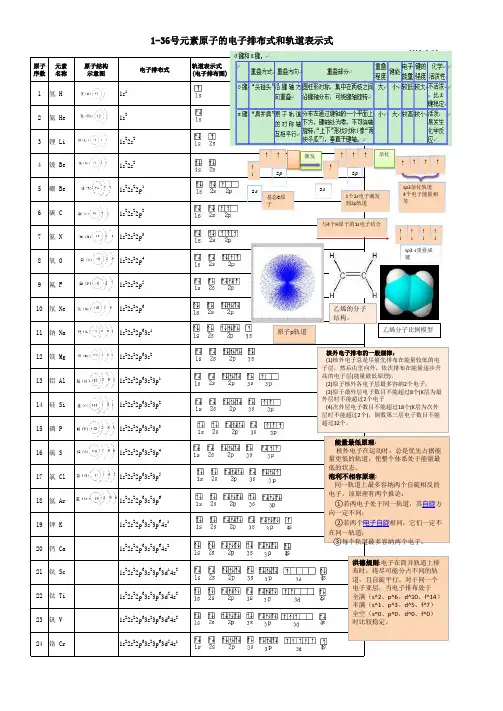


第一章原子结构与性质第一节原子结构一、能层与能级1、能层(1)含义:根据核外电子的能量不同,将核外电子分为不同的能层(电子层)。
(2)序号及符号:能层序号一、二、三、四、五、六、七……分别用K、L、M、N、O、P、Q……表示,其中每层所容纳的电子数最多为2n2 个。
(3)能量关系:能层越高,电子的能量越高,能量的高低顺序为E(K)<E(L)<E(M) <E(N)<E(O)<E(P)<E(Q)。
2、能级(1)含义:根据多电子原子的同一能层的电子的能量也可能不同,将它们分为不同能级。
(2)表示方法:分别用相应能层的序数和字母s、p、d、f等表示,如n能层的能级按能量由低到高的排列顺序为n s、n p、n d、n f等。
3、能层、能级与最多容纳的电子数能层(n)一二三四五六七……符号K L M N O P Q……能级1s2s2p3s3p3d4s4p4d4f5s……………………最多电子数22626102610142……………………281832………………2n2(1)能层序数等于该能层所包含的能级数,如第三能层有 3 个能级。
(2)s、p、d、f 各能级可容纳的最多电子数分别为 1 、3、5、7 的2倍。
(3)原子核外电子的每一能层最多可容纳的电子数是2n2 (n为能层的序数)。
二、基态与激发态原子光谱1、基态原子与激发态原子(1)基态原子:处于最低能量状态的原子。
(2)激发态原子:基态原子吸收能量,它的电子会跃迁到较高能级,变成激发态原子。
2、光谱(1)光谱的成因及分类(2)光谱分析:在现代化学中,常利用原子光谱上的 特征谱线 来鉴定元素,称为光谱分析。
三、构造原理与电子排布式 1、构造原理 (1)含义以 光谱学 事实为基础,从氢开始,随核电荷数递增,新增电子填入 能级 的顺序称为构造原理。
(2)示意图2、电子排布式将 能级 上所容纳的电子数标在该能级符号 右上角 ,并按照能层从左到右的顺序排列的式子。

铝原子的轨道表示式铝是常见的金属元素,在宇宙中普遍存在,因此被广泛应用于日常生活中,例如我们常见的铝制品如饮料罐,家用电器,汽车零件等等。
为了深入研究铝的特性,我们必须了解它的原子特性,包括电子轨道表示式。
铝原子由13个电子构成,具体的电子轨道表示式可以用以下公式表示:1s2 2s2 2p6 3s2 3p1。
数学符号1s的意思是第一层电子轨道(外层)一个电子。
数学符号2s的意思是第二层电子轨道(内层)两个电子。
数学符号2p的意思是第二层电子轨道(内层)六个电子。
数学符号3s的意思是第三层电子轨道(内层)两个电子。
数学符号3p的意思是第三层电子轨道(内层)一个电子。
这些电子轨道告诉我们,构成铝原子的电子具有两个单电子轨道,两个双电子轨道和一个三电子轨道。
它们的具体位置和特性如下:1s,2s,2p都属于低能量轨道,相对于3s和3p,它们位于原子核靠近;3s和3p都属于高能量轨道,它们位于原子核远离,并在形成化学键的过程中起着作用。
此外,电子轨道可以通过分子轨道法则来认识。
据此,认为每个键定中实现电子价键双电子轨道为单位圈,每个分子可以填充最多4个单位圈,而每个单位圈由一对单电子轨道和一对双电子轨道组成。
铝原子的电子轨道表示式为1s2 2s2 2p6 3s2 3p1,据此可以分析出铝包含三个分子轨道,每个分子轨道填充了两个单位圈,每个单位圈由一对单电子轨道和一对双电子轨道组成,其中第一个分子轨道填充两个单位圈,分别为1s2和2s2,第二个分子轨道填充两个单位圈,分别为2p6和3s2,第三个分子轨道填充一个单位圈,即3p1。
由此可见,了解铝原子的电子轨道表示式非常有必要,这是理解铝的特性,利用铝进行技术开发的基础。
只有彻底了解铝的电子轨道表示式,才能真正掌握它的特性,从而更好地开发利用它。
总之,由于铝拥有良好的导电性能、耐腐蚀性和可机械加工性,它成为了全球最常见的金属材料之一。
要想更好地开发铝,理解铝原子的电子轨道表示式就显得尤为重要。

微观轨道与宏观轨道的意义是不同的。
两者都是指粒子运行的区域,但宏观轨道一般都是光滑的曲线,而微观轨道则往往是指空间的一定范围(严格来说,不论是哪个微粒的轨道其实都是分布于全空间的,但一般它在绝大部分空间出现的概率都极小,而它经常出现的空间区域就是它的轨道),这个范围的边界是模糊的,所以也常用“云”这个概念来替代“轨道”。
在高中化学中遇到的“电子云”其实就是“电子轨道”,两个名称,一个实体!
原子轨道和分子轨道其实就是指其中的电子的轨道,这是一种约定俗成的简称,实际应为“原子中的电子轨道”与“分子中的电子轨道”。
单独一个原子时,它的电子都围绕着该原子的原子核运动,这样形成的电子轨道就是原子轨道。
当若干个原子组成分子时,原子的内层电子基本上还是围绕这个原子的原子核运动,它们的电子轨道也变化不大;但外层的电子现在就可以在更大的范围甚至是整个分子的范围内运动了,这样原来的由这些外层电子构成的原子轨道就消失了,它们重组成统一的属于整个分子的新轨道,此即分子轨道。
分子轨道往往比原子轨道复杂的多,因而出现了极多密集的能级。
这些能级分成若干组,组与组之间的能级差别较大,而组内各能级的差别很小,看起来像是连成了一片,这就形成了一个能带。
每一组能级就是一个能带。

单电子原子轨道报告草稿大伙儿好。
我是应化0904杨旭明,我报告的题目是单电子原子轨道。
大伙儿看,题目的左侧,是一个蝴蝶形状的3d轨道,而题目的右边,是3d轨道形状的蝴蝶。
微观的世界和宏观的世界,竟然有如此好的形似。
在认知世界的进程中,咱们适应将过于宏大或过于细微的东西,用现实可感的物体来象征比喻。
(点击鼠标)研究天体运动,咱们将天体比作小球,研究电子运动,咱们也比喻为小球,只是似乎出了什么问题。
(点击鼠标)星球抽象为小球,似乎是理所应该,无可厚非,而电子抽象为小球,似乎也是理所应该,无可厚非。
似乎终归是似乎,不是确信。
罢了经确信的是,电子既有波动性,又有粒子性,而经典物理学中,没有粒子性的波,也没有波性的粒子。
这是一个血淋淋的事实。
量子力学中,电子的波粒二象性不容忽略。
关于那个熟悉,江湖纷争了好久。
大伙立场不同,观点不同,各执一词。
很多人煞费苦心,这些人有牛顿、道尔顿、康普顿,巴尔默、波尔、狄更斯、惠更斯、托马斯、戴维逊、汤姆逊、德布罗意、爱因斯坦等。
最后他们取得了一个折衷的结论:波粒二象性。
这下好了,电子不是小球了,大伙也不明白电子是什么了,既是波也是粒子,这说法很玄乎。
如何来描述电子的运动,大伙儿犯难了。
大伙儿陷入了无奈与迷惘中。
这时,薛定谔出场了,以一个英雄的姿态。
他给出了一个方程。
(点击鼠标)薛定谔能够说是天才过人,却也是大器晚成,他提出波动方程的时候已经39岁了。
科学史家们作了些尽力,试图搜索出薛定谔发觉永久改变现代物理学和化学面貌的方程时究竟做了什么。
薛定谔是自由之爱的信奉者,而且一直由情人们或他的妻子陪伴着度假。
他乃至保留有一份关于他所有为数众多的情人们的详细日记存档,对每一次相会都精心作了编码。
历史学家此刻以为,在他发觉方程的那个礼拜,和一名女友住在阿尔卑斯山的赫维格别墅。
(点击鼠标)人可不能无缘无端的伟大。
从薛定谔的事迹能够看出,有爱才有奇迹,有爱才能伟大。
说到那个地址,不经感叹自己什么缘故如此碌碌无为,我扯大伙儿后腿了。