碳族元素复习
- 格式:ppt
- 大小:459.00 KB
- 文档页数:32
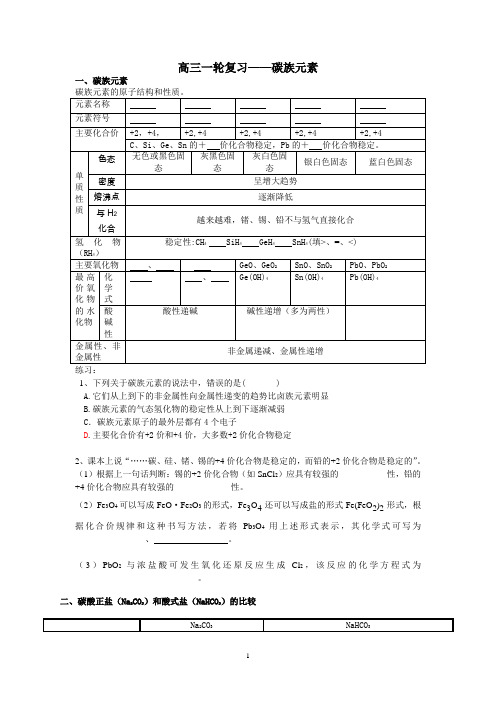
高三一轮复习——碳族元素一、碳族元素1、下列关于碳族元素的说法中,错误的是( )A.它们从上到下的非金属性向金属性递变的趋势比卤族元素明显B.碳族元素的气态氢化物的稳定性从上到下逐渐减弱C .碳族元素原子的最外层都有4个电子D .主要化合价有+2价和+4价,大多数+2价化合物稳定2、课本上说“……碳、硅、锗、锡的+4价化合物是稳定的,而铅的+2价化合物是稳定的”。
(1)根据上一句话判断:锡的+2价化合物(如SnCl 2)应具有较强的___________性,铅的+4价化合物应具有较强的_____________性。
(2)Fe 3O 4可以写成FeO ·Fe 2O 3的形式,Fe 3O 4还可以写成盐的形式Fe(FeO 2)2形式,根据化合价规律和这种书写方法,若将Pb 3O 4用上述形式表示,其化学式可写为______________ 、 。
(3)PbO 2与浓盐酸可发生氧化还原反应生成Cl 2,该反应的化学方程式为____________________________。
二、碳酸正盐(Na 2CO 3)和酸式盐(NaHCO 3)的比较23a、用酚酞做指示剂,达到滴定终点时发生的反应为:b、用甲基橙做指示剂,达到滴定终点时发生的反应为:,典型例题[例1]下列关于碳族元素的说法正确的是()A.单质都是无色晶体B.单质中硅单质熔点最高C.碳族元素形成的化合物种类最多D.在化合物中最稳定的化合价都是+4价[例2]门捷列夫在19世纪中叶,曾根据他所发现的周期律,预言过第四周期第ⅣA族元素X(当时称为类硅)。
下列有关类硅的元素性质,不正确的是()A.XH4不稳定,但有强还原性B.可用焦炭在高温下从XO2中冶炼XC.X单质的熔点比硅高D.X(OH)4的酸性比H2SiO3强[例3]若发现了114号新元素X, 则有关X元素及其化合物的叙述正确的是: ( )(A)X有稳定的气态氢化物(B)X的最高正价氧化物的化学式为XO2(C)X为非金属元素(D)X的低价氧化物是酸性氧化物[例4]下列饱和溶液中,通入过量二氧化碳气体,肯定没有沉淀产生的是()①氢氧化钠②碳酸钠③硅酸钠④次氯酸钙⑤氯化钙A、①⑤B、①②C、④⑤D、③④[例5]某种混合气体,可能含有N2、HCl、CO,常温下,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都有没有变化,再将其通过足量的过氧化钠固体,气体体积减小,最后混合气体通过红热的铜丝网,经充分反应后气体体积又减少,但仍有剩余气体,以下对混合气体组成的判断正确的是()A、一定没有氮气,至少有一氧化碳和氯化氢中的一种B、一定有氮气,一氧化碳和氯化氢C、一定有氮气,一氧化碳和氯化氢至少有其中的一种D、一定有氮气和氯化氢,没有一氧化碳【真题演练】1.(2002上海15)将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是()A B C D2、(2003全国理综8)某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。


第九讲碳族元素复习主讲人车琳高考考点1、掌握碳族元素在周期表中的位置及其性质的关系2、了解碳、硅的单质及某些氧化物、氢化物、碳酸盐、硅酸盐的性质3、了解金刚石、石墨、晶体硅、二氧化硅的结构和性质。
4、了解碳的氧化物对大气的污染及其防治,初步了解粉尘对环境及人类健康的影响。
本讲序列【阅读议点】一、概述碳族元素包括、、、、,位于第于它们位于和之间,故容易形成化合物,不易形成化合物。
常见化合物有 +4和+2,其中:+4价较稳定的元素是 , +2价较稳定的元素是。
二、碳1、同素异形体⑴金刚石:色体形晶体,构型 ,键角,硬度,导电。
⑵石墨:色不透明状固体, 金属光泽,滑腻,结构,导电。
⑶无定形碳:包括炭黑、木炭、活性炭、焦炭。
⑷C60:“足球烯”2、化性⑴稳定性:⑵可燃性: C+O2─⑶还原性: CuO+ C —C+ H2O(气) ─C+ FeO—C+ S —C+ SiO2 —C+ HNO3(浓)—C+ CO2 ─⑷既作氧化剂,又作还原剂: C+ CaO ──C+ SiO2──三、一氧化碳1、物性:___色___味气体,___溶于水,比空气___,___毒,是因为。
2、化性:⑴可燃性:CO+ O2─ (蓝色火焰)⑵还原性: CO+ CuO ─CO+ H2O(气) ─3、实验室制法四、二氧化碳1、物性: 色 味的 体, 毒,比空气 ,扩散慢, 溶于水(1:1) 其固体俗称 ,易 。
2、化性:(指出各反应在实际生产中的应用) ⑴不能燃烧,不支持燃烧,不支持呼吸。
⑵酸性氧化物:CO 2+H 2O H 2CO 3 H ++HCO 3-CO 2+ Na 2O ─ CO 2+ CaO ── CO 2 + NaOH ─ 用于_________ CO 2 + Ca(OH)2 ─ 用于_________CO 2 + Na 2CO 3+ H 2O ─ CO 2 + CaCO 3 + H 2O ─ CO 2 + NH 3 + H 2O ─ CO 2 + NH 3 + NaCl+ H 2O ─ ⑶实验室制法原理:装置: 收集: 干燥: 检验: 吸收:五、碳酸及其盐1、碳酸(H 2CO 3):___挥发,___分解,二元弱酸(HAc>H 2CO 3>C 6H 5OH) 指出:①碳酸盐除K + .Na + .NH 4+盐外,一般不溶于水,碳酸氢盐均可溶 ; ②Al 2(CO 3)3、Al(HCO 3)3等一般不存在。
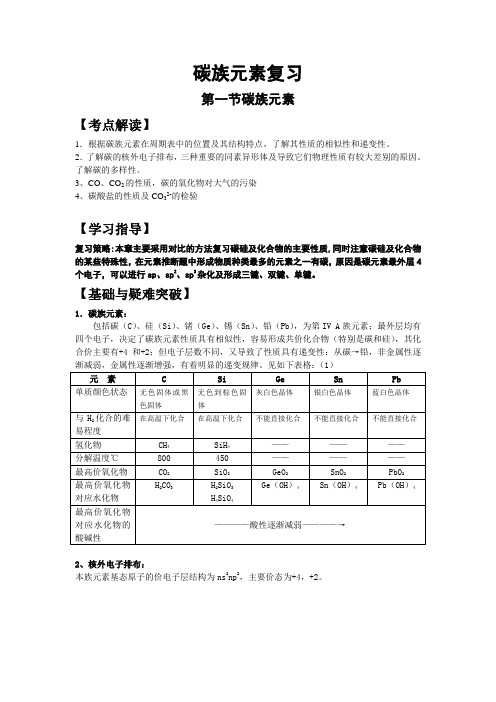
碳族元素复习第一节碳族元素【考点解读】1.根据碳族元素在周期表中的位置及其结构特点,了解其性质的相似性和递变性。
2.了解碳的核外电子排布,三种重要的同素异形体及导致它们物理性质有较大差别的原因。
了解碳的多样性。
3、CO、CO2的性质,碳的氧化物对大气的污染4、碳酸盐的性质及CO32-的检验【学习指导】复习策略:本章主要采用对比的方法复习碳硅及化合物的主要性质,同时注意碳硅及化合物的某些特殊性,在元素推断题中形成物质种类最多的元素之一有碳,原因是碳元素最外层4个电子,可以进行sp、sp2、sp3杂化及形成三键、双键、单键。
【基础与疑难突破】1.碳族元素:包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb),为第IV A族元素;最外层均有四个电子,决定了碳族元素性质具有相似性,容易形成共价化合物(特别是碳和硅),其化合价主要有+4和+2;但电子层数不同,又导致了性质具有递变性:从碳→铅,非金属性逐渐减弱,金属性逐渐增强,有着明显的递变规律。
见如下表格:(1)2、核外电子排布:本族元素基态原子的价电子层结构为ns2np2,主要价态为+4,+2。
碳的同素异形体的比较:(表2)碳元素不仅可以形成多种同素异形体,而且还可以形成多种无机化Array合物和有机化合物,是形成化合物种类最多的元素。
例题1:(1)质量相等的石墨与足球烯(C60)所含质子数()A.前者多 B. 相等 C. 后者多 D. 无法确定(2)设计一个实验证明金刚石、石墨和C60都是由碳元素组成的。
答案:(1)B (2)分别将三种物质在氧气充足的条件下燃烧,若三者产生的都是无色无味的气体且将所得气体通入澄清石灰水中,若气体都使澄清的石灰水变浑浊,则说明它们都是由碳元素组成的。
解析:(1)等质量的石墨与足球烯含有相同物质的量碳原子,所含质子数也相等3、碳单质及重要化合物的主要性质、制法及应用的比较一、碳单质:(1)物理性质:碳元素形成的同素异形体由于碳原子的排列方式不同,导致物理性质有较大的差别。
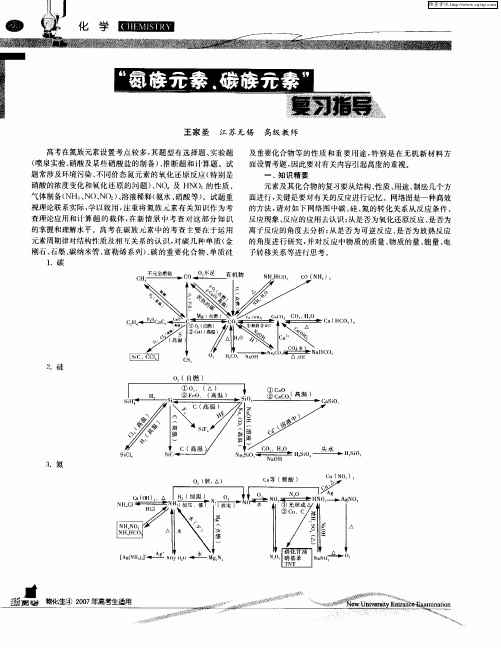

碳族元素知识要点复习题碳族元素递变性、特性,未知元素性质推导例1:下了关于碳族元素的递变规律不正确的是A自上而下元素的金属性逐渐增强B从上到下气态氢化物的稳定性依次增强C从上到下元素单质颜色逐渐变浅D从上到下元素单质的熔沸点逐渐升高例2:对于碳族元素下列说法不正确的是A自然界中有游离态的碳,没有游离态的硅B从上到下气态氢化物的稳定性依次减弱C除铅外,碳族元素均以+4价化合物较为稳定D只能形成共价化合物,不能形成离子化合物例3:对于碳族元素下列说法不正确的是A碳族元素的金属性比同周期氧族元素的金属性强B碳族元索的单质通常状况下都能导电C自然界中存在碳族元素中某元素的气态氢化物D碳族元素在自然界中都可以游离态存在例4:关于硅的化学性质的叙述中,正确的是A常温时不和任何酸反应B常温时硅与卤素单质均不反应C单质硅比金刚石熔点低D单质硅比碳的非金属性强例5:如果发现114号新元素X,则下列可能具有的性质合理的是A X是非金属元素B X有稳定的纽化物C X的+2价化合物比+4价化合物稳定D X02具有强氧化性例6:下列关于元素的叙述中,能够说明X一定位于IV A族的是A最高正价与最低负价绝对值相等B最高价氧化物的水化物为弱酸C单质晶体是-•种半导体材料D原子最外层有4个电子氧化物性质例1:关于碳和硅的氧化物叙述中,不正确的是A氧化物不一定能跟氢氧化钠反应B氧化物都能溶于水生成相应的酸C最高价氧化物都是相应酸的酸酊D氧化物在常温下不一定是气体例2:关于SiO?和CO?叙述中,不正确的是A都不能和酸反应B都能和碱反应C Si02由原子构成,CO?由分了构成D 都是酸性氧化物同素异形体例1:下列关于C60的叙述不正确的是A是一种新的化合物B与石墨、金刚石都是碳的同素异形体C其中只含有共价键D在空气中燃烧不一定生成C02 例2:能证明金刚石和石墨是同素异形体的正确解释是A两者在一定条件下可以相互转化B两者几乎有相同的熔点C在氧气中充分燃烧都只生成CO? D两者的晶体结构相同例3:根据反应:石墨二金刚石-1.894kJ, nJ'以得出的结论是A石墨比金刚石稳定B金刚石转化为石墨,能量升高C反应为物理变化D此反应为氧化还原反应原子半径、还原性、氧化性、稳定性比较例1:下列各组顺序的排列不正确的是A 原子半径:CVSiVGcVSnB 热稳定性:CHQSiHAGcH.QSnHiC 酸性强弱:H2CO3<H2SiO3<H.PO1 <H;:SO3D 还原性:CHiVSiHjVGeH’VSnHd物质用途例1:下列有关物质的用途错误的是A SiO?制光纤B Si和Gc制半导体C钢化玻璃制汽车窗玻璃D氮化硅陶瓷做导热剂E水玻璃作粘合剂例2:下列有关物质的用途错误的是A高温结构陶瓷可以制作耐酸设备B氧化铝陶瓷不可用于制作耐酸设备C氮化硅陶瓷可以制作轴承D光导纤维可以用于传像、照明Si、Si。
专题十八 碳族元素 新型无机非金属材料一、碳族元素1. 碳族元素位于元素周期表第ⅣA 族,包括 C Si Ge Sn Pb 在元素周期表中的位置(周期、族、原子序数)表示方法:原子结构示意图Si原子结构 相同点:最外层电子数相同,都是 4 个不同点:电子层数不同 相似性:不易得失电子,易形成共价键,难形成离子键,最高正价为 +4价,最低负价为—4价主要性质 递变性:随原子序数递增,元素金属性增强,非金属性减弱;氢化物稳定性减弱(CH 4可燃,SiH 4易自燃);最高价氧化物对应水化物酸性减弱,碱性增强,Ge(OH)4呈两性。
碳族元素的金属性比同周期氮族元素弱,且自上而下由非金属性向金属性递变比氮族更为明显。
2.碳所形成的单质金刚石:正四面体构型、空间网状结构的原子晶体。
无色透明,熔沸点高,硬度大,难溶于溶剂,不导电。
石墨:层状结构,层间以共价键结合。
熔点很 高 ,质软,有滑腻感,电的良导体。
C 60:形似足球,俗称"足球烯",分子晶体。
三者互称同素异形体3.硅及其化合物⑴硅 在地壳中含量仅次于氧,居第二位。
在自然界中以二氧化硅、硅酸盐等存在, ①结构 类似金刚石的原子晶体,正四面体构型,空间网状结构。
②化学性质:与NaOH 溶液反应 2Si + 2NaOH + H 2O == Na 2SiO 3 + 2H 2↑⑵二氧化硅SiO 2难溶于水,因此制H 2SiO 3的方程式为Na 2SiO 3 + 2HCl == 2NaCl + H 2SiO 3↓ 与NaOH 溶液反应SiO 2 + 2NaOH ==Na 2SiO 3 + H 2O与HF 溶液反应SiO 2 + 4HF ==SiF 4 ↑ + 2H 2O⑶硅酸盐 ①硅酸钠:可溶于水,水溶液俗称水玻璃,是一种无色粘稠的液体。
在空气中变质的方程式Na 2SiO 3 + CO 2 + 2H 2O == Na 2CO 3 + H 4SiO 4↓ ②硅酸盐 硅酸盐种类很多,结构复杂,常用氧化物的形式来表示组成。
初中化学碳单质复习教案主题:碳单质的性质及应用
一、知识点回顾
1. 碳的性质:
- 符号:C
- 族:碳族元素
- 类别:非金属元素
- 形态:固体
- 密度:约2.26克/立方厘米
- 熔点:约3550摄氏度
- 沸点:约4827摄氏度
2. 碳的同素异形体:
- 金刚石(共价型晶体)
- 石墨(层状晶体)
- C60富勒烯
3. 碳的化合价:通常为+4和-4
4. 碳的主要化合物:
- 二氧化碳(CO2)
- 一氧化碳(CO)
- 碳酸(比如二氧化碳溶于水产生的碳酸)
二、主要概念理解
1. 金刚石和石墨的差异:
- 金刚石:坚硬、透明、闪耀、不导电
- 石墨:软、墨黑、有金属性光泽、导电
2. 碳的赋役和自然界中的碳循环。
三、碳单质的应用
1. 金刚石:
- 工业领域:用于切割、磨削、钻孔
- 珠宝业:用于制作高档饰品
- 电子领域:用于制造半导体器件
2. 石墨:
- 铅笔芯的主要成分
- 高温、高压下可以转变为金刚石
四、案例分析
1. 为什么金刚石坚硬而且透明,而石墨软而且黑色?
2. 二氧化碳的排放对环境有何影响?
五、练习题解答
1. 完成反应式:C + O2 → ____
2. 描述金刚石和石墨之间的异同点。
3. 什么是C60富勒烯?其有何应用?
六、课堂小结
通过此次复习,我们对碳单质的性质和应用有了更深入的了解。
同学们在课后可以结合生活实际,观察碳单质在各个领域的应用,进一步加深对碳单质的理解。