第一轮复习碳族元素
- 格式:ppt
- 大小:1.38 MB
- 文档页数:33

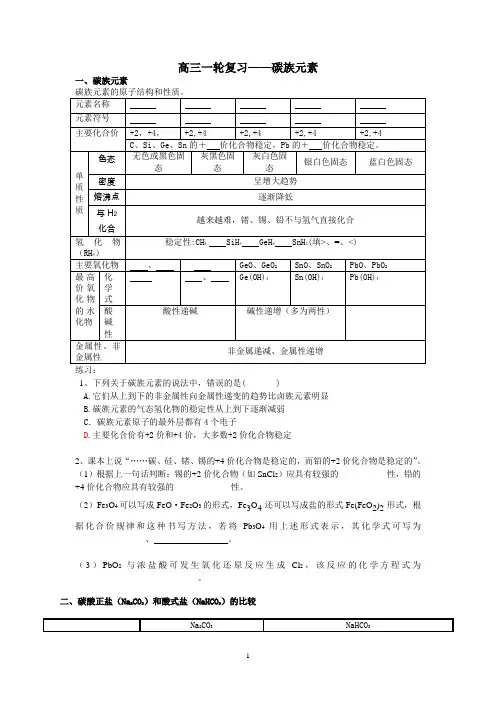
高三一轮复习——碳族元素一、碳族元素1、下列关于碳族元素的说法中,错误的是( )A.它们从上到下的非金属性向金属性递变的趋势比卤族元素明显B.碳族元素的气态氢化物的稳定性从上到下逐渐减弱C .碳族元素原子的最外层都有4个电子D .主要化合价有+2价和+4价,大多数+2价化合物稳定2、课本上说“……碳、硅、锗、锡的+4价化合物是稳定的,而铅的+2价化合物是稳定的”。
(1)根据上一句话判断:锡的+2价化合物(如SnCl 2)应具有较强的___________性,铅的+4价化合物应具有较强的_____________性。
(2)Fe 3O 4可以写成FeO ·Fe 2O 3的形式,Fe 3O 4还可以写成盐的形式Fe(FeO 2)2形式,根据化合价规律和这种书写方法,若将Pb 3O 4用上述形式表示,其化学式可写为______________ 、 。
(3)PbO 2与浓盐酸可发生氧化还原反应生成Cl 2,该反应的化学方程式为____________________________。
二、碳酸正盐(Na 2CO 3)和酸式盐(NaHCO 3)的比较23a、用酚酞做指示剂,达到滴定终点时发生的反应为:b、用甲基橙做指示剂,达到滴定终点时发生的反应为:,典型例题[例1]下列关于碳族元素的说法正确的是()A.单质都是无色晶体B.单质中硅单质熔点最高C.碳族元素形成的化合物种类最多D.在化合物中最稳定的化合价都是+4价[例2]门捷列夫在19世纪中叶,曾根据他所发现的周期律,预言过第四周期第ⅣA族元素X(当时称为类硅)。
下列有关类硅的元素性质,不正确的是()A.XH4不稳定,但有强还原性B.可用焦炭在高温下从XO2中冶炼XC.X单质的熔点比硅高D.X(OH)4的酸性比H2SiO3强[例3]若发现了114号新元素X, 则有关X元素及其化合物的叙述正确的是: ( )(A)X有稳定的气态氢化物(B)X的最高正价氧化物的化学式为XO2(C)X为非金属元素(D)X的低价氧化物是酸性氧化物[例4]下列饱和溶液中,通入过量二氧化碳气体,肯定没有沉淀产生的是()①氢氧化钠②碳酸钠③硅酸钠④次氯酸钙⑤氯化钙A、①⑤B、①②C、④⑤D、③④[例5]某种混合气体,可能含有N2、HCl、CO,常温下,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都有没有变化,再将其通过足量的过氧化钠固体,气体体积减小,最后混合气体通过红热的铜丝网,经充分反应后气体体积又减少,但仍有剩余气体,以下对混合气体组成的判断正确的是()A、一定没有氮气,至少有一氧化碳和氯化氢中的一种B、一定有氮气,一氧化碳和氯化氢C、一定有氮气,一氧化碳和氯化氢至少有其中的一种D、一定有氮气和氯化氢,没有一氧化碳【真题演练】1.(2002上海15)将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是()A B C D2、(2003全国理综8)某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。

高三化学第一轮复习:高: 课题39 第七章碳族元素第二讲硅及其化合物一、复习目标:1.掌握硅和二氧化硅的性质。
2、了解新型无机非金属材料。
二.知识回顾(一)硅及其化合物1.硅〈1〉硅的存在在自然界中,硅全部以____态存在,是构成矿物和岩石的主要成分。
在地壳中,硅的含量在所有元素中居第__位,仅次于氧。
〈2〉、硅的物理性质单质硅有晶体硅和无定形硅两种。
晶体硅是___色、有___光泽、脆而硬的固体,是良好的___材料。
〈3〉硅的化学性质(1)常温下硅的化学性质稳定,但能和氟、HF、强碱(NaOH)发生反应。
①硅和氟气反应生成四氟化硅气体,化学方程式为:。
②硅和氢氟酸反应生成四氟化硅,放出学方程式为:。
③硅与NaOH溶液作用生成硅酸钠,反应的化学方程式为:(2)在加热条件下,硅能和某些非金属单质发生反应。
①硅与氧气在加热时反应生成二氧化硅程式为。
②硅和C12在加热条件下反应生成四氯化硅的化学方程式为:〈4〉硅的制取:自然界中没有游离态的硅,常见的化合态的硅有和等。
工业上,用焦炭在电炉中还原二氧化硅得到含有少量杂质的粗硅。
反应的化学方程式:。
在该反应中,氧化剂是,还原剂。
2、二氧化硅(1)物理性质:二氧化硅广泛存在于自然界中,沙子、石英的主要成分就是二氧化硅,SiO2不溶于水,熔点、硬度。
水晶、石英是二氧化硅晶体。
(2)二氧化硅出化学性质①酸性氧化物的性质:Si02是酸性氧化物,是的酸酑,于水。
常温下Si02与NaOH溶液反应得到硅酸钠(Na2SiO3),反应的化学方程式为:高温下Si02能和碱性氧化物(如CaO)反应生成硅酸盐,反应的化学方程式为②常温下,SiO2能与氢氟酸(HF)反应,此反应常用于刻蚀玻璃,反应的化学方程式为:。
③二氧化硅的弱氧化性:Si02高温下与C作用可制取粗硅,反应的化学方程式为:_(3)二氧化硅的用途 :①Si02是制造光导纤维的主要。
②Si02常被用来制造石英表中的压电材料(3)Si02用于制造各种例3、硅酸(1)硅酸(H2Si03)硅酸不溶于水,其酸性比碳酸的酸性___。

2011高考第一轮复习教学案碳、硅及其化合物【课标要求】1.了解单质硅及其重要硅的化合物的主要性质及应用2.能综合应用硅及硅的化合物知识【知识梳理】1、本考点知识结构:2、碳族元素:①碳族元素的特征:碳族元素原子最外层电子数为4,既不容易失去电子,又不容易得到电子,易形成共价键,难形成离子键。
碳族元素形成的单质在同周期中硬度最大,熔沸点最高(如金刚石、晶体硅)。
②碳族元素的化合价:碳族元素的主要化合价有+2,+4,其中铅+2价稳定,其余元素+4价稳定。
③碳族元素的递变规律:从上到下电子层数增多,原子半径增大,原子核对最外层电子的吸引能力减弱,失电子的能力增强,从上到下由非金属递变为金属的变化非常典型。
其中碳是非金属,锡、铅是金属,硅、锗是半导体材料。
④碳族元素在自然界里的存在:自然界里碳有游离态和化合态两种;硅在地壳里无游离态,主要以含氧化合物的形式存在。
⑤几种同素异形体:碳:金刚石、石墨、C60、C70等;硅:晶体硅,无定形硅。
3、碳:在常温下碳很稳定,只在高温下能发生反应,通常表现为还原性。
①燃烧反应②与某些氧化物的反应:C+CO 22CO;C+2CuO CO2↑+2Cu;C+H2O CO+H2O(CO、H2的混合气体叫水煤气);2C+SiO 2Si+2CO↑③与氧化性酸反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O;C+4HNO3(浓)CO2↑+4NO2↑+2H2O4、一氧化碳:不溶于水,有毒(CO和血红蛋白结合,使血红蛋白无法和O2结合,而使细胞缺氧引起中毒),但由于CO无色无味因此具有更大的危险性。
①可燃性②还原性:CO+CuO CO2+Cu,CO+H2O(g)CO2+H2O5、二氧化碳:直线型(O=C=O)非极性分子,无色能溶于水,密度大于空气,可倾倒,易液化。
固态CO2俗称干冰,能升华,常用于人工降雨。
实验室制法:CaCO3+2HCl=CaCl2+CO2↑+H2O。
①酸性氧化物一—酸酐Ca(OH)2+CO2=CaCO3↓+H2O(用于检验CO2)②氧化性:CO2+C2CO;2Mg+CO 22MgO+C6、碳酸盐:①溶解性:Ca(HCO3)2>CaCO3;Na2CO3>NaHCO3。
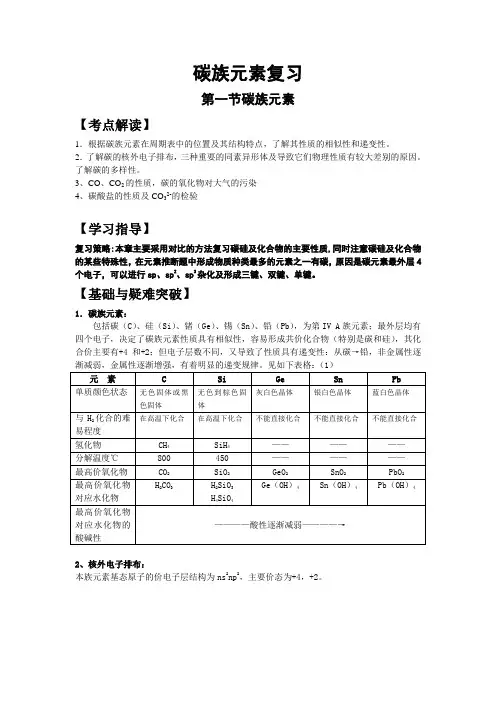
碳族元素复习第一节碳族元素【考点解读】1.根据碳族元素在周期表中的位置及其结构特点,了解其性质的相似性和递变性。
2.了解碳的核外电子排布,三种重要的同素异形体及导致它们物理性质有较大差别的原因。
了解碳的多样性。
3、CO、CO2的性质,碳的氧化物对大气的污染4、碳酸盐的性质及CO32-的检验【学习指导】复习策略:本章主要采用对比的方法复习碳硅及化合物的主要性质,同时注意碳硅及化合物的某些特殊性,在元素推断题中形成物质种类最多的元素之一有碳,原因是碳元素最外层4个电子,可以进行sp、sp2、sp3杂化及形成三键、双键、单键。
【基础与疑难突破】1.碳族元素:包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb),为第IV A族元素;最外层均有四个电子,决定了碳族元素性质具有相似性,容易形成共价化合物(特别是碳和硅),其化合价主要有+4和+2;但电子层数不同,又导致了性质具有递变性:从碳→铅,非金属性逐渐减弱,金属性逐渐增强,有着明显的递变规律。
见如下表格:(1)2、核外电子排布:本族元素基态原子的价电子层结构为ns2np2,主要价态为+4,+2。
碳的同素异形体的比较:(表2)碳元素不仅可以形成多种同素异形体,而且还可以形成多种无机化Array合物和有机化合物,是形成化合物种类最多的元素。
例题1:(1)质量相等的石墨与足球烯(C60)所含质子数()A.前者多 B. 相等 C. 后者多 D. 无法确定(2)设计一个实验证明金刚石、石墨和C60都是由碳元素组成的。
答案:(1)B (2)分别将三种物质在氧气充足的条件下燃烧,若三者产生的都是无色无味的气体且将所得气体通入澄清石灰水中,若气体都使澄清的石灰水变浑浊,则说明它们都是由碳元素组成的。
解析:(1)等质量的石墨与足球烯含有相同物质的量碳原子,所含质子数也相等3、碳单质及重要化合物的主要性质、制法及应用的比较一、碳单质:(1)物理性质:碳元素形成的同素异形体由于碳原子的排列方式不同,导致物理性质有较大的差别。




高三化学一轮复习导学案编制人:王金海陈光学审核人:张迎春使用时间:《碳的多样性》复习学案编号:班级_______ 学号姓名学习目标:1、了解碳的同素异形体2、了解碳和硅的物理性质及化学性质3、了解碳族元素性质的相似性和递变性一、碳1、碳的同素异形体碳的常见同素异形体有石墨是一种色、质、的片状固体。
金刚石是硬度、的晶体;C60是的固体。
【思考1】从定义角度分析同位素、同素异形体、同分异构体的差异:2、碳的同素异形体的结构在石墨中,碳原子呈排列,杂化方式为,每一层上的碳原子以键形成结构;层与层之间的相互作用是,易发成相对滑动。
在金刚石中,每个碳原子与相邻的个碳原子直接相连,杂化方式为,形成结构。
C60是有60个碳原子构成的,碳原子位于球的表面呈正六边形和正五边形排列。
3、碳的化学性质常温下很稳定,在高温下能发生化学反应,通常表现还原性。
(1)可燃性(2)还原性(例如:还原氧化铜、铁的氧化物、与某些氧化性酸的反应等)分别写出碳与浓硫酸,浓硝酸反应的化学方程式、4、碳的氧化物【思考2】CO具有强的还原性,能不能用浓硫酸干燥CO气体?【思考3】燃烧时火焰呈蓝色、淡蓝色的物质:【思考4】过量CO2通入NaOH溶液中,离子方程式为5、Na2CO3和NaHCO3(1)固体Na2CO3(NaHCO3)_______________________________(2)溶液NaHCO3 (Na2CO3)(3) 溶液NaCl (NaHCO3)__________________________________(4) 溶液NaOH(Na2CO3)_____ __________________________6、碳及其化合物之间转化的多样性如(1)用化学方程式表示钟乳石、石笋的成因:①②。
(2)用化学方程式表示溶洞的形成过程7、碳酸盐性质的一般规律(1)水溶性A、含K+、Na+、NH4+的正盐易溶于水,其余一般不溶于水;酸式盐均易溶于水B、一般的,在相同温度下,难溶性正盐的溶解度小于其酸式盐的溶解度,如相同条件下Ca(HCO3)2CaCO3的溶解度;酸式盐的溶解度小于其可溶性正盐的溶解度,如相同条件下Na2CO3NaHCO3的溶解度(2)热稳定性:一般的热稳定性顺序正盐>酸式盐,如相同条件下Ca(HCO3)2CaCO3;可溶性正盐>难溶性正盐,如相同条件下Na2CO3CaCO3。

高考化学碳族元素方程式总结
碳族元素指的是元素周期表ⅣA族的所有元素,包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)、鈇(Fl)五种。
以下是碳族元素方程式总结,请考生牢记。
SiO2 + 2NaOH == Na2SiO3 + H2O Si + O2 == SiO2(加热)
SiO2 + 2C == Si + 2CO(高温) SiO2 + CaO == CaSiO3 (高温)
C +2Cl2 == CCl4 (加热) C + Si == SiC (高温)
2H2SO4(浓)+ C == CO2 + 2H2O + 2SO2 加热
C + 4HNO3(浓)== CO2 + 4NO2 + 2H2O
SiO2 + 4HF == SiF4 + H2O 制磨砂玻璃
NaCO3 + SiO2 == Na2SiO3 + CO2
CaCO3 + SiO2 == CaSiO3 + CO2 此二者需高温,为制造玻璃的步骤金刚石、晶体硅:原子晶体石墨:混合晶体
8一些别称:
苛性钠NaOH 纯碱、苏打Na2CO3 小苏打NaHCO3 漂白粉Ca(ClO)2碱石灰CaO、NaOH的混合物石膏CaSO42H2O 生石膏2CaSO4H2O 高岭石Al2(Si2O5)(OH)4 石英SiO2
碳族元素方程式总结的内容确实是这些,查字典化学网期望考生能够更好的复习化学。
2021年高考第一轮复习备考专题差不多新奇出炉了,专题包含高考各科第一轮复习要点、复习方法、复习打算、复习试题,大伙儿来一起看看吧~。
2004年——2008年碳族元素高考试题1. (2004年北京卷)近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成出金刚石,具有深远意义。
下列说法不正确的是A. 由二氧化碳合成金刚石是化学变化B. 金刚石是碳的一种同位素C. 钠被氧化最终生成碳酸钠D. 金刚石中只含有非极性共价键2.玻璃的主要成分之一是二氧化硅,能在玻璃上进行蚀刻,将其制成毛玻璃和雕花玻璃的物质是()。
A.烧碱 B.纯碱 C.氢氟酸 D.盐酸3.大理石可以用作墙面、地面和厨房桌面,其主要成份是碳酸钙、食醋不慎滴在大理石桌面上,会使其失去光泽,变得粗糙,下列能正确解释此现象的是()。
A.食醋中的水使碳酸钙溶解 B.食醋中的醋酸将碳酸钙氧化C.食醋中的醋酸与碳酸钙反应并放出大量的二氧化碳气体D.食醋中的醋酸与碳酸钙发生了复分解反应4、(2008年广东卷文科基础)对于下列常见化学的认识错误..的是()A. 明矾可用作净水剂B. 干冰能用于人工降雨C. 碳酸钙是文物陶瓷的主要成分D. 小苏打是一种膨松剂,可用于制作馒头和面包5.(2004年全国)血液中血红蛋白结合的一种有毒气体是()A.氯气B.氮气C.一氧化碳D.甲烷6.(2006年广东卷)下列表述正确的是①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能A.①②③ B.②④ C.③④⑤ D.③⑤7.(08全国Ⅱ卷)对于ⅣA族元素,下列叙述中不正确的是( )A.SiO2和CO2中Si和O,C和O之间都是共价键B.C、Si、Ge的最外层电子数都是4,次外层电子数都是8C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应D.该族元素的主要化合价是+4和+28.(广东理科基础 34).根据陈述的知识,类推得出的结论正确的是A.镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O B.乙烯可使酸性高锰酸钾溶液褪色,则丙烯也可以使其褪色C.CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似D.金刚石的硬度大,则C60的硬度也大9.(2004上海卷)将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g 粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是10.(15)下图中每一方框的字母代表一种反应物或生成物:已知气态烃D (其密度在同温同压下是氢气密度的13倍)跟物质F 反应时产生明亮而带浓烈黑烟的火焰。
高三化学第一轮复习课题 38 第七章碳族元素无机非金属材料第一讲碳族元素一.复习目标:1.理解碳族元素的相似性和递变规律.2.掌握碳及其化合物的性质。
二.重点难点:碳族元素的性质比较(相似性、递变性、特殊性)三.知识回顾:(一)碳族元素1.碳族元素的组成和结构(1)碳族元素包括(名称及元素符号)_____,_____,_____,_____,_____五种元素,位于元素周期表的____族.(2)碳族元素原子最外层有__个电子,其最高正价为___,最高价氧化物及其水化物的化学式分别表示为___,___,___,气态氢化物的化学式表示为____,随着原子序数的增大,碳族元素的原子半径依次_____.(3)碳族元素位于活泼的金属向活泼的非金属过渡的中间位置,故在化学反应中不易__或__电子,易形成____键.2. 碳族元素性质的递变规律随着原子序数的增大,碳族元素由非金属元素逐渐转变为____元素,即____性逐渐增强,_____性逐渐减弱;最高价含氧酸的酸性逐渐____,碱性逐渐____;气态氢化物的稳定性逐渐____,还原性逐渐____.3.碳族元素的特殊性碳族元素的主要化合价有___和___,其中___和___有负价。
碳族元素在化合物中多以___价稳定,而铅在化合物中则以___价稳定。
铅的+4价化合物在化学反应中易得到电子,具有____性。
+2价锡的化合物具有较强的____性。
(二)、碳及其化合物1.碳的化学性质:4-C←0C→2+C→4+C〈1〉可燃性:完全燃烧不完全燃烧〈2〉还原性①与CO2反应②与CuO反应③与H2O反应④与浓H2SO4的反应⑤与浓硝酸反应〈3〉弱氧化性:与氢气作用2、碳的氧化物—— CO和CO2的比较4.除去CO 、CO 2 气体中混有的杂质 (1)CO 中混有CO 2 通过_____溶液的洗气瓶; (2)CO 2 中混有CO 通过灼热的CuO ;(3)CO 2 混有O 2 通过灼热的金属铜Cu ; (4)CO 2 中混有SO 2 通过盛有饱和的__________溶液(5)CO 2 中混有HCl 气体 通过盛有__________ 溶液的洗气瓶 (6)CO 2 中混有H 2S 可通过盛有CuSO 4溶液的洗气瓶。
2024年新人教版高考化学一轮复习讲义(新高考版)第28讲硅 无机非金属材料复习目标1.掌握Si元素的单质及其重要化合物的性质及应用。
2.掌握无机非金属材料的性质和用途。
内容索引考点一 碳族元素 硅和二氧化硅考点二 无机非金属材料真题演练 明确考向课时精练><碳族元素 硅和二氧化硅1.碳族元素概述(1)碳、硅、锗、锡、铅均属于第ⅣA 族元素,又称碳族元素,其价电子排布式为 。
(2)碳的单质①碳单质的存在形式有金刚石、石墨、无定形碳、足球烯,它们互为 。
②几种单质的结构特点金刚石: 空间网状结构;石墨:平面 层状结构,C 60是由60个碳原子形成的足球状分子晶体。
必备知识n s 2n p 2同素异形体正四面体正六边形2.硅单质硅酸盐氧化物2C+SiO23.二氧化硅高大Na2SiO3+H2OCaSiO3Na2SiO3+CO2↑SiO2+4HF===SiF4↑+2H2O光导纤维1.12C 、13C 、14C 是碳的三种同素异形体( )2.金刚石和石墨由相同的元素组成,因此它们具有相同的性质()3.石墨转变为金刚石的反应属于氧化还原反应( )4.Si 是半导体材料,可用于制作太阳能电池( )5.SiO 2与NaOH 溶液反应生成盐和水,也可以和氢氟酸反应,所以SiO 2是两性氧化物( )×××√×1.下列关于硅的说法不正确的是A.硅是非金属元素,它的单质是灰黑色、有金属光泽的固体B.硅的导电性能介于导体和绝缘体之间,是良好的半导体材料C.硅的化学性质不活泼,常温下不与任何物质发生反应D.加热到一定温度时,硅能与氯气、氧气等非金属反应关键能力一、硅和二氧化硅的性质√晶体硅的结构与金刚石类似,它是灰黑色、有金属光泽的非金属固体,故A 正确;硅常温下能和HF溶液、氢氧化钠溶液反应,故C错误;在加热时,硅能与氧气或氯气反应生成二氧化硅或四氯化硅,故D正确。
2.二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。
全国版2021版高考化学一轮复习第4章非金属及其化合物第1节碳硅及----b6b2bc1c-6ea9-11ec-bf7e-7cb59b590d7d第1节碳、硅及无机非金属材料测试描述1.了解碳、硅单质及其化合物的主要性质及应用。
2.了解碳、硅及其化合物对环境质量的影响。
3.了解常见无机非金属材料的性质和用途。
命题规律碳、硅及其化合物的性质经常在高考中被考查。
检查方法包括:结合原子结构和元素周期定律选择题型,检查碳、硅及其化合物的性质和应用;以新材料和新技术为背景,结合工艺流程图,通过填空考察了碳和硅化合物的性能和应用。
考点1碳、硅单质及其氧化物的性质1.碳的存在、性质和使用2.硅单质的存在、性质和制备(1)结构及物理性质(2)化学性质硅的化学性质不活泼,常温下不能被浓硫酸、浓硝酸等强氧化剂氧化,只能与f2、氢氟酸、强碱溶液反应;在加热条件下,能与o2、cl2等少数非金属单质化合。
写出以下相关反应的化学方程式:(3)工业制备高温反应原理:①制粗硅sio2+2c=====si+2co↑,高温3.碳和硅的氧化物(1)一氧化碳CO是一种无色无味的有毒气体,不溶于水,可作为气体燃料和冶金工业的还原剂。
(2)二氧化碳和二氧化硅高温② 粗硅Si+2Cl2==SiCl4,SiCl4+2h2==Si+4hcl的提纯。
(1)硅与碱溶液反应时,硅为还原剂,h2o为氧化剂。
高温(2)不能依据反应2c+sio2=====si+2co↑来说明c的还原性比si强,也不能依据反应高温sio2+na2co3=====na2sio3+co2↑来说明sio2水化物的酸性比h2co3强。
(3)高纯度晶体硅用作半导体材料,二氧化硅用作光纤材料。
(4)sio2是碱性氧化物,但能与hf反应,因此盛放氢氟酸不能用玻璃瓶,要用特制的塑料瓶。
盛放碱性溶液的试剂瓶不能用玻璃塞,因为sio2与碱溶液反应生成具有黏性的na2sio3。
[基本分析]判断正误,正确的画“√”,错误的画“×”。
第一节硅和碳族元素【知识纲要1】二氧化碳与二氧化硅的比较Na【知识纲要2】硅、二氧化硅化学性质的三个方面1.一般性(通性)SiO2是酸酐SiO2 + 2NaOH ==Na2SiO3 + H2O2.特殊性(规律性之外)H2SiO3、H4SiO4不溶于水的酸,它们的酸酐均为SiO2亲氟性:Si + 2F2 ==SiF4Si +4HF ==SiF4 + H2↑SiO2 +4HF==SiF4↑+ 2H2O常温下:Si +2NaOH +2H2O ==Na2SiO3 +3 H2↑3.反常性(矛盾下的客观存在)硅的还原性比碳的还原性强,但是,工业上可用碳还原二氧化硅制得晶体硅。
2C + SiO2Si + 2CO ↑按金属活动顺序表,Sn 的金属活动性比Pb 强,但是,按同一主族元素金属性强弱递变规律性得Sn 的金属性比Pb的金属性弱。
例题1 对于ⅣA族元素,下列叙述中不正确...的是()A.SiO2和CO2中,Si和O,C和O之间都是共价键B.C、Si和Ge的最外层电子数都是4,次外层电子数都8C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应D.该族元素的主要化合价是+4和+2【答案】B警悟学习同一主族元素需牢固掌握元素族的“三性”:相似性、递变性、特殊性。
第二节氯及卤族元素【知识纲要1】实验室制取氯气1.实验室制取氯气的发生装置是怎样的一套装置?答:实验室制取气体是根据反应物的状态和反应条件来选择气体的发生装置的。
常见的三大类型为:①固体和固体反应,需加热(如制O2);②固体和液体反应或液体和液体反应,不需加热(如制H2、CO2);③固体和液体反应或液体和液体反应,需加热。
现在要学习的实验室制取氯气就属于类型③。
采用圆底烧瓶作反应容器,上口连接分液漏斗滴加反应物,下底隔着石棉网加热。
可用此套装置制取CO、HCl气体。
2.为什么反应强调所用盐酸必须是浓盐酸?答:实验室制取氯气的反应中盐酸起还原剂的作用。
硅和硅酸盐工业单元复习
一、碳族元素
1.碳族元素在周期表中的位置、原子结构和性质
⑴位于周期表中的第( )族,包括( )五种元素。
⑵原子的最外层有( )个电子。
⑶主要化合价是( )。
其中( )的+4价是( ),而( )的+2是稳定的。
( )只有+4价。
4.二氧化硅是熔点( ),硬度( ),( )溶于水的固体。
5.SiO 2的的化学性质
①具有弱氧化性 SiO 2+ C==
②具有酸性氧化物的通性(硅酐)
化学 SiO 2 + CaO== (此反应用于 )
性质 SiO 2 + NaOH==
故盛放碱性溶液的试剂瓶不能用( )塞,常用( )塞。
③特性 SiO 2+ HF== 故盛放氢氟酸不能用( )瓶。
6.硅酸是( )溶于水的( )酸,其酸性比碳酸( )。
7.硅酸钠的水溶液溶液俗名( )。
写出各其中加入盐酸和通入二氧化碳时发生的化学反应方程式
( )。
8. CO 2是动、植物呼吸作用的废气成分;又是植物进行光合作用的原料气,光合作用的方程式
为 。
(9)硅是一种良好的 材料,常用于电子工业。
(10)SiO 2是高性能通信材料 的主要原料。
(11)化石原料燃烧产生大量的CO 2,使大气中CO 2含量增大,会导致 的环境问题。
(12)利用CaCO 3和Ca(HCO 3)2互相转化解释“水滴石穿”和“滴水成石”的化学解释,请写化学方程式。
“水滴石穿”:______________________;“滴水成石”:__________________________。