最新sk高三一轮复习碳硅及其化合物
- 格式:ppt
- 大小:1.61 MB
- 文档页数:45

考点一 碳、硅及其氧化物的性质与用途1.碳、硅元素在自然界中的存在形态(1)碳:既有游离态又有化合态。
(2)硅:因有亲氧性,所以自然界中只有化合态。
硅在地壳中的含量占第二位。
2.碳、硅单质的物理性质和用途碳硅结构金刚石:空间网状结构,石墨:层状结构 晶体硅:与金刚石类似的空间网状结构物理 性质 金刚石熔点高、硬度大 石墨熔点高、质软,有滑腻感晶体硅为灰黑色固体,有金属光泽、硬度大、熔点高用途金刚石用作切割刀具,石墨用作电极、铅笔芯晶体硅用作半导体材料、硅芯片和硅太阳能电池3.碳和硅的化学性质——还原性(1)碳单质的化学性质。
①与O 2反应。
A .O 2不足:2C +O 2=====点燃2CO 。
B .O 2足量:C +O 2=====点燃CO 2。
②与其他物质反应。
A .与CuO 反应:2CuO +C=====△2Cu +CO 2↑。
(冶炼金属) B .与CO 2反应:CO 2+C=====高温2CO 。
C .与水蒸气反应:C +H 2O(g)=====高温CO +H 2。
(制取水煤气)第10讲 碳、硅及其重要化合物考纲要求:1.了解碳、硅单质及其重要化合物的制备方法,掌握其主要性质及其应用。
2.了解碳、硅单质及其重要化合物对环境的影响。
D .与浓硫酸反应:C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 。
碳的还原性还表现为可将强氧化性的浓硫酸、浓硝酸分别还原为SO 2和NO 2,本身被氧化为CO 2。
(2)硅单质的化学性质。
硅的化学性质不活泼,在常温下只能与氟气(F 2)、氢氟酸(HF)、强碱反应,不能与氢气、氧气、氯气、硫酸、硝酸反应,加热时能与氧气、氯气反应。
①与O 2反应:Si +O 2=====△SiO 2。
②与Cl 2反应:Si +2Cl 2=====△SiCl 4。
③与氢氟酸反应:Si +4HF===SiF 4↑+2H 2↑。
④与NaOH 溶液反应:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑。



碳和硅及其化合物[考点要求]1.知道硅元素在自然界以SiO2及硅酸盐的形式存在2.知道晶体硅是良好的半导体材料3.了解二氧化硅与氢氟酸、碱性氧化物、强碱的反应4.了解陶瓷、玻璃、水泥等硅酸盐产品的用途几种硅酸盐制品的制备方法不作要求。
[活动探究]阅读教材《必修1》P62——第四章第1节硅[思考1]下列关于硅的说法不正确的是()A.硅是非金属元素,它的单质是灰黑色有金属光泽的固体B.硅是导电性能介于金属和绝缘体之间,是良好的半导体材料C.硅的化学性质不活泼,常温下不与任何物质反应D.加热到一定温度时,硅能与氯气、氧气等非金属反应活动一、知道硅的结构及性质1.晶体硅是色、有光泽、的固体。
熔点,半导体,不活泼,除常温下与反应外,加热时也可与反应。
2.工业制法3.硅的存在和分布[思考2]下列表述正确的是①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能A.①②③B.②④C.③④⑤D.③⑤[思考3]下列各反应中SiO2表现的是什么性质或作用?在①—④项中选出正确答案填空。
①酸性氧化物的通性②弱氧化性③与挥发性酸的盐反应制挥发性酸酐④被氢氟酸腐蚀使玻璃被雕刻。
A. SiO2+4HF==SiF4+2H2O _____________。
B. SiO2+CaCO3高温===CaSiO3+CO2↑____________。
C. SiO2+2NaOH==Na2SiO3+H2O ____________。
D. SiO2+2C高温===Si+2CO↑___________。
活动二、了解硅的重要化合物1、二氧化硅①晶体结构:②主要性质:③用途:制造光导纤维、光学仪器、玻璃原料和建筑材料。



1.C、Si单质的存在形态、物理性质及用途CO2+H2O H2CO3熟记硅及其化合物的特殊性质题组三硅的制取方法在设计制备纯硅的实验题中,常遇到的知识点有:1.正误判断,正确的打硅酸盐改写成氧化物形式的方法===BaCO3↓+H2O下列说法正确的是()A.原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值B.操作A与操作B完全相同C.该流程中硅元素的化合价发生改变D.反应器中发生的复分解反应为SiO2+2NaOH===Na2SiO3+H2O3.综合利用CO2、CO对构建低碳社会有重要意义。
(1)Li2O、Na2O、MgO均能吸收CO2。
如果寻找吸收CO2的其他物质,下列建议合理的是________(填字母)。
A.可在碱性氧化物中寻找B.可在ⅠA、ⅡA族元素形成的氧化物中寻找C.可在具有强氧化性的物质中寻找(2)Li4SiO4可用于吸收、释放CO2,原理是在500 ℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700 ℃,反应逆向进行,放出CO2,Li4SiO4再生,写出CO2与Li4SiO4反应的化学方程式:______________________________________________________________________________________________________________________________________;该反应为________(填“吸”或“放”)热反应,原因是_________________________________________________________________________________________________。
(3)CO和铁粉在一定条件下可以合成五羰基合铁[Fe(CO)5],该物质可用作无铅汽油的防爆剂,是一种浅黄色液体,熔点-20.5 ℃,沸点103 ℃,易溶于苯等有机溶剂,不溶于水,密度1.46~1.52 g·cm-3,有毒,光照时生成Fe2(CO)9,60 ℃发生自燃,五羰基合铁的制备原理如下:Fe(s)+5CO(g)200 ℃、20 MPa250 ℃~300 ℃Fe(CO)5(g)①下列说法正确的是________(填字母)。

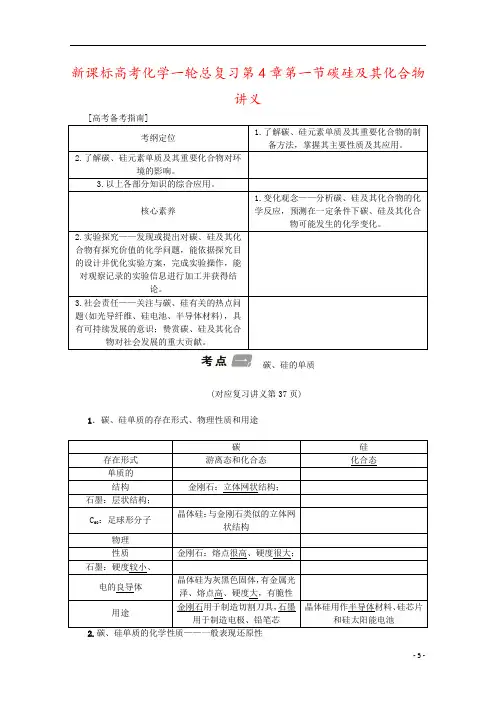
新课标高考化学一轮总复习第4章第一节碳硅及其化合物讲义碳、硅的单质(对应复习讲义第37页)1.碳、硅单质的存在形式、物理性质和用途2.碳、硅单质的化学性质——一般表现还原性碳 与O 2反应C +O 2=====完全燃烧CO 22C +O 2=====不完全燃烧2CO与氧化物反应C +2CuO=====△2Cu +CO 2↑2C +SiO 2=====高温2CO↑+Si C +CO 2=====高温2CO C +H 2O (g )=====高温CO +H 2与强氧化性酸反应浓硫酸:C +2H 2SO 4(浓)=====△2SO 2↑+CO 2↑+2H 2O 浓硝酸:C +4HNO 3(浓)=====△4NO 2↑+CO 2↑+2H 2O硅――→ 与O 2 反应Si +O 2=====△ SiO 2――→ 与F 2 反应Si +2F 2=====△SiF 4――→ 与HF 反应Si +4HF===SiF 4↑+2H 2↑――→ 与NaOH 溶液反应Si +2NaOH +H 2O ===Na 2SiO 3+2H 2↑(类似Al 性质)3.SiO 2制粗硅、提纯硅的一般过程 SiO 2――→C Si(粗)――→Cl 2SiCl 4――→H 2Si判断正误(1)硅的性质不活泼,故自然界中存在游离态的硅元素。
( ) (2)金刚石、石墨、C 60为碳的三种同素异形体。
( )(3)晶体硅熔点高、硬度大,故可用于制作半导体材料。
( ) (4)Si 和SiO 2都可用于制造光导纤维。
( )(5)非金属性:C>Si ,则热稳定性:CH 4>SiH 4。
( ) (6)Si 为非金属,与酸不能反应。
( )[提示] (1)× (2)√ (3)× (4)× (5)√ (6)×1.有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。