醛酮,羧酸,及其衍生物
- 格式:docx
- 大小:22.99 KB
- 文档页数:2





羧酸及其衍生物羧酸及其衍生物Ⅰ 目的要求羧酸是含有羧基(―COOH)的含氧有机化合物,我们平常所说的有机酸就是指的这类化合物。
所谓羧酸衍生物,包括的化合物种类很多,诸如羧酸盐类、酰卤类、酯类(包括内酯、交酯、聚酯等)、酸酐类、酰胺类(包括酰亚胺、内酰胺)等都是羧酸衍生物,有人甚至把腈类也包括在羧酸衍生物的范围之内。
其实,比较常见的而又比较重要的是酰卤、酸酐、酯和酰胺这四类化合物。
羧酸盐与一般无机酸盐在键价类型上没大区别,不作专门介绍。
至于腈类,将放在含氮化合物中加以介绍。
这四类化合物都是羧酸分子中,因酰基转移而产生的衍生物,所以又叫羧酸的酰基衍生物。
羧酸及其衍生物RCOL(L:-OH、-X、-OOCR′、-OR′、-NH2)在许多重要天然产物的构成以及在生物代谢过程中均占有重要地位。
本章将以饱和一元脂肪酸为重点,讨论羧酸及其衍生物的结构和性质。
鉴于乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的重要地位,本章作概括介绍。
希望学生在此基础上,探讨设计合成路线的一般方法。
本章学习的具体要求1、掌握羧酸的结构与性质之间的关系。
2、掌握羧酸衍生物的主要化学性质。
3、了解羧酸衍生物的亲核取代反应机理。
4、掌握羧酸与羧酸衍生物之间相互转变条件。
5、了解卤代酸、羟基酸的特性。
6、掌握乙酰乙酸乙酯和丙二酸二乙酯的制法、性质和在有机合成上的应用。
这也是本章的重点之一。
Ⅱ 学习提要(一)羧酸一、概述羧酸往往有俗名,希望学生有所了解,尽可能记忆一些,脂肪酸的系统命名原则和醛相β α同。
γCH3-CH-CH2-COOH2 14 3 OH 芳香酸命名是把芳环视作取代基。
76羧酸的沸点比分子量相近的其它有机物高,这是由于羧酸能以氢键缔合。
同时,即使在气态时,羧酸也是双分子缔合的,所以羧酸的沸点比分子量相近的醇还要高。
二、羧酸结构和化学性质亲核取代O 还原R-C-C-O-H α-H反应H 脱羧酸性1、酸性?E O O O +?R-C H + R-C R-C E EO-H O OO O NaOH/Na2CO3/ NaHCO3H2O + R-C E R-C EH+ O-Na O-H应用:①鉴别:与酚不同,与非酸性物质不同。
羧酸的衍生物及其性质实验报告,如"#1实验原理",1实验原理羧酸衍生物是羧酸缩合醚、醋酸酯及其他酸性衍生物,主要由醛或酮衍生物经羧化反应而成。
羧酸衍生物具有两性,它既能与基反应,又能与酸反应,它的pH值主要在4-7之间,它的核酸结合能力差,但有弱结合能力,对微生物有抑菌作用。
这类衍生物性质主要是形成了一个苯环上的乙酸膦(P-CH<sub>2</sub>-CH)或硝酸膦(P-NO<sub>2</sub>-CH)官能团,其稳定性与pH值有关,常温下它是有放电性的,但温度升高时可消除电荷, 使它对某些底物具有较强的吸附性质。
2实验材料1. 1mol以上羧酸;2. 各种醛或酮;3. 醋酸、硫酸或其他缓冲液(如:异烟酸、钛酸等);4. 各种表面活性剂;5. 乙醇或异丙醇;6. 酶模拟剂、核酸甘油酯化剂;7. PH试纸和温度计。
3实验步骤1. 首先,量取羧酸,称量各种醛或酮,加入搅拌中,同时加入醋酸、硫酸或其他缓冲液,充分混合;2. 再加入合适的表面活性剂,加热至恒温,搅拌,调节pH值,并用PH试纸检查;3. 加入乙醇或异丙醇,使反应液具有一定pH值,并在温度下待一段时间;4. 之后,利用反应物溶解在相对低温条件下反应,再加入酶模拟剂、核酸甘油酯化剂,模拟生物体的环境,并将温度升高至适宜的温度;5. 最后,用PH试纸和温度计测量所得到的样品溶液的PH值及温度,记录结果作为最终反应溶液的实验数据。
4实验结果及分析以n-己酸为原料,制备十二醛及其衍生物,结果如下表所示:衍生物|溶解度|结晶度|抑菌率------|------|------|-------乙酰己酸|可溶|大晶|47.6%丙酰己酸|可溶|大晶|39.2%苯乙酰己酸|可溶|小晶|25.2%硝酸己酸|可溶|结晶|37.5%由上表可知,在这次羧酸的衍生物合成实验中,乙酰己酸和硝酸己酸的抑菌率最高,在40%以上;丙酰己酸和苯乙酰己酸的抑菌率分别为39.2%和25.2%,仍然具有一定的抑菌作用。
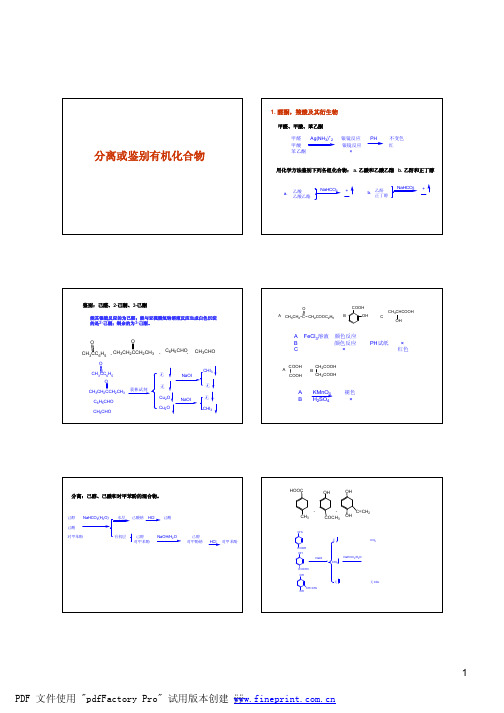
醛酮,羧酸,及其衍生物
一.羰基的性质
1.与HCN加成(可用于制取α-羟基羧酸)
2.与胺和氨气反应(反应可用来保护羰基,H+可使还原成羰基):
与伯胺,氨气生成西弗碱
与仲胺生成烯
利用羰基和苯胺反应生成有色沉淀也可用于鉴别羰基
3.与醇反应,生成缩醛,半缩醛,可用于羰基保护(酸性条件恢复)
4.与亚硫酸氢钠的加成:得到α—羟基磺酸钠。
α—羟基磺酸钠是一种盐类化合物,亚
硫酸氢钠水溶液与不溶于水的羰基化合物反应得到的α—羟基磺酸钠会溶入水中,使得反应进度大大加强。
(可用于鉴别醛,甲基酮,8碳以下环酮)
5.α,β-不饱和醛酮的加成反应:
l 与卤素的加成:加成位置是碳碳双键。
l 与质子酸的加成:加成位置是1,4-亲核加成。
l 与格氏试剂,烷基锂的加成:根据羰基附近的位阻效应来判定反应为1,4-加成还是1,2-加成。
可以加入卤化亚铜使得格氏试剂的反应的1,4-加成产物为主产物。
l 与二烷基铜锂的加成:1,4-加成为主要!
l 对加成反应的要注意的三点:酸催化,碱催化,立体构型稳定。
酸和碱的催化过程虽然有一定的不同,但是反应的进行靠的是β-C的正电性得以让亲核试剂进攻!
6.碘仿反应(甲基醛酮,α碳连着甲基的仲醇,α-羟基酸,用于鉴别及少一个碳的羧酸
制备)
7.羰基的还原
a.羰基还原为亚甲基:
Clemmensen还原法:Hg-Zn锌汞齐,HCl,加热。
Wolff-Kishner-Huang minlon 还原法:溶剂:高沸点的一缩二乙二醇,KOH。
还原
剂:二氮烷。
加热!
b.还原为醇:
氢化催化:Pt催化
LiAlH4还原:LiAlH4提供氢负离子,H2O提供氢离子。
可还原酯基。
三(叔丁基
氧基)氢化铝锂可以保证还原羰基的同时不还原酯基。
NaBH4还原:不还原酯基,立体选择性,对水不敏感。
乙硼烷还原:B2H6还原羰基得到硼酸酯,水解得到醇。
羰基优先于碳碳双键被还
原。
Meerwein-Ponndorf还原:Oppenauer氧化的逆反应,反应过程中硝基不受影响。
8.羰基的氧化:
醛的一般氧化:得到羧酸。
Cannizzaro反应:无α活泼氢的醛在碱性作用下发生分子之间的歧化反应。
酮的一般氧化:羰基与α-C断裂(氧化剂可用浓硝酸,KMnO4等)
9.Wittig 反应:仲烃基溴与三苯磷在苯基锂的作用下形成磷叶立德,极性部分可以和羰
基的氧置换。
本反应用于增长碳链。
本反应的过渡态为偶极中间体,不稳定,分解
为烯烃。
10.羟醛缩合,极为重要,用于增长碳链(具体过程仔细看书,在此不叙述)
11.醛酮制备
a.羟基的氧化,主要氧化剂有(Cr2O3,MnO2酸性条件….)
b.炔烃与水加成
c.烯烃的臭氧化
d.酰氯和格式试剂反应
e.付克酰基化
f.……………
12.与格氏试剂反应,理论上可制备除甲醇以外所有醇
13..注:某些常用的鉴别醛酮的反应未列出,详情见物质鉴别的ppt
二.羧酸及其衍生物
1.羧酸的反应:成酯,醇,酸催化
成酰胺,胺,酸催化
成酰卤,亚硫酰氯
α-H的卤代,PBr3催化
2.酯的反应:酯交换
氨解
LiAlH4还原醇(NaBH4不能还原)
酸,碱均可使其水解
可由酸,醇反应制得;可由酸酐,醇反应制得
3.酰胺的反应:酸可使其水解
LiAlH4还原成为胺,仅羰基失去
较稳定,不易被亲核
4.酰卤的反应:由酸和亚硫酰氯反应制备
较活泼,易被亲核
氨解
醇解
傅克反应
与格氏试剂反应
命名题自己总结,在此不赘述。