醛酮反应
- 格式:pdf
- 大小:296.23 KB
- 文档页数:22






原创——醛、酮化学反应归纳醛、酮化学反应归纳一、与RMgX加成甲醛产生一级醇,其他的醛生成二级醇。
酮生成三级醇。
羰基两旁的基团太大时,酮不能正常地反应。
会发生烯醇化反应或还原反应:烯醇化反应:还原反应:当格式试剂反应结果不好时,用烷基锂反应可以得到较好的结果。
Cram规则一:大基团L与R呈重叠型,两个较小的基团在羰基两旁呈邻交叉型,与格式试剂(包括氢化铝锂等)反应时,试剂从羰基旁空间位阻较小的基团S一边接近分子,故(i)是主要产物,(ii)为副产物。
R与L处于重叠型为最有利的反应时的构象。
二、与HCN反应(碱性条件下)生成的,—羟基腈可用于制备,—羟基酸,羟基酸可进一步失水变为,,,—不饱和酸(如有机玻璃)。
氢氧根可以增加氰离子的浓度,但碱性不能太强。
该反应符合Cram规则一。
Cram规则二:当醛、酮的,—C上有—OH,—NHR时,由于它们能与羰基氧形成氢键,反应物主要为重叠型构象,发生亲核加成反应时,亲核试剂主要从S基团的一侧进攻。
Strecker(斯瑞克)反应:羰基化合物与氯化铵、氰化钠生成,—氨基腈、再水解制备,—氨基酸的反应三、与炔化物的反应四、与含氮亲核试剂的加成A、与NH或RNH反应(与一级胺生成亚胺,又称西弗碱)(弱酸性条件) 32亚胺在稀酸中水解,可得原羰基化合物与胺:故该反应可用来保护羰基。
B、与RNH反应(生成烯胺) 2要使反应完全,需将水除去。
在稀酸水溶液中烯胺可水解得到羰基化合物与二级胺。
可发生氮烷基化与碳烷基化反应。
C、与氨衍生物的反应a.与羟胺的反应(生成肟)肟与亚硝基化合物发生互变异构。
亚硝基化合物与酮肟的互变异构:亚硝基化合物与醛肟的互变异构:亚硝基化合物在没有,氢时是稳定的,有,氢时有利于平衡肟。
肟的Z构型一般不稳定。
Beckmann(贝克曼)重排反应:酮肟在酸性催化剂中重排生成酰胺的反应催化剂:HSO、多聚磷酸、PCl、PhSOCl(苯磺酰氯)、SOCl (亚硫酰氯)24532 反应特点:离去与迁移基团处于反式;基团的离去与迁移是同步的;迁移基团在迁移前后构型不变。




醛酮氧化反应总结1. 引言醛酮氧化反应是一种重要的有机合成反应,广泛应用于药物合成、材料科学等领域。
该反应通过在醛或酮分子中引入氧原子,形成相应的羧酸或酮酸产物。
本文将对醛酮氧化反应的机理、催化剂和反应条件进行总结。
2. 醛酮氧化反应机理醛酮氧化反应的机理通常涉及氧化剂的参与。
一般来说,氧化剂可以以直接氧化方式或间接氧化方式参与反应。
2.1 直接氧化方式在直接氧化方式中,氧化剂直接转移氧原子给醛或酮分子。
常见的直接氧化氧化剂有氧气、过氧化氢、过氧化硫等。
以过氧化氢为例,其直接与醛或酮反应,生成相应的羧酸或酮酸产物。
直接氧化方式的机理较简单,反应速度较快,但一些底物特别是较不活泼的醛或酮可能需要较高的反应温度和氧化剂浓度。
2.2 间接氧化方式在间接氧化方式中,氧化剂首先被激活或还原为活性的氧化物。
常见的间接氧化氧化剂有卤化铬酸盐、硝酸铬酸盐等。
以卤化铬酸盐为例,先将醛或酮氧化铬酸酯,然后再通过水解或酸解生成醛酮产物和铬酸盐。
间接氧化方式的机理较为复杂,反应速度较慢,但该方式通常对较不活泼的底物也具有较好的适应性。
3. 催化剂在醛酮氧化反应中,常常需要使用催化剂来提高反应速率和选择性。
3.1 金属催化剂金属催化剂在醛酮氧化反应中具有广泛的应用。
常见的金属催化剂有铜、钯、铑等。
这些金属催化剂能够提供氧化剂还原所需的电子,并促进氧原子的转移给底物分子。
金属催化剂通常以配位形式存在,与氧化剂形成配位络合物。
这些络合物能够稳定氧化剂并促进其活化,从而加速醛酮氧化反应的进行。
3.2 酶催化剂酶催化剂是一种天然的催化剂,具有高效率和高选择性的特点。
在醛酮氧化反应中,一些氧化酶如酮酸脱氢酶、醛脱氢酶等能够催化醛酮的氧化反应。
酶催化剂通常具有特异性,只催化特定的底物或底物类似物。
因此,在催化剂选择时需要考虑底物的结构和性质。
4. 反应条件在进行醛酮氧化反应时,通常需要考虑以下反应条件:•温度:反应的温度通常在室温至高温之间,不同底物需要不同的反应温度。
化学反应中的醛酮反应醛酮反应是一类重要的有机化学反应,指的是醛与酮之间进行氧化还原反应,生成相应的醇和酸酐的过程。
该反应在有机合成、医药化学等领域具有广泛的应用。
本文将介绍醛酮反应的机理、分类以及其在实际应用中的一些例子。
一、醛酮反应的机理醛酮反应通常是通过氧化还原的方式进行,其中醛或酮被氧化为酸酐或醇。
该反应是在酸性或碱性条件下进行的。
在酸性条件下,醛酮反应首先发生质子化,形成醇醛离子或酮离子。
接着,醇醛离子或酮离子会接受电子,生成相应的酸酐或醇产物。
在碱性条件下,醛酮反应开始于亲核试剂的加成。
亲核试剂攻击醛或酮中的部分正电荷,形成一个中间体。
然后,中间体经历质子化或负离子迁移等步骤,最终生成酸酐或醇产物。
二、醛酮反应的分类根据反应条件和产物类型的不同,醛酮反应可以分为多种类型,如氧化、还原、氧气插入和杂原子插入等。
下面将介绍其中的几种典型反应。
1. 氧化反应氧化反应是指醛或酮被氧化为酸酐的反应。
常见的氧化剂有氧气、过氧化氢、高锰酸钾等。
例如,乙醛可以通过氧气氧化为乙酸的反应:CH3CHO + O2 -> CH3COOH2. 还原反应还原反应是指醛或酮被还原为醇的反应。
典型的还原剂有金属钠、锂铝烷等。
例如,丙酮可以通过锂铝烷还原为异丙醇的反应:(CH3)2CO + LiAlH4 -> (CH3)2CHOH3. 氧气插入反应氧气插入反应是指氧气直接参与醛酮反应,生成酸酐的反应。
例如,甲醛可以通过氧气插入反应生成甲酸的反应:CH3CHO + 1/2 O2 -> CH3COOH4. 杂原子插入反应杂原子插入反应是指醛酮反应中,醛或酮分子中的氧原子被其他原子或基团所取代的反应。
例如,乙醛可以经过羟胺的插入反应生成乙酰肼:CH3CHO + H2NNH2 -> CH3C(NHNH2)O三、醛酮反应的应用举例醛酮反应在有机合成和医药化学中具有广泛的应用。
下面介绍两个具有代表性的例子。
甲酸的醛酮反应是有机化学中的一种重要的加成反应,也是合成有机化合物的重要路径之一。
醛酮反应是烯丙基甲酰基与烯丙基酮发生加成反应,生成含有羰基的β-羥基酸盐,是C-C键构造的重要方法之一。
是不对称的,使得甲酸在有机合成中具有广泛的应用。
本文将对做详细的介绍,以便更好地理解该反应机理及其应用。
一、醛酮反应醛酮反应是化学中的一种加成反应,指的是一种以烯丙基甲酰基和烯丙基酮为反应物的加成反应,生成含有羰基的β-羥基酸盐。
这种反应是C-C键构造的重要方法之一。
醛酮反应有许多种方法,包括光化学和非光化学方法。
其中最常用的是亲核加成反应和金属催化反应。
不同的反应条件可以影响反应的速率和产物的选择性。
在实际应用中,选择最适合的反应条件是非常重要的。
二、是醛酮反应的一种特殊形式,指的是以甲酸为氢源的醛酮反应。
与其他醛酮反应相比,具有不对称性,因此在合成有机化合物中具有广泛的应用。
是一种非常优秀的合成β-羥基酸盐的方法。
它不仅可以在反应中使用水作为溶剂,还可以使用非常简单的反应条件,如在普通温度和室温下进行反应。
此外,该反应也具有高度的反应选择性和产率。
三、的反应机理的反应机理如下:(1)首先,烯丙基甲酰基与烯丙基酮发生反应生成中间体(A):(2)然后,中间体(A)再与甲酸发生反应,生成中间体(B):(3)最后,中间体(B)发生脱水反应,生成最终产物:β-羥基酸盐。
四、的应用是有机合成中的重要反应之一。
可以将其应用于生物活性物质、新的医药原料、植物保护剂、农药和杀虫剂等领域。
此外,该反应也可用于合成一个官能化合物的背景或一种受体分子。
例如,在合成生物活性化合物方面,可以用于获得广谱抗菌活性化合物,如奎宁和胺碘酮等。
在合成医药原料方面,该反应可以用于获得抗病毒和抗肿瘤化合物。
在其他领域,包括植物保护剂、农药和杀虫剂等方面也可以为诸多重要的应用领域提供可能性。
五、结语综上所述,是有机合成中的重要反应之一。
通过了解该反应的反应机理及其应用,可以更好地理解该反应在合成有机化合物中的应用及意义,这对于有机合成化学家具有极大的价值。
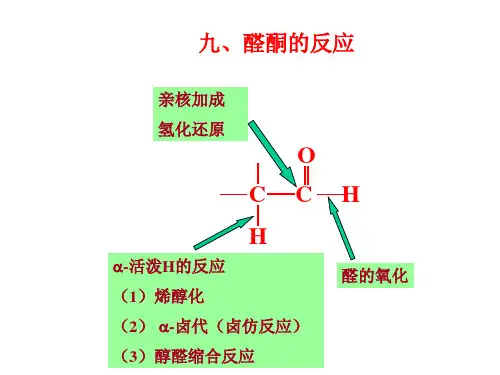
第12章 活泼亚甲基反应在醛、酮、羧酸及其衍生物中,与羰基相邻的α-亚甲基(1)也受羰基拉电子效应的影响,因此α-碳上的氢也表现出一定的酸性,并可离解出一个质子形成碳负离子(2)。
(2)经过共振成为烯醇负离子(3),得到一个质子形成烯醇式(4)。
(1)式和(4)式之间的互变称为烯醇互变异构。
(1)式称为酮式(keto form ),(4)式称为烯醇式(enol form )。
H+C C O-H+34(酮式)(烯醇式)醛、酮、酸酸及其衍生物的α-亚甲基上的氢受到邻位羰基的活化而呈一定的酸性,因此常称为活泼亚甲基化合物。
活泼亚甲基化合物烯醇化程度越高,α-氢酸性越大,亚甲基越活泼。
而烯醇化程度与分子结构有关,例如,丙酮在液态时含有1.5×10-4%的烯醇(pK a 20),而乙酰丙酮则由于其烯醇式可形成分子内氢键以及共轭效应,在己烷中的烯醇含量高达92%,酸性较丙酮大得多(pK a 9),与苯酚相近(pK a 9.98)。
C H 2C C O C H 3O CH 3H 3(8%) (92%)与羧酸相比(pK a 4.76),烯醇是较弱的酸。
一些活泼亚甲基化合物的酸性见表12.1。
除了含羰基化合物外,其它带有吸电子基团(如硝基、亚硝基、烷氧基等)的化合物均有不同程度的烯醇化作用。
表12.1 一些活泼亚甲基化合物的酸性 化合物 pK a 化合物pK a HCOCH 2CHO CH 3COCH 2COCH 3 RCH 2NO 2 CH 3COCH 2CO 2R NCCH 2CN 5 910 11 11CH 3SO 2CH 2SO 2CH 3EtO 2CH 2CO 2Et RCH 2CHO RCOCH 2R’ RO 2CCH 2R’ RCH 2CN 12.5 13 16 19-29 24.5 25醛、酮、羧酸及其衍生物的羰基活化α-氢的能力有以下次序: -CHO > -COCO 2R > -COPh > -COR > -CN > -COX > -CO 2R > -CO 2H 这些羰基化合物的许多重要反应与它们的α-活泼亚甲基有关。
本章将主要讨论羰基化合物的α-卤化反应、缩合反应、烷基化反应,以及磷和硫叶立德(也是一类活泼亚甲基化合物)参与的缩合反应。
12.1 羰基化合物的α-卤化12.1.1 醛和酮的卤化α-位含有活泼氢的酮在酸或碱催化下可与卤素作用,发生α-氢的卤代反应:C RCH 2O X在酸催化下,首先羰基发生质子化,然后通过烯醇式进行卤化。
由于反应过程中能够产生卤化氢,故该反应也可不加酸催化,一旦反应发生了,产生的卤化氢即可自动催化,反应就能很快进行。
C R CHOCRCH 2O X+ HX这个反应通常在冰醋酸中进行,也可用N, N -二甲基甲酰胺或乙醚作溶剂。
原料分子中的α-氢可逐个被卤素取代,但反应可控制在单取代和双取代阶段。
当α-氢被卤素取代后,卤原子的吸电子效应使羰基氧上的电子云密度降低,羰基氧再质子化形成烯醇要比未卤代时困难一些。
因此,只要小心控制卤素的量,可以使反应停留在单取代阶段。
该反应主要用于制备单卤代酮,例如:C C 6H 5CH 3OCC 6H 5CH 2O Br+ Br 2AcOH+ HBr66%对于不对称的酮,α-氢被卤素取代的优先次序是CH > CH 2 > CH 3,这是因为α-碳上取代基愈多,超共轭效应愈大,形成的烯醇式中间体愈稳定,因而这个碳上的氢就更容易离开而进行卤化反应。
但通常得到两种产物的混合物。
醛类直接进行卤化,常被氧化成酸。
如将醛转化成缩醛后再卤化,然后水解缩醛,也能得到α-卤代醛:RCH 2CH 3OH HClRCH 2RCHCHOBr在碱催化的过程中,碱首先夺取α-碳上的质子,形成碳负离子,然后与卤素反应,生成α-卤代酮。
由于卤素吸电子效应的影响,使得被卤素取代了的α-碳上的氢的酸性增强,第二个质子更容易失去并进一步卤化生成二卤代产物;同样,第三个质子比第二个质子更容易被取代。
因此,只要第一个质子被卤代,第二和第三个质子均很快被卤代,反应不能停留在单卤代和双卤代产物阶段。
C R CHOC R CHX 2O 3+X -当然,如果羰基的α-碳上只有一个质子,碱催化的反应也可生成单卤代产物。
例如:C 6H 3C 6H 5CCBrCH 2CH 3OCH 312.1.2 卤仿反应在上述碱催化的卤化反应中,由于-CX 3强拉电子作用,生成的三卤代产物中的羰基很容易受OH -的亲核进攻,OH -加成到羰基碳上,形成四面体过度态(I );然后,(I )中的三卤甲基作为离去基团离去,生成羧酸(II )和三卤甲基负离子,后者再获取一个质子后生成卤仿。
这个反应称为卤仿反应。
O C OHO C RO -+ HCX 3(I ) (II )当使用次碘酸钠溶液为卤化试剂时,乙醛和甲基酮能够迅速转化成羧酸和碘仿,其中碘仿以黄色沉淀析出,很容易观察到,故碘仿反应被用于乙醛和甲基酮的鉴定。
此外,碘仿反应也适用于检查可被次碘酸钠氧化为乙醛和甲基酮的醇类。
例如,乙醇和碘在氢氧化钾溶液中反应,立即生成碘仿。
CH 3CH 2OH2甲基酮的卤仿反应也提供了一种制备羧酸的方法,许多芳基甲基酮可以由芳环的酰基化或其他反应来制取。
此外,次卤酸盐对C=C 双键没有干扰,因此不饱和的甲基酮也可以通过卤仿反应转化为不饱和酸。
例如,从β-萘乙酮制备β-萘甲酸和从4-甲基-3-丁烯-2-酮制备3-甲基-2-丁烯酸都是通过卤仿反应来完成的:CO 2H88%CH 3CH 3C CHCO 2HCH 353% 12.1.3 脂肪酸的卤化由于羧基中的羟基与羰基可形成p-π共轭,羧基中羰基碳的正性比醛、酮差,活化亚甲基的能力降低,因此,羧酸的α-H 酸性比醛、酮小,故而羧酸的α-H 远比醛和酮的α-H 难以卤化,而且只限于氯化和溴化。
α-碘代酸需要间接的方法合成。
与羧酸相反,酰氯和酸酐的α-H 都容易被卤化。
脂肪酸在催化量的三氯化磷或三溴化磷存在下可进行氯化或溴化。
具体操作是在脂肪酸中加入少量红磷并通入氯气或加入溴,卤素能够很顺利地取代羧酸的α-氢。
此时,卤化的实际对象是酰卤,而羧酸和酰卤之间处于不断地相互转化之中,最终使所有的羧酸转化为酰卤并卤化。
产物用水处理,α-卤代酰卤被水解为α-卤代酸。
2P + 3Br 22PBr 33RCH 2CO 2H + PBr 3 3RCH 2COBr + P(OH)3RCH 2COBr +Br 2+HBr2H + RCH 2COBr酰卤的卤化也要通过烯醇式,反应在酸催化下进行。
RCH 2CBrO+ HBr+例如,己酸在PCl 3存在下溴化生成α-溴代己酸:OHOBr86% 12.2 酯缩合反应 12.2.1 克莱森缩合反应含有α-活性氢的酯在碱性条件下失去一分子醇生成β-酮酸酯,这个反应称为酯缩合反应,或者克莱森(Claisen )缩合反应。
例如,乙酸乙酯在乙醇钠(或金属钠)的作用下缩合,产物经过酸化和分离,得到乙酰乙酸乙酯:CH 3COC 2H 5O 2 2. H 3+OCH 3CCH 2COC 2H 5O O从形式上看,乙酰乙酸乙酯是由一分子乙酸乙酯提供一个α-氢,另一分子乙酸乙酯消除一分子乙氧基而形成的。
这个反应的过程是: 首先乙氧基负离子夺取乙酸乙酯的α-氢,生成碳负离子(1);然后,(1)亲核进攻另一分子乙酸乙酯的羰基碳,形成加成产物(2);接着消除一分子乙氧基负离子,生成乙酰乙酸乙酯(3)。
由于乙酰乙酸乙酯(pK a 11)是一个酸性比乙醇(pK a ~16)强的活泼亚甲基化合物,因此第三步生成的乙酰乙酸乙酯全部与乙醇钠交换为乙酰乙酸乙酯的钠化物(4),只是在反应完成后经过酸化才得到乙酰乙酸乙酯。
CH 2H 5 + HOC 2H 512H 5CH 3C O OC 2H 5CH 2COC 2H 5O2CH2H 5+ OC 2H 5CH 3CCH 2COC 2H 5OO2 3+ OC2H 5CH 3CCH 2COC 2H 5OO + HOC 2H 52H 534H +CH 3CCH 2COC 2H 5OO这四步反应都是可逆的,而且由于乙酸乙酯的酸性很弱(pK a ~25),第一步反应平衡倾向于逆反应方向,因此反应似乎不能进行到底。
然而,如上所述,由于乙酰乙酸乙酯的酸性比较强,第四步反应平衡倾向于产物方向,从而使反应得以完全进行。
所以,中间体(4)的生成是酯缩合反应的驱动力。
这种反应相当于一个强酸从盐中置换出一个弱酸,两者的酸性相差愈大,反应的驱动力就愈大,置换得也就愈完全。
按照这个机理,如果酯的α-位有两个和三个活泼氢时,缩合反应可以进行,但若只有一个活泼氢,则难以进行缩合。
事实正是如此。
例如,苯乙酸甲酯在甲醇钠作用下能够顺利地缩合为2,4-二苯基乙酰乙酸甲酯,而异丁酸甲酯在同样条件下却不发生反应,因为产物2,2,4,4-四甲基乙酰乙酸甲酯在β-位上没有氢,它的酸性要比醇弱得多。
C 6H 5CH 2CO 2CH 32CH 36H 5(CH 3)2CHCO 2CH 32CH 33乙酰乙酸乙酯既有酮的特征,如能与醛酮试剂反应形成肟、腙等,又有酯的性质,如氨解形成酰胺、水解为酸等,同时还表现出烯醇的特征:例如,与溴发生加成反应;与三价铁离子在乙醇中发生紫红色反应(酚和羧酸具有这一特征的显色反应);与醋酸铜振荡时形成一种能溶于有机溶剂的绿色铜络合物,分子式为Cu(C 6H 9O 3)2,从苯中得到的结晶熔点为193o C ;能溶于氢氧化钠中,与金属钠反应放出氢气,形成的无色水溶性固体化合物就是酯缩合反应中的钠化物(4)。
这些事实证实,乙酰乙酸乙酯是一个由酮型(5)和烯醇型(6)互变异构体组成的混合物。
在烯醇型异构体(6)中存在分子内氢键。
CH C CH 3C OC 2H 5OO H5 6 乙酰乙酸乙酯的钠化物(4)的实际结构应当为:C CH 3C OC 2H 5OO Na12.2.2 迪克曼缩合反应分子内的酯缩合称为迪克曼(Dieckmann )缩合。
这个反应特别适合于合成五元和六元环型β-酮酸酯。
例如:CO 2C 2H 5OCO 2C 2H 5O12.2.3 交叉的酯缩合反应两种不同的酯亦可发生缩合反应,称为交叉的酯缩合反应。
如果两种酯都有α-H ,发生交叉的酯缩合发应后可能有四种不同的产物,没有合成价值。
但一种酯中没有α-H ,另一种酯中含有α-H 时,它们的缩合反应还是相当有用的。
例如,甲酸酯、碳酸酯、草酸酯、苯甲酸酯等可与另一种具有α-活泼氢的酯进行交叉酯缩合反应:HCOC 2H 5O +CH +3HCCH 2COC 2H 5O O79%C 6H 5CH 2COC 2H 5O+C 2H 5+3C 2H 5OCCHCOC 2H 5O O C 6H 586% 12.2.4 酮与酯的缩合含有α-H 的酮与酯也可发生交叉缩合反应,生成β-酮酸酯或β-二酮。