醛酮羧酸及其衍生物
- 格式:ppt
- 大小:732.50 KB
- 文档页数:24

第十章 醛酮含有羰基的化合物:O H O CH3CCH3 O C CH3醛和酮:CH 3C羧酸 羧酸:CH3CO OHCOOH COOH COOHOH CH3CHCOOHO羧酸衍生物:CH3COCl (CH3CO) ( )2OCOOC 2H 5NHOβ-二羰基化合物:CH3CCH2COOC 2H5CH2COOC2H5 COOC2H5210 醛和酮教学大纲(醛和酮)醛和酮的结构与物理性质 醛和酮的结构与物理性质; 醛和酮的化学性质:1.与氢氰酸加成; 2.与亚硫酸氢钠加成; 3.与醇亲核加成; 4.与氨的衍生物反应; 5.与Grignard试剂加成; 试剂加成 6.醇醛缩合反应; 7 卤化和卤仿反应; 7. 卤化和卤仿反应 还 原 反 应 —— 催 化 加 氢 、 金 属 氢 化 物 还 原 、 Clemmenson 还 原 、 WolffKishner黄鸣龙还原、Cannizzaro反应;氧化反应)。
羰基 carbonylOR C H R O C R'醛(aldehyde)O R C O R C R' Ar H Ar O C O C R H酮(Ketone K t )Oβ αC H(R)CC脂肪族醛、酮芳香族醛、酮α,β-不饱和醛、酮4命名:O CH3CCH2CH2CHOO O CH3CCHCCH3 CH2CH=CH24-氧代戊醛3-烯丙基-2,4-戊二酮OO CHO环己酮CHO2'-氧代环己基甲醛CHO OH O CHO苯甲醛2-羟基苯甲醛 (水杨醛)呋喃甲醛 (糠醛)5z醛和酮的结构2spCσOδ C+δO键角接近 120 °1 C=O双键是由一个σ键和一个π键组成的。
2 羰基碳原子为 sp2杂化轨道与氧原子的 p 轨道和其它两个原子 形成三个 形成 个σ键 键,一个 个 p轨 轨道与氧原子的 与氧 子 p轨 轨道侧面交盖成 侧面交 成π键 键, 氧原子上另有两对孤对电子处于氧的s轨道和p轨道中。


第十一章羧酸及其衍生物的结构与性质引言羧基()是羧酸的官能团,是由羰基和羟基组成的。
由于羰基的碳氧双键与羟基氧原子的共轭效应的作用,使羟基中氧原子电子向羰基转移,羟基的氢易离解而显酸性。
羧基中羟基也能被其它基团取代生成羧酸衍生物。
羧基是吸电子基,α-H具有活性,可以被卤代。
此外羧酸还能被还原和发生脱羧反应。
这里所讨论的羧酸衍生物主要是指羧基中羟基被取代后生成的酰卤(),酸酐(),酯(),酰胺()以及由酰胺脱水后生成的产物腈()。
在羧酸衍生物中羰基与卤素,酰胺基,烷氧基和氨基相连,由于卤素,氧原子和氮原子的负电性以及孤对电子的作用,使羰基碳上正电性不同,因此它们发生亲核反应性质也有差别。
羧酸衍生物还能发生还原反应。
11.1 羧酸的酸性羧酸是弱酸,能与强碱反应生成盐:羧酸酸性的强弱与所连的基团有关,连吸电子基团的羧酸酸性较强,而连供电子基团的酸性相对较弱。
如下列化合物酸性强弱顺序为:11.2 羧酸衍生物的生成羧基中的羟基被卤素、酰胺基、烷氧基和氨基取代形成酰卤、酸酐、酯和酰胺等羧酸衍生物。
1、酰卤的形成羧酸与SO2Cl,PCl5,PCl3等氯化剂直接反应生成酰卤:因为POCl3沸点低易除去,此法可制备高沸点的酰氯。
H3PO3沸点高,可制备低沸点的酰氯。
该法产生的SO2,HCl易除去,因此生成的酰氯纯度高,后处理容易。
2、酸酐的形成羧酸在脱水剂(如乙酰氯、乙酸酐)存在下加热,失去一分子水而生成酸酐。
二元酸可以分子内脱水生成二酸酐:3、酯化反应羧酸和醇在催化剂(H2SO4、HCl或苯磺酸等)作用下回流生成酯:酯化反应由多种机理,在大多数情况下,是羧酸中羟基与醇中羟基氢结合生成水,表观上看是一种亲核取代反应,实际上是一个亲核加成-消除反应的机理:决定反应速度的一步是亲核加成,因此羧基中碳的正电性以及羧基所连的基团大小核亲核试剂R'OH中R'体积大小都影响反应的速度,下列羧酸与甲醇酯化反应的相对速度的快慢顺序为:4、形成酰胺的反应羧酸与氨立即反应生成盐,在加热条件下,脱水生成酰胺,生成酰胺的反应是可逆的,如果把生成的水从反应体系中除去,反应可趋于完全。

关于醛、酮、羧酸及其衍生物部分学过的人名反应付玉状引文:熟记有机人名反应不仅是期末考试的要求,也是考研的重要内容,更是对化学先驱们的尊重与缅怀。
接下来,我将对有机化学课堂上讲解过的关于醛、酮、羧酸及其衍生物部分学过的人名反应进行总结。
摘要:按照首字母排列顺序,依次介绍相关人名反应的主要化学反应方程式,反应机理,应用以及发现过程中的一些小故事进行简介,醛、酮、羧酸及其衍生物部分学过的人名反应主要包括Baeyer-Villigery氧化、Beckmann重排、Cannizzaro反应、Claisen酯缩合、Clemmensen 还原、Dieckmann分子内缩合、Friedel-Crafts反应、Hofman降级反应、Mannich反应、Michael加成反应、Perkin反应、Reformatsky反应、Reimer-Timann反应、Witig反应和Wolff-Kishner-Huang还原反应。
关键词:有机反应人名醛酮羧酸及其衍生物正文:1.Baeyer-Villigery氧化重排反应——拜耳-维立格氧化重排反应Baeyer-Villigery氧化重排反应是酮在过氧化物氧化下,在羰基和一个邻近烃基之间引入一个氧原子,得到相应的酯的化学反应。
醛可以进行同样的反应,氧化的产物是相应的羧酸。
常用的氧化剂包括间氯过氧化苯甲酸、过氧化乙酸、过氧化三氟乙酸等,其中过氧化三氟乙酸是较好的催化剂,反应温度一般在10℃~40℃之间,产率高。
为避免生成的酯在酸性条件下发生酯交换反应,常在反应物中加入磷酸氢二钠,以保持溶液接近中性。
需要注意的是环酮发生反应得到的主要产物是内酯Baeyer-Villigery氧化重排反应机理:从表面上看来,该反应仅是一个氧原子对碳-碳键进行的插入反应。
事实上,该反应是一个典型的1,2-迁移反应,其机制与霍夫曼重排、频纳醇重排等是类似的。
首先,反应物的羰基被质子活化(反应1),从而易于接受过氧酸的亲核进攻(反应2)。

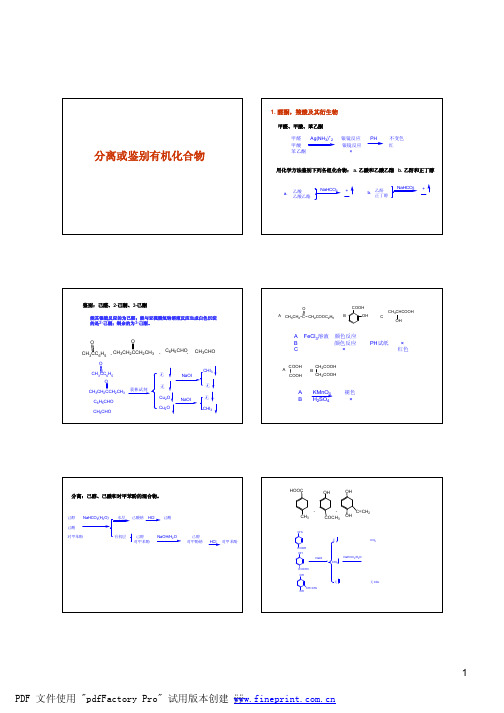
醛酮,羧酸,及其衍生物一.羰基的性质1.与HCN加成(可用于制取α-羟基羧酸)2.与胺和氨气反应(反应可用来保护羰基,H+可使还原成羰基):与伯胺,氨气生成西弗碱与仲胺生成烯利用羰基和苯胺反应生成有色沉淀也可用于鉴别羰基3.与醇反应,生成缩醛,半缩醛,可用于羰基保护(酸性条件恢复)4.与亚硫酸氢钠的加成:得到α—羟基磺酸钠。
α—羟基磺酸钠是一种盐类化合物,亚硫酸氢钠水溶液与不溶于水的羰基化合物反应得到的α—羟基磺酸钠会溶入水中,使得反应进度大大加强。
(可用于鉴别醛,甲基酮,8碳以下环酮)5.α,β-不饱和醛酮的加成反应:l 与卤素的加成:加成位置是碳碳双键。
l 与质子酸的加成:加成位置是1,4-亲核加成。
l 与格氏试剂,烷基锂的加成:根据羰基附近的位阻效应来判定反应为1,4-加成还是1,2-加成。
可以加入卤化亚铜使得格氏试剂的反应的1,4-加成产物为主产物。
l 与二烷基铜锂的加成:1,4-加成为主要!l 对加成反应的要注意的三点:酸催化,碱催化,立体构型稳定。
酸和碱的催化过程虽然有一定的不同,但是反应的进行靠的是β-C的正电性得以让亲核试剂进攻!6.碘仿反应(甲基醛酮,α碳连着甲基的仲醇,α-羟基酸,用于鉴别及少一个碳的羧酸制备)7.羰基的还原a.羰基还原为亚甲基:Clemmensen还原法:Hg-Zn锌汞齐,HCl,加热。
Wolff-Kishner-Huang minlon 还原法:溶剂:高沸点的一缩二乙二醇,KOH。
还原剂:二氮烷。
加热!b.还原为醇:氢化催化:Pt催化LiAlH4还原:LiAlH4提供氢负离子,H2O提供氢离子。
可还原酯基。
三(叔丁基氧基)氢化铝锂可以保证还原羰基的同时不还原酯基。
NaBH4还原:不还原酯基,立体选择性,对水不敏感。
乙硼烷还原:B2H6还原羰基得到硼酸酯,水解得到醇。
羰基优先于碳碳双键被还原。
Meerwein-Ponndorf还原:Oppenauer氧化的逆反应,反应过程中硝基不受影响。
羧酸及其衍生物羧酸及其衍生物Ⅰ 目的要求羧酸是含有羧基(―COOH)的含氧有机化合物,我们平常所说的有机酸就是指的这类化合物。
所谓羧酸衍生物,包括的化合物种类很多,诸如羧酸盐类、酰卤类、酯类(包括内酯、交酯、聚酯等)、酸酐类、酰胺类(包括酰亚胺、内酰胺)等都是羧酸衍生物,有人甚至把腈类也包括在羧酸衍生物的范围之内。
其实,比较常见的而又比较重要的是酰卤、酸酐、酯和酰胺这四类化合物。
羧酸盐与一般无机酸盐在键价类型上没大区别,不作专门介绍。
至于腈类,将放在含氮化合物中加以介绍。
这四类化合物都是羧酸分子中,因酰基转移而产生的衍生物,所以又叫羧酸的酰基衍生物。
羧酸及其衍生物RCOL(L:-OH、-X、-OOCR′、-OR′、-NH2)在许多重要天然产物的构成以及在生物代谢过程中均占有重要地位。
本章将以饱和一元脂肪酸为重点,讨论羧酸及其衍生物的结构和性质。
鉴于乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的重要地位,本章作概括介绍。
希望学生在此基础上,探讨设计合成路线的一般方法。
本章学习的具体要求1、掌握羧酸的结构与性质之间的关系。
2、掌握羧酸衍生物的主要化学性质。
3、了解羧酸衍生物的亲核取代反应机理。
4、掌握羧酸与羧酸衍生物之间相互转变条件。
5、了解卤代酸、羟基酸的特性。
6、掌握乙酰乙酸乙酯和丙二酸二乙酯的制法、性质和在有机合成上的应用。
这也是本章的重点之一。
Ⅱ 学习提要(一)羧酸一、概述羧酸往往有俗名,希望学生有所了解,尽可能记忆一些,脂肪酸的系统命名原则和醛相β α同。
γCH3-CH-CH2-COOH2 14 3 OH 芳香酸命名是把芳环视作取代基。
76羧酸的沸点比分子量相近的其它有机物高,这是由于羧酸能以氢键缔合。
同时,即使在气态时,羧酸也是双分子缔合的,所以羧酸的沸点比分子量相近的醇还要高。
二、羧酸结构和化学性质亲核取代O 还原R-C-C-O-H α-H反应H 脱羧酸性1、酸性?E O O O +?R-C H + R-C R-C E EO-H O OO O NaOH/Na2CO3/ NaHCO3H2O + R-C E R-C EH+ O-Na O-H应用:①鉴别:与酚不同,与非酸性物质不同。