药品检验补充检验方法和检验项目批准件编号2009024
- 格式:pdf
- 大小:9.43 MB
- 文档页数:11

关注!总局关于发布药品补充检验方法研制指南的通告(2018年第7号)为规范和指导药品补充检验方法研制工作,强化检验检测技术对药品监管的支撑作用,根据监管工作需要,现发布《药品补充检验方法研制指南》。
特此通告。
附件:药品补充检验方法研制指南食品药品监管总局2018年1月5日附件药品补充检验方法研制指南为规范和指导药品补充检验方法研制工作,进一步提高药品补充检验方法的科学性、实用性和适用性,依据《药品管理法实施条例》第五十三条规定,制定本指南。
一、研制范围药品补充检验方法针对有掺杂、掺假嫌疑的药品。
在国家药品标准规定的检验方法和检验项目不能检验时,药品检验机构可以补充检验方法和检验项目进行药品检验;经国家食品药品监督管理总局批准后,使用补充检验方法和检验项目所得出的检验结果,可以作为食品药品监管部门认定药品质量的依据。
属于药品标准提高工作的,或针对仿冒产品以及未获得批准文号产品的方法原则上不纳入药品补充检验方法范畴。
二、主要研制内容(一)药品中非法添加化学物质的;(二)化学增重、染色、掺杂掺假的;(三)擅自添加着色剂、防腐剂、香料、矫味剂及辅料的;(四)未按批准的生产工艺生产从而影响药品质量的;(五)存在其他风险物质的。
三、方法确立药品检验机构在药品检验中发现有掺杂掺假嫌疑,且国家药品标准规定的检验方法和检验项目不能检验的,可以起草药品补充检验方法。
起草检验方法前,应深入调查研究,并通过市级及以上食品药品监管部门对拟建立方法的必要性和执法适用性审核,还应避免与在研或已批准方法的重复。
市级及以上食品药品监管部门可以根据监管需要,委托药品检验机构组织起草补充检验方法。
药品补充检验方法应首先选择建立通用方法,避免同一检查项分别针对不同药品建立多个相同或类似方法。
四、方法研制药品检验机构应按照《药品补充检验方法研制技术要求》(见附1)开展方法起草和研制工作。
起草药品补充检验方法时,同时还应编制起草说明,包括研究背景、检测指标的选择、实验设计、拟定方法、方法学验证、样品测定结果分析等内容。

药品补充检验方法和检验项目适用范围正文:咱们都知道,药品的质量直接关系到人们的健康。
所以啊,对于药品的检验工作可不能马虎,得仔细检查,确保每一片药都靠谱。
那么问题来了,怎么检验?检验什么?这些问题,今天就让我来给大家好好说道说道。
说到检验方法,那可真是五花八门。
比如说吧,我们常见的有物理检验、化学检验和生物学检验这三大块。
物理检验嘛,就是看药品的形状、颜色、气味这些,看看有没有不对劲的地方。
化学检验呢,就得靠那些试剂和仪器了,通过化学反应来判断药品的成分对不对。
至于生物学检验,那就更高级了,得靠显微镜和培养皿,观察微生物的生长情况。
再来说说检验项目,那也是多种多样。
就拿抗生素来说吧,咱们得测它的纯度、含量、杂质啥的。
还有那个抗肿瘤药,也得看它有没有重金属污染,有没有残留的药物单体。
还有啊,那些治疗心脑血管病的药,还得检测它们对血压、血糖这些指标的影响。
不过,检验可不是一件简单的事情。
你得先确定一个标准,然后才能去检验。
这个标准啊,得是权威的,不能随便定。
而且,检验的时候也不能光看结果,还得看过程,看操作是不是规范,试剂是不是准确。
举个例子吧,有一次我们检验了一批中药,发现有个药材里含有微量的重金属。
这可咋整?按理说,这种小量重金属应该没啥大问题,但要是多了,就可能对身体有害。
于是我们赶紧跟专家商量,决定用一种更敏感的仪器来检测。
结果还真发现了问题,说明我们的判断是对的。
后来想想,幸亏咱们没大意,不然后果不堪设想啊。
还有一回,我们检验了一批抗生素,发现有个产品里的杂质比标准高。
这下可把大家吓坏了,因为超标的杂质可能会影响药物的效果,甚至让人吃出问题。
好在经过一番努力,我们找到了原因——生产过程中的一个环节出了问题。
于是我们赶紧调整了工艺,确保了产品的质量和安全。
总的来说,药品检验是一项非常严谨的工作。
它需要我们有扎实的理论知识,敏锐的观察力,准确的操作技能,以及不怕麻烦的精神。
只有这样,我们才能确保每一粒药都是安全的,让患者们吃得放心。


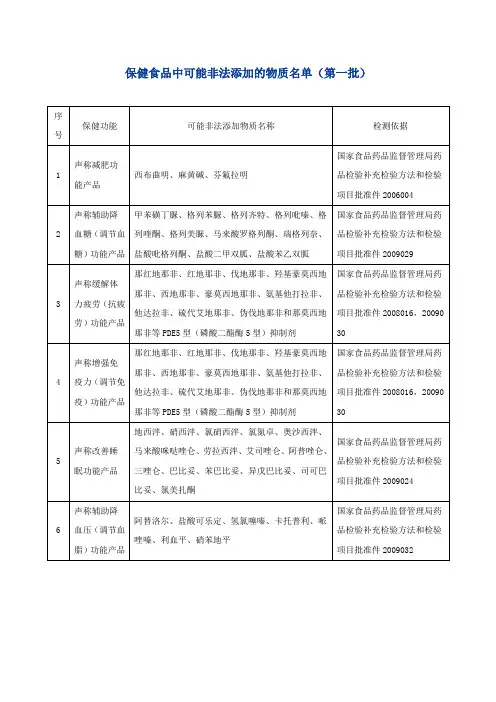
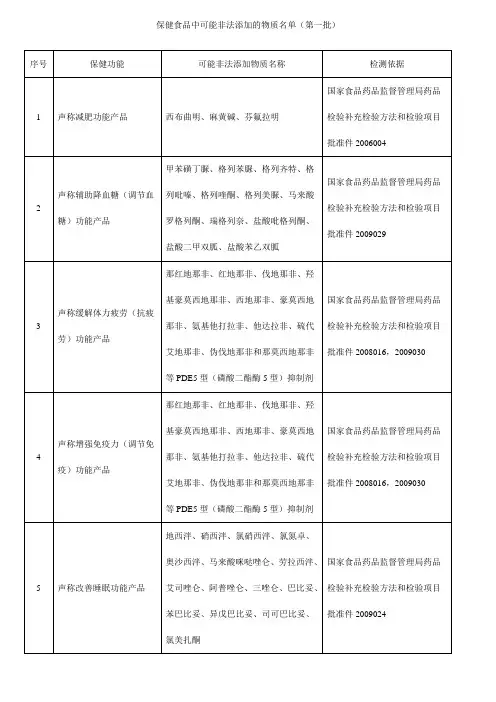
关于发布保健食品中可能非法添加的物质名单(第一批)的通知各省、自治区、直辖市食品药品监督管理局(药品监督管理局):为贯彻落实国务院食品安全委员会办公室《关于进一步加强保健食品质量安全监管工作的通知》(食安办〔2011〕37号)要求,严厉打击保健食品生产中非法添加物质的违法违规行为,保障消费者健康,国家局组织制定了《保健食品中可能非法添加的物质名单(第一批)》,现予以印发。
该名单未涵盖行业内存在的所有非法添加物质,各级食品药品监督管理部门在监督检查中要注意收集名单之外的非法添加物质情况,汇总后报送国家局。
附件:保健食品中可能非法添加的物质名单(第一批)国家食品药品监督管理局办公室二○一二年三月十六日附件:保健食品中可能非法添加的物质名单(第一批)序号保健功能可能非法添加物质名称检测依据1声称减肥功能产品西布曲明、麻黄碱、芬氟拉明国家食品药品监督管理局药品检验补充检验方法和检验项目批准件20060042声称辅助降血糖(调节血糖)功能产品甲苯磺丁脲、格列苯脲、格列齐特、格列吡嗪、格列喹酮、格列美脲、马来酸罗格列酮、瑞格列奈、盐酸吡格列酮、盐酸二甲双胍、盐酸苯乙双胍国家食品药品监督管理局药品检验补充检验方法和检验项目批准件20090293声称缓解体力疲劳(抗疲劳)功能产品那红地那非、红地那非、伐地那非、羟基豪莫西地那非、西地那非、豪莫西地那非、氨基他打拉非、他达拉非、硫代艾地那非、伪伐地那非和那莫西地那非等PDE5型(磷酸二酯酶5型)抑制剂国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2008016,20090304声称增强免疫力(调节免疫)功能产品那红地那非、红地那非、伐地那非、羟基豪莫西地那非、西地那非、豪莫西地那非、氨基他打拉非、他达拉非、硫代艾地那非、伪伐地那非和那莫西地那非等PDE5型(磷酸二酯酶5型)抑制剂国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2008016,20090305声称改善睡眠功能产品地西泮、硝西泮、氯硝西泮、氯氮卓、奥沙西泮、马来酸咪哒唑仑、劳拉西泮、艾司唑仑、阿普唑仑、三唑仑、巴比妥、苯巴比妥、异戊巴比妥、司可巴比妥、氯美扎酮国家食品药品监督管理局药品检验补充检验方法和检验项目批准件20090246声称辅助降血压(调节血脂)功能产品阿替洛尔、盐酸可乐定、氢氯噻嗪、卡托普利、哌唑嗪、利血平、硝苯地平国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2009032。
国家食品药品监督管理局
国家药品标准补充颁布件
批件号: 2008B003
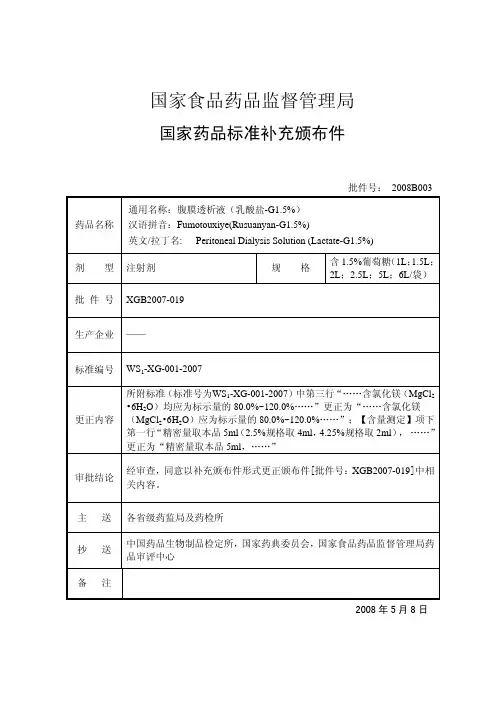
药品名称通用名称:腹膜透析液(乳酸盐-G1.5%)
汉语拼音:F umotouxiye(Rusuanyan-G1.5%)
英文/拉丁名: P eritoneal Dialysis Solution (Lactate-G1.5%)
剂型注射剂规格含1.5%葡萄糖(1L;1.5L;2L;2.5L;5L;6L/袋)
批件号XGB2007-019
生产企业——
标准编号WS1-XG-001-2007
更正内容所附标准(标准号为WS1-XG-001-2007)中第三行“……含氯化镁(MgCl2•6H2O)均应为标示量的80.0%~120.0%……”更正为“……含氯化镁(MgCl2•6H2O)应为标示量的80.0%~120.0%……”;【含量测定】项下第一行“精密量取本品5ml(2.5%规格取4ml,4.25%规格取2ml),……”更正为“精密量取本品5ml,……”
审批结论经审查,同意以补充颁布件形式更正颁布件[批件号:XGB2007-019]中相关内容。
主送各省级药监局及药检所
抄送中国药品生物制品检定所,国家药典委员会,国家食品药品监督管理局药品审评中心
备注
2008年5月8日。
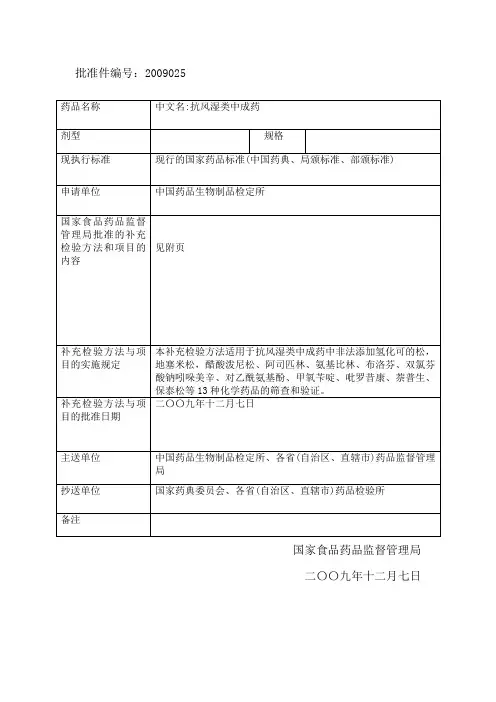
批准件编号:2009025国家食品药品监督管理局二〇〇九年十二月七日抗风湿类中成药中非法添加化学药品补充检验方法本补充检验方法适用于抗风湿类中成药中非法添加氢化可的松,地塞米松、醋酸泼尼松、阿司匹林、氨基比林、布洛芬、双氯芬酸钠、吲哚美辛、对乙酰氨基酚、甲氧苄啶、吡罗昔康、萘普生、保泰松等13种化学药品的快速筛查和确证。
该方法中,薄层色谱法用于快速筛查;高效液相色谱法用于定性检查;经快速筛查或定性检查结果为阳性的样品,需经液——质联用方法验证后出具检验报告。
我局已批复的药品补充检验方法和检验项目批准件(批准件编号2006006)也可同时使用。
一、薄层色谱法[检查](1)阿司匹林、吲哚美辛、布洛芬、双氯芬酸钠、萘普生、对乙酰氨基酚、保泰松、吡罗昔康取供试品一次服用量(片剂除去包衣;胶囊剂取内容物:大蜜丸剪碎,加适量硅藻土),研细,加甲醇10ml,超声处理20分钟,放至室温,滤过;或取液体制剂,水浴蒸干,加甲醇10ml超声外理20分钟,放至室温。
滤过作为供试品溶液。
分别取阿司匹林、吲哚美辛、布洛芬、双氯芬酸钠、萘普生、对乙酰氨基酚、保泰松和吡罗昔康对照品,加甲醇制成每ml含1mg的溶液作为对照品溶液。
照薄层色谱法(中国药典2005年版一部附录VIB)试验,分别取供试品与对照品溶液各10ul点于同一硅胶GF254薄层板上,以正己烷-乙酸乙酯-冰乙酸(15:5:1)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。
供试品色谱中,在与对照品色谱相应的位置上,应不得显相应的荧光淬灭斑点。
(2)氨基比林、甲氧苄啶、地塞米松、氢化可的松、醋酸波尼松分别取氨基比林、甲氧苄啶、地塞米松、氢化可的松、醋酸波尼松对照品,加甲醇制成每 ml含1mg的溶液,作为对照品溶液。
照薄层色谱法(中国药典2005年版一部附录VIB试验,分别取[检查](1)项下供试品溶液和上述对照品溶液各10ul点于同一硅胶 GF254薄层板上,以三氯甲烷-丙酮-甲醇-浓氨(9:3:1:0.1)为展开剂,展开,取出,晾干,置紫外光灯(254nm)下检视。

保健食品中添加违禁药物情况及检测方法研究进展保健食品是近二十年在国内外兴起的新兴食品,系指具有特定保健功能的食品,即适用于特定人群食用,具有调节机体功能,不以治疗疾病为目的的食品。
近几年来,随着科学技术不断进步,保健食品生产工业技术水平不断提高,种类迅速增加,特别是我国加入WTO以后,国外企业纷纷抢占国内市场,进口保健食品品种和数量大幅度上升。
同时,该领域利用高技术手段做假的不法行为也时有发生。
据有关调查结果显示,近两年我国已知的非法添加药品、防腐剂及非食品成分的保健食品有200多种。
保健食品添加违禁成分或掺假,不仅导致不良后果引发的一系列问题和纠纷,而且在使用者不知情的条件下,将产生极大的毒副作用,不断引起人们对保健品背后隐患的担忧。
国家相关法律法规明令禁止在保健食品中添加药物;批准生产销售的保健食品,在其产品广告中禁止宣传疗效作用。
但现在市场上有些不法厂商,在保健食品中滥加药物,在广告中非法宣传疗效,欺骗和诱使消费者购买服用,致使当今滥用保健食品现象极为普遍。
殊不知,药品和保健食品是两个绝然不同的概念,误用加入药物的保健食品危害很大,这是应当引起人们清醒认识和严肃对待的问题。
本文介绍了可用和禁用于保健食品的中药、保健食品中常添加的违禁药物和危害,并就近年来保健食品中常添加的违禁药物检测方法的研究进展作一综述。
1 保健食品与一般食品和药品的区别[1]1.1 保健(功能)食品保健食品是指声称具有特定保健功能或者以补充维生素、矿物质为目的的食品,即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品。
1.2保健(功能)食品和一般食品的区别保健食品与普通食品、药品有着本质的区别(表1),保健食品是指具有特定保健功能的食品。
作为食品的一个种类,保健食品具有一般食品的共性,既可以是普通食品的形态,也可以使用片剂、胶囊剂、颗粒剂、丸剂、口服液等多种特殊剂型,但保健食品的标签和说明书必须标示保健功能。

1.写出以下五个英文缩写的中文:GMP、GSP、GCP、GLP、GAP。
答:GMP: 药品生产质量管理标准GSP: 药品经营质量管理标准GCP: 药品临床试验质量管理标准GLP: 药物非临床研究质量管理标准GAP: 中药材生产质量管理标准2.简述药品质量标准分析方法验证的目的和内容。
答:目的:证明所采用的方法适合于相应检测要求。
验证内容有:准确度、精细度〔包括重复性、中间精细度和重现性〕、专属性、检测限、定量限、线性、范围和耐用性。
3.高效液相色谱法常用检测器有哪七种?不同检测器对流动相有哪些要求?答:高效液相色谱法常用检测器有:紫外检测器、二极管阵列检测器、荧光检测器、示差折光检测器、蒸发光散射检测器、电化学检测器和质谱检测器。
不同的检测器,对流动相的要求不同。
如采用紫外检测器,所用流动相至少符合紫外-可见分光光度法对溶剂的要求;采用低波长检测时,还应考虑有机相中有机溶剂的截止使用波长,并选用色谱级有机溶剂。
蒸发光散射检测器和质谱检测器通常不允许使用含不挥发盐组分的流动相。
4.简述药物分析中常用热分析法的概念及英文缩写。
答:⑴热重分析法〔TGA〕:TGA法是在程序控制温度下,测量物质的重量及温度关系的一种技术。
⑵差热分析法〔DTA〕:DTA法是在程序控制温度下,测定供试品和参比物之间的温度差及温度(或时间)关系的技术。
⑶差示扫描量热分析法(DSC): DSC法是在程序控制温度下,测量输给供试品及参比物热量差(dQ /dT)及温度(或时间)关系的技术。
5.反相色谱系统所采用的流动相适宜的pH范围是多少?为什么?当试验需要的流动相超出此范围时选用何种色谱柱填充剂?答:以硅胶为载体的一般键合固定相填充剂适用pH2~8的流动相。
当pH大于8时,可使载体硅胶溶解;当pH小于2时,及硅胶相连的化学键合相易水解脱落。
当色谱系统中需使用pH大于8的流动相时,应选用耐碱的填充剂,如采用高纯硅胶为载体并具有高外表覆盖度的键合硅胶、包覆聚合物填充剂、有机-无机杂化填充剂或非硅胶填充剂等;当需使用pH小于2的流动相时,应选用耐酸的填充剂,如具有大体积侧链能产生空间位阻保护作用的二异丙基或二异丁基取代十八烷基硅烷键合硅胶、有机-无机杂化填充剂等。
附件药品补充检验方法研制指南为规范和指导药品补充检验方法研制工作,进一步提高药品补充检验方法的科学性、实用性和适用性,依据《药品管理法实施条例》第五十三条规定,制定本指南。
一、研制范围药品补充检验方法针对有掺杂、掺假嫌疑的药品。
在国家药品标准规定的检验方法和检验项目不能检验时,药品检验机构可以补充检验方法和检验项目进行药品检验;经国家食品药品监督管理总局批准后,使用补充检验方法和检验项目所得出的检验结果,可以作为食品药品监管部门认定药品质量的依据。
属于药品标准提高工作的,或针对仿冒产品以及未获得批准文号产品的方法原则上不纳入药品补充检验方法范畴。
二、主要研制内容(一)药品中非法添加化学物质的;(二)化学增重、染色、掺杂掺假的;(三)擅自添加着色剂、防腐剂、香料、矫味剂及辅料的;(四)未按批准的生产工艺生产从而影响药品质量的;(五)存在其他风险物质的。
三、方法确立药品检验机构在药品检验中发现有掺杂掺假嫌疑,且国家药品标准规定的检验方法和检验项目不能检验的,可以起草药品补充检验方法。
起草检验方法前,应深入调查研究,并通过市级及以上食品药品监管部门对拟建立方法的必要性和执法适用性审核,还应避免与在研或已批准方法的重复。
市级及以上食品药品监管部门可以根据监管需要,委托药品检验机构组织起草补充检验方法。
—1 —药品补充检验方法应首先选择建立通用方法,避免同一检查项分别针对不同药品建立多个相同或类似方法。
四、方法研制药品检验机构应按照《药品补充检验方法研制技术要求》(见附1)开展方法起草和研制工作。
起草药品补充检验方法时,同时还应编制起草说明,包括研究背景、检测指标的选择、实验设计、拟定方法、方法学验证、样品测定结果分析等内容。
鼓励科研院所、大专院校、第三方机构或其他社会力量参与开展方法研制。
方法研制过程中应征求技术机构、监管部门等各方面意见,保证方法的科学性、操作性和执法适用性。
五、方法复核方法起草单位应在药品补充检验方法审评委员会秘书处(挂靠单位为中国食品药品检定研究院)推荐的复核单位名单中选择1至3家药品检验机构进行复核,其中至少1家为省级或省级以上药品检验机构。
保健食品中巴比妥类化学成分的快速检测胶体金免疫层析法1 范围本方法规定了保健食品中巴比妥类化学成分的胶体金免疫层析快速检测方法。
本方法适用于硬胶囊、软胶囊、丸剂、片剂、散剂及口服液等保健食品中巴比妥类化学成分的快速测定。
2 原理本方法采用竞争抑制免疫层析原理。
样品中的巴比妥类化学成分经提取后与胶体金标记的特异性抗体结合,抑制了抗体和检测线(T线)上抗原的结合,从而致使检测线不显色。
通过检测线的显色与否判读,对样品中巴比妥类化学成分进行定性判定。
3 试剂和材料除另有规定外,本方法所用试剂均为分析纯,水为GB/T 6682规定的二级水。
3.1 试剂3.1.1 无水乙醇。
3.1.2 提取液:将无水乙醇(3.1.1)与水按照体积比10:90混匀。
3.1.3 甲醇。
3.2 参考物质参考物质的中文名称、英文名称、CAS登录号、分子式、相对分子量见表1,纯度≥95%。
表1 参考物质的中文名称、英文名称、CAS登录号、分子式、相对分子量中文名称英文名称CAS登录号分子式相对分子量巴比妥Barbital 57-44-3 C8H12N2O3184.19苯巴比妥Phenobarbital 50-06-6 C12H12N2O3232.24异戊巴比妥Amobarbital 57-43-2 C11H18N2O3226.27司可巴比妥钠Secobarbital 76-73-3 C12H17N2O3238.28注:或等同可溯源物质。
3.3 标准溶液的配制3.3.1 巴比妥类标准储备液(0.5 mg/mL):精密称取巴比妥(或苯巴比妥,异戊巴比妥,司可巴比妥钠)标准品(3.2.1)适量,置于10mL容量瓶中,加入适量甲醇(3.1.3)超声溶解后,用甲醇稀释至刻度,摇匀,制成浓度为0.5mg/mL的巴比妥类标准储备液。
﹣20 ℃避光保存,有效期6个月。
3.3.2 巴比妥类标准中间液(50μg/mL):精密量取巴比妥类标准储备液(0.5mg/mL)(3.3.1)1mL,置于10mL容量瓶中,用甲醇(3.1.3)稀释至刻度,摇匀,制成浓度为50μg/mL的巴比妥类标准中间液。
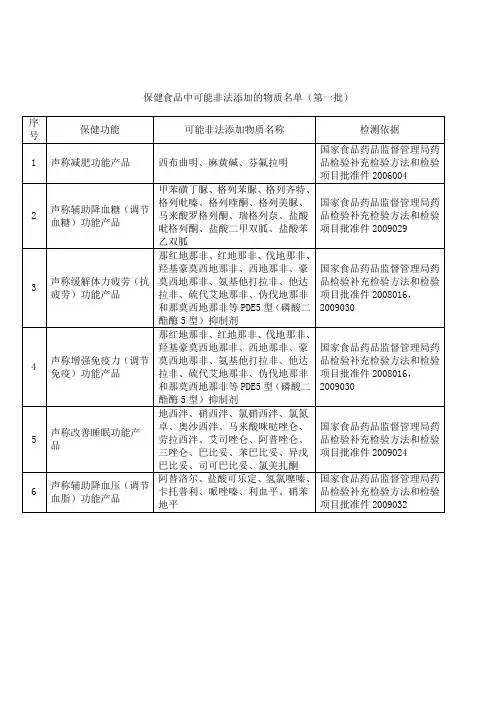
保健食品中可能非法添加的物质名单(第一批)(食药监办保化[2
012]33号)
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
为贯彻落实国务院食品安全委员会办公室《关于进一步加强保健食品质量安全监管工作的通知》(食安办〔2011〕37号)要求,严厉打击保健食品生产中非法添加物质的违法违规行为,保障消费者健康,国家局组织制定了《保健食品中可能非法添加的物质名单(第一批)》,现予以印发。
该名单未涵盖行业内存在的所有非法添加物质,各级食品药品监督管理部门在监督检查中要注意收集名单之外的非法添加物质情况,汇总后报送国家局。
附件:保健食品中可能非法添加的物质名单(第一批)
国家食品药品监督管理局办公室
二○一二年三月十六日附件:
保健食品中可能非法添加的物质名单(第一批)。