“铝三角”的图像分析及计算
- 格式:doc
- 大小:190.50 KB
- 文档页数:2


一、必备知识“铝线法”的基本方法可以由四句话来概括——“相邻粒子不反应,相隔粒子聚中间,隔之越远越易行,所带电荷是关键”1.Al3+―→Al(OH)3(1)可溶性铝盐与少量NaOH溶液反应:Al3++3OH-(少量)===Al(OH)3↓(2)可溶性铝盐与氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH4+2.Al(OH)3―→Al3+Al(OH)3溶于强酸溶液:Al(OH)3+3H+===Al3++3H2O3.Al3+―→AlO2-可溶性铝盐与过量的强碱反应:Al3++4OH-(过量)===AlO2-+2H2O4.AlO2-―→Al3+偏铝酸盐溶液与足量的盐酸反应:AlO2-+4H+===Al3++2H2O5.AlO2-―→Al(OH)3 (1)偏铝酸盐溶液中加少量盐酸:AlO2-+H+(少量)+H2O===Al(OH)3↓(2)偏铝酸盐溶液中通入CO2:2AlO2-+CO2(少量)+3H2O==2Al(OH)3↓+CO32-AlO2-+CO2(过量)+2H2O===Al(OH)3↓+HCO3-6.Al(OH)3―→AlO2-Al(OH)3溶于强碱溶液:--二、铝的图像分析1.铝盐溶液和氨水的反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ n沉淀n NH33 .H2O2.向AlCl3溶液中滴加NaOH溶液至过量⑴Al3++3OH-=Al(OH)3↓⑵Al(OH)3+OH-=AlO2-+2H2On沉淀VNaOH3.向NaOH溶液中滴加AlCl3溶液至过量⑴Al3++4OH-= AlO2-+2H2O⑵Al3++ 3AlO2-+6H2O =4Al(OH)3↓n沉淀0 1 2 3 4V AlCl3离子方程式:⑴AlO2-+H++H2O =Al(OH)3↓⑵Al(OH)3+3H+=Al3+ +3H2O图像:n沉淀V0 1 2 3 495.向HCl溶液中滴加NaAlO 2溶液至过量图像:n沉淀VNaAlO20 1 2 3 4⑴AlO 2-+4H + =Al 3+ +2H2O ⑵Al 3++3AlO 2-+6H 2O =4Al(OH)3↓离子方程式看面看线看点跟铝有关的图像分析典例分析1.下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )B.向1 L浓度分别为0.1 mol·L-1和0.3mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液D.向AlCl3溶液中滴加过量氨水跟铝有关的图像分析解析 Ba(OH)2和NaAlO2中加入H2SO4,发生的反应依次为,所以加1 L H2SO4时,Ba(OH)2反应完,再加0.5 L H2SO4时,AlO2(-)反应完全,再加1.5 L H2SO4时,Al(OH)3全部溶解,A正确;向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的NaOH溶液,发生的反应依次是Al3++3OH-===Al(OH)3↓、OH-+NH4+===NH3·H2O、Al(OH)3+OH-===+2H2O,所以沉淀Al3+和溶解Al(OH)3所用NaOH的量之比为3∶1,而图像上看到的是1∶1,B错误;向烧碱溶液中滴加明矾溶液,发生的反应依次是Al3++4OH-==+2H2O、Al3++3+6H2O===4Al(OH)3↓,C错误;AlCl3溶液中滴加过量氨水,沉淀不会溶解,D错误。
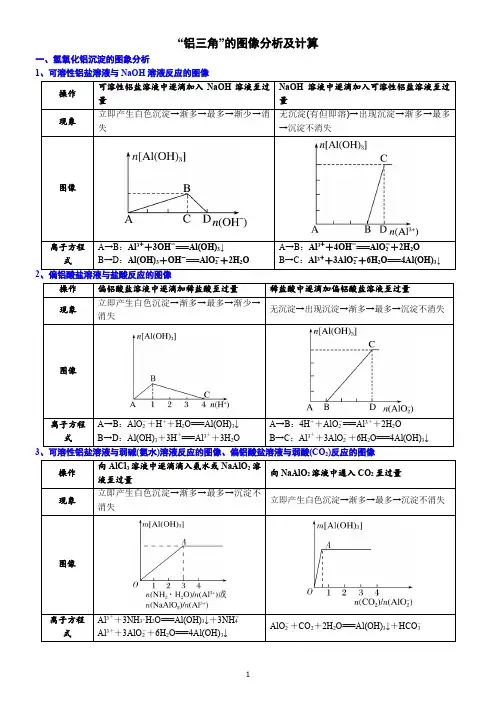
“铝三角”的图像分析及计算一、氢氧化铝沉淀的图象分析1、可溶性铝盐溶液与NaOH溶液反应的图像A→B:Al3++3OH-===Al(OH)↓A→B:Al3++4OH-===AlO-+2H OA→B:AlO-+H++H O===Al(OH)↓A→B:4H++AlO-===Al3++2H O32Al3++3NH·H O===Al(OH)↓+3NH+4、可溶性铝盐、镁盐混合液与NaOH溶液反应的图像O→A:H++OH-===H O(1)向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量O →A:H++OH-===H O(2)把2O →A:2KAl(SO)+3Ba(OH)===2Al(OH)↓+3BaSO↓+K SO类型一图像认识1、向含有盐酸的AlCl3 溶液中慢慢滴入NaOH 溶液,生成沉淀W(g)与所加NaOH 溶液体积V的关系如下图,其中正确的是( )2、如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是()A.①线表示Al3+的物质的量的变化B.x表示AlCl3的物质的量C.①线表示Al(OH)3的物质的量的变化D.①线表示AlO-2的物质的量的变化3、下列实验操作对应的图像不正确的是()1、向30mL1mol·L-1的AlCl3溶液中逐渐加入浓度为4mol·L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为()A.3mL B.7.5mL C.15mL D.17.5mL2、现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO2-4的物质的量之比为()A.1①3 B.2①3 C.6①1 D.3①13、向混有一定量盐酸的硫酸铝和硫酸镁混合溶液中,逐滴加入2mol/L的NaOH 溶液,所生成沉淀W g 与加入NaOH 溶液的体积V( mL)如图所示,则原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为()A.1:3:1 B.1:2:1 C.1:1:2 D.1:1 :14、某溶液中可能含有H+、NH+4、Mg2+、Al3+、Fe3+、CO2-3、SO2-4、NO-3中的几种。

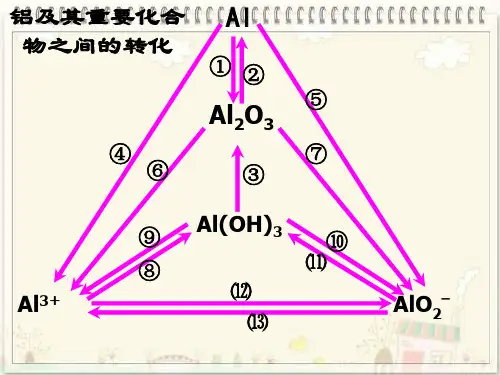
第二讲铝三角及其图像【相互转化】①A l3+AlO2-②④③⑤⑥Al(OH)3【图像分析】(1) 向Al3+的溶液中加入强碱(OH―)现象:先出现白色溶液后消失方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:(2) 向强碱溶液中加入Al3+现象:先没有沉淀后出现并不消失方程式:Al3++4OH―==AlO2―+2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:(3) 向AlO2―溶液中加入H+现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O图像:(4) 向H+溶液中加入AlO2―现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解方程式:AlO2―+4H+==Al3++2H2O3AlO2―+Al3++6H2O==4A l(O H)3↓图像:作业:例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?解:(1) 设原合金中Mg的质量为X,Al的质量为yMg -----M g(O H)2Al-----A l(O H)324 58 27 78x 11.6 y 19.4-11.6==7.8x=4.8 g y == 2.7 g(2) 当沉淀达到最大值时,则n(HCl)==n(NaOH)则c(HCl)== 5*160/100= 8 mol/L[点击试题]1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )A.78gB.15.6gC.7.8gD.3.9g2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL 和45mL时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。


元素化合物知识作为其他化学知识的载体,在中学化学中占有举足轻重的地位。
纵观近几年的高考试题,铝、氧化铝、氢氧化铝、常见的铝盐(如氯化铝、明矾等)一直是命题的热点。
Al3+、Al(OH)3、AlO2-的相互转化,应用在离子分离(如Mg2+、Al3+的分离)、共存及推断中的试题屡屡出现。
2001年开始高中化学教学采用了新教材。
不难发现铝这一节的内容与原教材相比,有了较大幅度的调整——将其改编在平衡章节之后,要求学生用平衡的理念来分析。
这势必对学生这一节的学习,提出了更高的要求。
而同为金属的镁、铁的章节却做了大幅度的删减。
因此,大胆假设今后几年试题仍将在Al与酸反应、Al3+与碱反应,AlO2-与酸反应的离子方程式书写以及计算、图象分析等方向作文章。
传统的教学方式中,往往习惯于采用“铝三角”来教学。
铝三角可以表明Al3+、Al(OH)3、AlO2-之间存在一定关联,三者之间可以通过加入酸或者碱相互转化。
然而关键的定量关系(Al3+与OH-相互滴加产物的讨论等)不能通过“铝三角”得以体现。
因为,铝三角忽略了最为关键的一点:AlO2-是Al(OH)3在OH-过量时产生的。
为了解决这一问题,笔者大胆提出“线型”学铝策略。
一.线型学铝概念的提出“线型学铝”策略中所谓的“铝线”,其实就是由H+ Al3+ Al(OH)3 AlO2- OH-五个粒子所构成的一条关系线。
出于H+、OH-与Al3+、Al(OH)3、AlO2-的紧密关系考虑,与“铝三角”不同,“铝线”中加入了H+、OH-这两种离子。
感觉上,粒子数的增加,使问题变的更为复杂;而实际上,只是将原本转换关系中隐藏的粒子更直观、更清晰表现出来。
二.线型学铝概念的剖析“线型学铝”基本内容可以由四句话来概括——相邻粒子不反应,相隔粒子聚中间,隔之越远越易行,所带电荷是关键。
(一)相邻粒子不反应——解决粒子间共存问题有铝元素参加的粒子间共存问题的讨论一直是会考、高考的热点,2004年的浙江省会考试卷中就有两题(第4题、第23题)涉及这一内容。


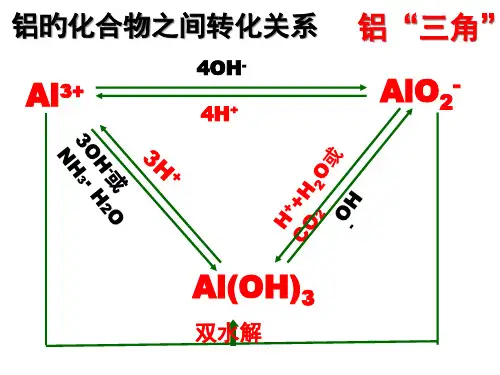
①过量OH —②过量H +③H + ④OH —⑤H + ⑥OH — 知识点一、铝三角1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系有关离子方程式:A 、Al 3+与AlO 2—的相互转化①Al 3+→AlO 2—:Al 3+ + 4OH -= AlO 2-+2H 2O ②AlO 2—→Al 3+: AlO 2-+ 4H + = Al 3+ + 2H 2O B 、AlO 2—与Al(OH)3的相互转化③AlO 2—→Al(OH)3:H + + AlO 2-+ H 2O= Al(OH)3 ↓ ④Al(OH)3→AlO 2—:Al(OH)3 + OH -= AlO 2-+2H 2O C 、Al 3+与Al(OH)3的相互转化⑤Al(OH)3→Al 3+:Al(OH)3 + OH -= AlO 2-+2H 2O ⑥Al 3+→Al(OH)3:Al 3+ + 3OH -= Al(OH)3↓ 2、铝三角的应用 ①制取Al(OH)3常用弱碱与可溶的铝盐反应:Al 3+ + 3NH 3·H 2O == Al(OH)3↓+3NH 4+ 也可以用偏铝酸盐与弱酸反应:AlO 2- + CO 2 + 2H 2O == Al(OH)3↓+ CO 32- 还可以用铝盐与偏铝酸盐反应:Al 3+ + 3AlO 2-+ 6H 2O = 4Al(OH)3 ↓ ②离子共存问题:a 、Al 3+与OH —、S 2—、AlO 2—、HCO 3—、CO 32—、HSO 32—等离子因生成沉淀或双水解而不能大量共存; b 、AlO 2—与Al 3+、H +、NH +、Fe 3+等离子因生成沉淀或双水解反应而不能大量共存。
知识点二、铝的化合物的有关图象1、四个基本图象①向铝盐溶液中逐滴滴加强碱性溶液直至过量 ②向强碱性溶液中逐滴滴加铝盐溶液直至过量Al 3+Al(OH)3AlO 2—现象:先产生沉淀,后沉淀消失。
铝三角复习Al(OH)3的性质:两性氢氧化物Al(OH)3 + HCl === ;Al(OH)3 + NaOH === 。
一、Al(OH)3的两性电离方程式:()()由电离方程式可推出:二、铝三角(Al3+、Al(OH)3、AlO2-之间的转化关系)涉及到的四个离子方程式:① Al3+ + 3OH- === ② Al(OH)3 + OH- === ③ AlO2- + H+ + H2O === ④ Al(OH)3 + 3H+ ===(1) Al(OH)3 (2) Al(OH)3Al3+ AlO2- Al3+ AlO2-离子方程式:离子方程式:(1)(2)联合推出Al(OH)3Al3+ AlO2-三、与生成Al(OH)3沉淀有关的图像:1.把强碱溶液逐滴加到铝盐(Al3+)溶液中至过量 2. 把铝盐(Al3+)溶液逐滴加到强碱溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:3.把强酸溶液逐滴加到AlO2- 溶液中至过量 4. 把AlO2- 溶液逐滴加到强酸溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:5.把氨水逐滴加到铝盐(Al3+)溶液中至过量 6. 把CO2通入到AlO2- 溶液中至过量①现象:①现象:②有关反应:②有关反应:③图像:③图像:7.往等物质的量的AlCl3、MgCl2混合溶液中加入NaOH溶液至过量①现象:③图像:②有关反应:四、制备Al(OH)3的方法:方法1:向铝盐溶液中加入化学方程式:离子方程式:方法2:向NaAlO2溶液中通入足量化学方程式:离子方程式:方法3:溶液和溶液混合化学方程式:离子方程式:课堂练习:1.已知某溶液中可能有Mg2+、Al3+、NH4+中的一种或几种,向其中加入NaOH溶液至过量,得到的图像可能如下:由图像分析溶液中的成分:①②③④2.向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回答下列问题:(1)图中A点表示的意义是(2)图中B点表示的意义是(3)上述两步反应用总的离子方程式可表示为:(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为。
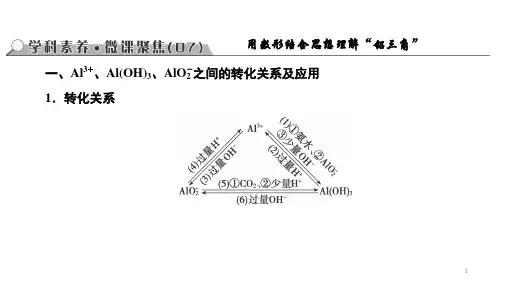
高考过关知识点4“铝三角”的转化关系及图像分析命题点1“铝三角”转化与应用1.Al3+、Al(OH)3、[Al(OH)4]-之间的转化关系2.“铝三角”转化的应用(1)判断离子共存问题:Al3+与OH-及[Al(OH)4]-、CO2-3、S2-等弱酸根阴离子;[Al(OH)4]-与H+、HCO-3以及弱碱阳离子Al3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量共存。
(2)鉴别(利用滴加顺序不同,现象不同)。
①向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。
②向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
[对点训练1](2017·青岛模拟)下列说法不正确的是()A.铝箔插入稀硝酸中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜B. 如右图所示,①中为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成C.Al2O3――→NaOH(aq)△Na[Al(OH)4](aq)――→CO2Al(OH)3D.AlCl3溶液中滴加NaOH溶液后铝的存在形式:A[铝与稀HNO3发生反应有NO生成,不能形成氧化膜,A不正确;浓氨水挥发出的NH3被AlCl3溶液吸收生成白色沉淀Al(OH)3,B正确;Al2O3为两性氧化物与NaOH反应生成Na[Al(OH)4],Na[Al(OH)4]溶液遇CO2生成Al(OH)3,C正确;当n(NaOH)∶n(AlCl3)=3时,恰好生成Al(OH)3,当n(NaOH)∶n(AlCl3)=4时,恰好生成Na[Al(OH)4],D正确。
][对点训练2](2017·西安名校三检)某无色透明溶液与铝反应放出氢气,该溶液中可能含有Mg2+、Cu2+、Ba2+、H+、Ag+、SO2-4、SO2-3、HCO-3、OH-、NO-3十种离子中的若干种,下列推断正确的是()A.当溶液中有Al3+生成时,溶液中可能存在:SO2-4、NO-3、H+、Mg2+B.当溶液中有Al3+生成时,溶液中一定存在:H+、SO2-4;可能存在Mg2+C.当溶液中有[Al(OH)4]-生成时,溶液中一定存在:OH-、Ba2+、NO-3D.当溶液中有[Al(OH)4]-生成时,溶液中可能存在:OH-、Ba2+、NO-3、SO2-3B[据题意,一定不含有Cu2+、HCO-3。
高一化学必修一知识点:铝三角高一化学必修一知识点:铝三角铝是高中化学重要的金属,主要有铝、氧化铝、氢氧化铝。
高考化学中铝的考点主要集中的铝及其化合物的两性,即既可以与酸反应,也可以与碱反应。
点击图片可在新窗口打开铝三角主要体现了铝及其化合物的两性一、单质铝(Al)铝是一种活泼金属,具有金属的共性,能够与非金属、酸、某些盐反应,同时具有自己特有的性质,可以与碱反应。
铝极易失去最外层3个电子形成铝离子:Al-3e-=Al3+。
1.铝与非金属反应铝可以与大多数非金属单质反应,如氧气、氯气、硫、溴等,生成相应的氧化物或盐。
4Al+3O2点击图片可在新窗口打开2Al2O3;2Al+3S点击图片可在新窗口打开Al2S3;2Al+3Cl2点击图片可在新窗口打开2AlCl3;2.铝与酸反应这里所说的酸,主要指稀硫酸和稀盐酸,常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸。
注意钝化也属于化学变化。
2Al+6HCl=2AlCl3+3H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;3.铝与强碱反应大多数金属不与碱反应,与强碱反应,是铝特有的性质,(锌也可以发生类似的反应,了解即可)2Al+2NaOH+2H2O==2NaAlO2+3H2↑;对应离子方程式:2Al+2OH-+2H2O==2AlO2-+3H2↑;该反应的本质是铝首先与水反应,生成氢氧化铝与氢气,2Al+6H2O=2Al(OH)3+3H2↑;然后,氢氧化铝与氢氧化钠反应,2Al(OH)3+2NaOH=2NaAlO2+4H2O。
在整个过程中,水是氧化剂,而氢氧化钠不是氧化剂。
在解答电子转移和电线桥双线桥法的题目中要注意。
4.铝热反应铝热反应是指铝在高温条件下还原金属氧化物,置换金属单质的一种反应,不是特指与铝与氧化铁的反应。
2Al+Fe2O3点击图片可在新窗口打开2Fe+Al2O3,铝具有较强的还原性,可以还原一些金属氧化物,如氧化钨,二氧化锰等等。
铝的化合物之间的相互转化—铝三角【要点解读】1.Al3+―→Al(OH)3(1)可溶性铝盐与少量NaOH溶液反应:(2)可溶性铝盐与氨水反应:2.Al(OH)3―→Al3+:Al(OH)3溶于强酸溶液:3.Al3+―→AlO2-:可溶性铝盐与过量的强碱反应:4.AlO2-―→Al3+:偏铝酸盐溶液与足量的盐酸反应:5.AlO2-―→Al(OH)3:偏铝酸钠溶液中加入少量盐酸:6.Al(OH)3―→ AlO2-:Al(OH)3溶于强碱溶液:【温馨提示】三种物质相互转化注意反应条件,特别是Al(OH)3既能溶于强酸,又能溶于强碱。
【特别提醒】1.两性化合物的概念指既能与酸反应,又能与碱反应的化合物。
与酸或碱反应生成的产物是盐和水的化合物才是两性化合物。
弱酸的铵盐、弱酸的酸式盐不属于两性化合物。
2.Al(OH)3的三种制备方法(1)用铝盐和氨水制备Al(OH)3,不选用强碱(如NaOH)溶液,是由于Al(OH)3溶于强碱溶液,而不溶于弱碱(如氨水)溶液。
(2)溶液中AlO2-→Al(OH)3最好通入CO2,而不是选用强酸,因为氢氧化铝溶于强酸,而不溶于较弱的酸。
3.常见的既能与酸反应又能与碱反应的物质(1)金属单质:Al等;(2)两性氧化物:Al2O3等;(3)两性氢氧化物:Al(OH)3等;(4)弱酸的铵盐:(NH4)2CO3、CH3COONH4、(NH4)2S等;(5)弱酸的酸式盐:NaHCO3、KHS、NaHSO3等。
【重难点点睛】(1)Al单质及其化合物推断突破口Al、Al2O3、Al(OH)3既能与强酸反应又能与强碱反应。
(2)Al元素化合物之间的典型转化关系①②。
“铝三角”的图像分析及计算
教学设计
教学目标:1.使学生熟练掌握“铝三角”相关的离子反应方程式
2.学会有关“铝三角”的图像分析
3.学会进行关于“铝三角”的简单计算
教学重点、难点
“铝三角”的图像分析和计算
教学过程:
【学生活动】
①
A l3+AlO2-
②
④③⑤⑥
Al(OH)3
根据铝三角的转化关系图写出相应的离子方程式
【教师】从电荷守恒的角度来帮助学生理解记忆离子方程式
比如:Al3+ AlO2-Al3+带三个正电荷,而AlO2-带一个负电荷,从Al3+转变AlO2-必须要4个负电荷,也就是是4个OH-,因此该离子反应方程式为Al3++4OH-= AlO2-+2H2O 【学生活动】根据反应的不同情况画出图像
【教师活动】帮助学生分析题目的意思,解答相应的问题,并给出评价
反应顺序:
先:Al3++3OH-=Al(OH)3↓
后:Al(OH)3+OH-=AlO2-+2H2O
根据反应的先后和计量系数画出图像
AlCl3溶液中滴加NaOH溶液
【学生活动】根据相关知识解答问题
【典型例题】向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回答下列问题:
(1)图中A点表示的意义是
(2)图中B点表示的意义是
(3)上述两步反应用总的离子方程式可表示为:
(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为。
【教师活动】指导学生用正确的方法解题,并且总结
方法要领:有关图像的问题,通常的解法是“三看、三守恒”
一看面:分析清楚横纵坐标的意义
二看线:图像的整体走势要分析清楚,特别是每段对应的反应情况
三看点:分析透彻各个拐点(开始沉淀、完全沉淀、沉淀溶解等等)
在解题中综合应用:元素守恒、电荷守恒、得失电子守恒
答案:A点表示得到Al(OH)3沉淀的最大值
B点表示Al(OH)3沉淀完全溶解
Al3++4OH-=AlO2-+2H2O
体积有两解V=7.5mL或者V=17.5mL
【学生活动】在对例题掌握到位的基础之上,进行强化的变式训练
【变式训练1】Al2(SO4)3和MgSO4混和,
加适量水溶解,再加入KOH溶液,析出
的沉淀量(W)与KOH溶液体积(V)的关系如图,
则Al2(SO4)3和MgSO4的物质的量之比是
A. 2:1
B. 1:2
C. 1:1
D. 1:3
答案:C
【变式训练2】
将一定质量的镁铝合金全部溶解在200mL盐酸中(体积变化不计),取10mL反应后的溶
液,用1mol/LNaOH溶液滴定得下图关系
(1)求Mg、Al的质量各是多少?
(2)求盐酸的物质的量浓度为多少?
答案:m(Mg)=1.44g
m(Al)=1.08g
c(HCl)=1.4mol/L
【教师活动】
总结方法、布置作业。