第二章 热力学第一定律
- 格式:pdf
- 大小:873.54 KB
- 文档页数:20





第二章 热力学第一定律第一节 第一定律的实质及热力学能和总能能量守恒与转换定律是自然界的基本规律之一,它指出:自然界中的一切物质都具有能量,能量不可能被创造,也不能被消灭;但能量可以从一种形态转变为另一种形态,且在能量的转化过程中能量总量不变。
热力学第一定律是能量守恒与转换定律在热现象中的应用。
它确定了热力过程中热力系统与外界进行能量交换时,各种形态能量数量上的守恒关系。
一、热力学能热力学能是与物质内部粒子的微观运动和粒子的空间位置有关的能量。
它包括分子移动、转动、粒子震动运动的内动能和分子间由于相互作用力的存在而具有的内位能,故又称内能。
内动能取决于分子热运动,是温度的函数,而内位能取决于分子间的距离,是比体积的函数,即u = f ( T, v )二、总能除热力学能外,工质的总能量还包括工质在参考坐标系中作为一个整体,因有宏观运动速度而具有动能、因有不同高度而具有位能。
前一种能量称之为内部储存能,后两种能量则称之为外部储存能。
我们把内部储存能和外部储存能的总和,即热力学能与宏观运动动能和位能的总和,叫做工质的总储存能,简称总能。
即p k E U E E =++ (2-1)E---总能; U---热力学能; E k ---宏观动能; E p ---宏观位能。
第二节 第一定律的基本能量方程及工质的焓一、焓在有关热力计算总时常有U+pV 出现,为了简化公式和计算,把它定义为焓,用符号H 表示,即H=U+pV (2-2)1kg工质的焓值称为比焓,用h表示,即h=u+pv (2-3)焓的单位是J,比焓的单位是J/kg。
焓是一个状态参数,在任一平衡状态下,u、p和v都有一定得值,因而焓h也有一定的值,而与达到这一状态的路径无关。
当1kg工质通过一定的界面流入热力系统时,储存于它内部的热力学能当然随着也进入到系统中,同时还把从外部功源获得的推动功pv带进了系统。
因此系统中因引进1kg工质而获得的总能量是热力学能与推动功之和(u+pv),即比焓。




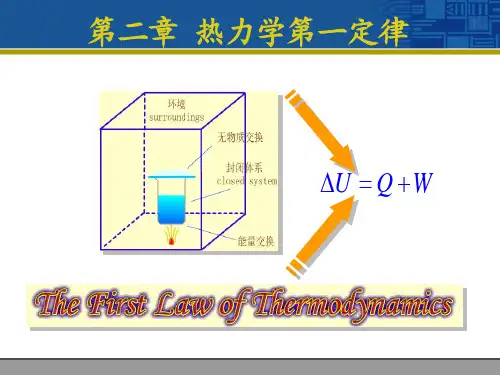
第二章热力学第一定律First law of thermodynamics First law of thermodynamics2–1 热力学第一定律的实质2-2 热力学能(内能)和总能2-22–3 热力学第一定律基本表达式2–4 闭口系基本能量方程式252–5 开口系能量方程12–1热力学第一定律的实质一、第一定律的实质能量守恒与转换定律在热现象中的应用。
二、第一定律的表述第定律的表述热是能的一种,机械能变热能,或热能变机械能的时候,他们之间的比值是一定的。
或:热可以变为功,功也可以变为热;一定量的热消失时必定产生相应量的功;消耗一定量的功时,必出现与之相应量的热。
22–2 热力学能(内能)和总能一、热力学能(internal energy)UU chU nu k平移动能U thU k 转动动能振动动能()T f 1),(v T U U =U p —()v T f ,2二、总(储存)能(total stored energy of system)、总(储存)能(o s o ed e e gy o sys e )++热力学能,内部储存能k pk pE U E E e u e e =++=3总能外部储存能宏观动能宏观位能宏观动能与内动能的区别2–3 热力学第一定律基本表达式加入系统的能量总和-热力系统输出的能量总和= 热力系总储存能的增量δW+d EE d Eδi im e δj jm e δQd ττ+τ流入:δδi iQ m e +∑流出:δδjjW m e+∑5内部贮能的增量:d E2–4 闭口系基本能量方程式τ⎡()()21tot δδj j i i Q E e m e m W τ⎤=∆+Σ−Σ+⎣⎦∫闭口系,δ0δ0i j m m ==忽略宏观动能U k 和位能U p ,E U∆=∆δd δδd δQ U W Q U W u wu w=∆+=+=∆+=+q q 第一定律第一解析式—功的基本表达式热7讨论:δd δU W U W =∆+=+δd δQ Q q u wq u w=∆+=+1)对于可逆过程δd d Q U p V=+2)对于循环netnetδd δQ U W QW =+⇒=∫∫∫ 3)对于定量工质吸热与升温关系,还取决于W 的”“+”、“–”、数值大小。

第二章热力学第一定律1.1概述本章的主要内容是通过热力学第一定律计算系统从一个平衡状态经过某一过程到达另一平衡状态时,系统与环境之间交换的能量。
、恒压条件下,△H =Q p 。
系统状态变化时,计算系统与环境间交换的能量状态),m dT1.2主要知识点1.2.1状态函数的性质状态函数也称热力学性质或变量,其值由系统所处的状态决定。
当系统的状态变化时,状态函数Z 的改变量Z 只决定于系统始态函数值1Z 和终态函数值2Z ,而与变化的途径过程无关。
即21Z Z Z 如21T T T ,21U U U 。
另外,状态函数也即数学上的全微分函数,具有全微分的性质。
例如,(,)U f T V ,则d (/)d (/)d V T U U T T U V V热力学方法也即是状态函数法,所谓状态函数法就是利用状态函数①改变值只与始、末态有关而与具体途径无关以及②不同状态间的改变值具有加和性的性质,即殊途同归,值变相等;周而复始,其值不变的特点,用一个或几个较容易计算的假设的变化途径代替一个难以计算的复杂变化过程,从而求出复杂的物理变化或化学变化过程中系统与环境之间交换的能量或其它热力学状态函数的变化值。
1.2.2平衡态在一定条件下,将系统与环境隔开,系统的性质不随时间改变,这样的状态称为平衡态。
系统处于平衡态一般应满足如下四个条件:①热平衡:系统各点温度均匀;②力学平衡:系统各点压力相等;③相平衡:即宏观上无相转移;④化学平衡:化学反应已经达到平衡。
应该特别注意平衡态与稳态的不同。
一个处于热力学平衡态的系统必然达到稳态,即各热力学性质不随时间而变化。
但是处于稳态的系统并不见得达到平衡态。
稳态只不过是系统的各物理量不随时间变化而已。
例如,稳定的热传导过程,系统各处温度并不相等,但不随时间变化;还有,稳定的扩散过程,各点浓度并不相等,但却不随时间变化。
1.2.3热系统与环境间由于温差而交换的能量。
热是物质分子无序运动的结果,是过程量。
在绝热系统中发生了放热反应,尽管系统的温度升高,但0Q 。
这是因为系统没有与环境交换热量。
热不是状态函数。
从同一始态到同一终态,途径不同热也不同。
常用的有恒压热p Q 和恒容热V Q 。
热值的符号规定为系统吸热取正值,放热取负值。
1.2.4功除热以外的、在系统与环境间交换的所有其它形式的能量。
功是物质分子有序运动的结果,也是过程量。
热力学中将功分为体积功和非体积功。
涉及到的非体积功主要有表面功和电功,将分别在界面现象和电化学部分进行讨论。
功不是状态函数,故相同的始态和终态间发生的变化,其途径不同所作的功是不同的。
即功与过程有关。
体积功的计算公式为21amb d V V W p V其中,p amb 为环境压力。
这是体积功计算的基本公式或通用公式。
此公式对可逆或不可逆功、膨胀功或压缩功的计算都是适用的。
若是可逆过程,系统压力与环境压力处处相等(实际上只相差无限小量),此时环境压力amb p 可以用系统压力p 来代替,体积功的计算公式变为21d V V W p V功的符号规定为系统对外做功取负值,环境对系统做功取正值。
1.2.5热力学能热力学能也称为内能。
是状态函数,包括系统内部一切能量,但是不包括系统整体的动能和势能,即系统整体所处位置的高低,以及系统整体是处于运动状态还是处于静止状态对热力学能并无影响;热力学能的绝对值不知道。
理想气体的热力学能仅是温度的函数。
因为理想气体分子间没有作用力,体积变化不会引起分子间势能的变化,但是温度的改变会引起分子动能的变化。
对于凝聚态物质,如果压力变化范围不大,则压力对热力学能的影响可忽略不计。
封闭系统在恒容及0W (W 表示非体积功,下同)的条件下,d V V U Q C T对理想气体即使不恒容仍可用此式计算热力学能的变化,因为理想气体()U f T ,仅是温度的函数,恒容与否对U 并无影响。
d V U C T1.2.6焓焓的定义为H U pV 。
焓是状态函数,绝对值不知道。
从定义式看,焓并无明确的物理意义。
比较重要的性质是封闭体系在恒压及0W 时pH Q 即此时焓的改变值与恒压热相等。
对于单纯pVT 变化,在上述条件下有d p p H Q C T但对于非恒压过程焓的变化并不等于过程热。
对于理想气体即使不恒压仍可用此式来计算焓变,因为理想气体()H f T ,仅是温度的函数,恒压与否对H 焓并无影响。
d p H C T同热力学能一样,在通常情况下,由于凝聚系统的不可压缩性,改变压力导致系统状态的变化很小,故状态函数焓的变化值也就很小。
1.2.7热力学第一定律热力学第一定律的数学表达式为U Q W要注意此式的使用条件是封闭系统。
另外,要注意功和热的正负号。
值得注意的是:当系统从状态(1) 状态(2)通过不同的途径时,W 和Q 分别有不同的值,但二者之和Q W 却为一定值,只与始末态有关。
U Q W 既说明了热力学能、热和功可以互相转化,又表述了它们转化时的定量关系。
因此我们可以利用热力学第一定律通过计算系统状态(1)→状态(2)的变化过程中系统与环境之间交换的Q 和W ,进而计算由于系统与环境之间所交换的能量。
并得到系统热力学能的变化U 。
1.2.9可逆过程定义:系统经过某一过程由状态(1)变到状态(2)之后,如果能使系统和环境完全复原(即系统回到始态且不在环境留下任何痕迹),则这样的过程就称为可逆过程。
可逆过程有如下特点:①状态变化时推动力与阻力相差无限小,系统与环境始终无限接近于平衡态;②过程中的任何一个中间态都可以从正、逆两个方向到达;③系统经过一个循环后,系统和环境均恢复原态,变化过程中无任何耗散效应;④在相同的始、终态间,恒温可逆过程系统对环境作最大功,环境对系统作最小功;⑤由于状态变化时推动力与阻力相差无限小,所以完成过程所需时间为无限长。
可逆过程是一种科学的抽象,是一种假想的理想化过程,实际发生的过程均为不可逆过程。
尽管如此,可逆过程却是物理化学中一个非常重要的过程,例如“在相同的始、终态间,恒温可逆过程系统对环境作最大功,环境对系统作最小功”;在热力学和电化学之间起着桥梁作用的重要公式m ,()=T p rG zFE 也只有在可逆条件下才成立。
对于实际的变化过程,有些状态函数的改变值只有通过设计可逆过程才能进行计算,例如第二章中计算实际变化过程熵变△S 。
可以毫不夸张地说:通过设计可逆过程来计算不可逆过程状态函数的改变值是物理化学的重点、也是考研的重点之一。
如何辨别和设计可逆过程,是进行物理化学计算必须重点掌握的内容。
例如,在物理化学计算中将在推动力与阻力相差无限小条件下进行的实际过程如:在p 体p 环=d p 条件下进行的恒温膨胀和压缩过程;在T 体T 环=d T 条件下进行的传热过程;在某一温度以及与该温度对应的平衡压力下进行的相变过程等近似按可逆过程处理。
1.2.10理想气体绝热过程理想气体绝热可逆过程方程式有下列三种形式pV 常数;1TV =常数;(1)/T p 常数;或者1122p V p V;111122TV T V ;(1)/(1)/1122T p T p。
其中/p V C C ,称为热容比,也曾称为理想气体的绝热指数。
理想气体绝热过程是考研的重要内容之一。
对于理想气体绝热过程,关键是求终态温度2T 。
值得注意的是,可逆过程和不可逆过程(恒外压过程)求2T 所用的方程是不同的,千万不可用错。
对于可逆过程,根据题目给定的条件,可用上述三个过程方程中的任意一个,也可用公式11,m 211121(-)=[/( -1)](1/-1/)V nC T T p V V V计算2T ;而对于不可逆过程则只能用公式,m 21221(-)=-(-)V nC T T p V V 计算2T 。
1.2.11相变焓通常纯物质的相变化是在恒定压力和恒定温度下进行,因此恒压下的相变焓也就是相变过程的热效应,故也称相变热。
1.2.12标准摩尔反应焓的计算主要有两种方法计算标准摩尔反应焓r m H,即由标准摩尔生成焓f m H和标准摩尔燃烧焓c m H计算。
r m B f m B(B)H H(由标准摩尔生成焓计算r m H)r m B c m B(B)H H (由标准摩尔燃烧焓计算r m H)1.2.13标准摩尔生成焓物质B 的标准摩尔生成焓是一定温度下由热力学稳定单质生成化学计量数B 1 的物质B 的标准摩尔反应焓。
离子的标准摩尔生成焓是在标准状态下由稳定单质生成无限稀溶液中1mol 离子的焓变。
规定,在标准状态下由2H (g)生成无限稀溶液中+1 mol H 的标准摩尔生成焓为零。
值得注意的是物质B 的标准摩尔生成焓并不是其焓的绝对值,而是相对于稳定单质的标准摩尔生成焓为零的焓值。
1.2.14标准摩尔反应焓随温度的变化 基希霍夫公式21B r m 2r m 1,m ()()(B)d T p TH T H T C T,m ,()(B)r m p B p r m pBH C C T1.2.15恒容反应热与恒压反应热的关系对于没有气体参加的凝聚态间的反应0W ,()0pV ,Q U H 。
对于有气态物质参加的反应r m r m B()Bg H U RT 。
1.2.16节流膨胀绝热条件下,气体始末态压力分别保持恒定的膨胀过程。
该过程是一个等焓过程。
J-T H (/)T p 称为焦耳-汤姆逊系数,或节流膨胀系数,是系统的强度性质。
通常情况下,大部分气体经节流膨胀后J-T 0 ,温度下降,产生致冷效应。
理想气体经节流膨胀后温度不变。
1.当理想气体冲入一真空绝热容器后,其温度将(a)升高(b)降低(c)不变(d)难以确定(答案)c (△U=Q+W,∵p 外=0,∴W=0,又∵绝热,∴Q=0,所以△U =0)因为是真空故不做功,又因为是绝热故无热交换,故△U =0。
温度不变。
2.当热力学第一定律写成d U =δQ –p d V 时,它适用于(a).理想气体的可逆过程(b).封闭体系的任一过程(c).封闭体系只做体积功的可逆或等压过程(d).封闭体系的等压过程(答案)c(W=W 体+W 非,当W 非=0时,W 体=-pdV)3.对热力学可逆过程,下列说法中正确的是(a)过程进行的速度无限慢(b)没有功的损失(c)系统和环境可同时复原(d)不需环境做功(答案)c 可逆过程:体系经过某一过程从状态(1)变到状态(2)之后,如果能够使体系和环境都恢复到原来的状态而未留下任何永久性的变化,则该过程称为热力学可逆过程。
否则为不可逆过程特征:①状态变化时推动力与阻力相差无限小,体系与环境始终无限接近于平衡态;②过程中的任何一个中间态都可以从正、逆两个方向到达;③体系变化一个循环后,体系和环境均恢复原态,变化过程中无任何耗散效应;④等温可逆过程中,体系对环境作最大功,环境对体系作最小功。