western blot操作技巧及常见问题分析
- 格式:pdf
- 大小:368.58 KB
- 文档页数:6

免疫细胞研究western blotWestern Blot常见问题及处理总结阿木1、western blot 的优点答:灵敏,可达ng级,用Ecl显色法理论上可达pg 级。
方便,特异性高。
2、为什么我的细胞提取液中没有目标蛋白?答:原因有很多: a) 你的细胞中不表达这种蛋白质,换一种细胞;b) 你的细胞中的蛋白质被降解掉了,你必需加入PMSF,抑制蛋白酶活性;c) 你的抗体不能识别目标蛋白,多看看说明,看是否有问题。
3、我的细胞提取液有的有沉淀,有的很清亮,为什么呢?答:a) 有沉淀可能因为你的蛋白没有变性完全,可以适当提高SDS 浓度,同时将样品煮沸时间延长,b) 也不排除你的抗原浓度过高,这时再加入适量上样缓冲液即可。
4、我做的蛋白质分子量很小(10KD),请问怎么做WB?答:可以选择0.2μml的膜,同时缩短转移时间。
也可以将两张膜叠在一起,再转移。
其他按步骤即可。
5、我的目的带很弱,怎么加强?答:可以加大抗原上样量。
这是最主要的。
同时也可以将一抗稀释比例降低。
6、胶片背景很脏,有什么解决方法?答:减少抗原上样量,降低一抗浓度,改变一抗孵育时间,提高牛奶浓度。
7、目标带是空白,周围有背景,是为什么?答:你的一抗浓度较高,二抗上HRP 催化活力太强,同时你的显色底物处于一个临界点,反应时间不长,将周围底物催化完,形成了空白即“反亮现象”。
将一抗和二抗浓度降低,或更换新底物。
8、我的胶片是一片空白,是怎么回事?答:如果能够排除下面的几个问题那么问题多半出现在一抗和抗原制备上。
a) 二抗的HRP 活性太强,将底物消耗光;b) ECM底物中H2O2,不稳定,失活;c) ECL底物没覆盖到相应位置;d) 二抗失活。
9、我在显影液中显影1分钟和5分钟后,底片漆黑一片,是什么原因呢?答:a) 可能是红灯造成的, 胶片本来就被曝光了,可以在完全黑暗的情况下操作.看是否有改善.;b) 显影时间过长。
10、DAB好还是ECM好?答:DAB 有毒,但是比较灵敏,是HRP 最敏感的底物;ECM结果容易控制,但被催化时灵敏度差一点,但如果达到阀值,就特别灵敏,可以检测pg 级抗原。

WesternBlot最全攻略:从protocol到问题解决蛋白免疫印迹(western blotting)一般由凝胶电泳、样品的印迹和免疫学检测3个部分组成,是根据抗原抗体特异性结合检测样本中某种蛋白的方法,与ELISA不同的地方在于WB是一种半定量的检测方法。
操作流程如下:下面详细介绍一下每个操作步骤:一、样本的制备(1)样本一般是组织和细胞,根据样本类型的不同,选择合适的裂解液:样本类型裂解液全细胞NP-40、RIPA细胞质(可溶性)Tris-HCl细胞质(细胞骨架)Tris-Triton膜结合部分NP-40、RIPA细胞核RIPA、核裂解液线粒体RIPA(2)抑制剂,根据研究的目的蛋白进行选择,假如要检测磷酸化的蛋白含量,就要对磷酸酶进行抑制,现在很多公司都有多种抑制剂的混合物抑制剂靶点浓度2μg/ml抑肽酶胰蛋白酶、血纤维蛋白溶酶亮抑酶肽溶酶体1-10μg/ml胃蛋白酶抑制剂A Asp蛋白酶1μg/mlPMSF Asp蛋白酶1mMEDTA 镁和锰金属蛋白酶1-5mMEGTA 钙金属蛋白酶1mM氟化钠丝氨酸和苏氨酸磷酸酶5-10mM原钒酸盐酪氨酸磷酸酶1mM焦磷酸盐丝氨酸和苏氨酸磷酸酶1-2mMβ-甘油磷酸盐丝氨酸和苏氨酸磷酸酶1-2mM(3)要加入loading buffer(BME、DTT,目的是减少蛋白高级结构的形成)主要成分主要功能SDS 使蛋白变性并带上负电荷BME或DTT 减少二硫键的形成溴酚蓝离子型染料,可观察蛋白迁移甘油增加样品密度,起沉降作用(4)煮沸变性:一般是99°C,10min,水浴锅煮沸时,防止EP 管盖弹开,使水浴锅内的水进入。
二、凝胶电泳(1)配胶。
这里说的都是SDS变性胶,先配分离胶,再配浓缩胶。
根据目标蛋白分子量的大小,选择合适的分离胶浓度,分子量越高,分离胶的浓度越低。
浓缩胶一般用的都是5%。
配胶时需注意以下几点:①玻璃板清洗后,为了使表面的水快速晾干,可以在烘箱中放置几分钟,拿出来的时候一定要晾到室温再灌胶,不然很容易产生气泡;②配胶用的试剂一般都是在4度冰箱保存,当我们按比例配好混合液的时候,要等混合液恢复室温时,再灌胶,不然也很容易产生气泡;③加水液封时,速度要慢,可用1ml枪沿着胶板上沿反复移动,不然很容易将分离胶冲变型。

WesternBlot(WB)操作中需要注意事项与结果不理想可能的原因自查Western Blot(WB)操作中需要注意事项与结果不理想可能的原因自查第一部分 WB操作中需要注意事项一、蛋白样品的准备1、样品质量所抽取样品的蛋白含量,蛋白变性是否充分等等,还有,蛋白样品的PH值是否在7~8之间。
这会直接影响到样品浓缩的效果。
此外,蛋白样品是否降解、目的蛋白是否已抽取充分都会对最终结果的可靠性有影响。
2、细胞水平要做WB,多少细胞提的蛋白够做WB一般5×106就足够3、小分子量蛋白10KD需要的注意点1)可选择孔径0.22um的PVDF膜或者NC膜,转膜时间缩短,另外可采用Tricine-SDS-PAGE 体系2)也可以选择PSQ膜,同时缩短转移时间。
也可以将两张膜叠在一起,再转移。
其他按步骤即可4、大分子量蛋白200KD需要的注意点1)做200kd蛋白的WB时要注意,分离胶最好选择>7%的;剥胶时要小心2)转移时间需要相应延长;要做分子量参照(否则出现杂带不知道如何分析)3)转膜液中甲醇含量可适当降低,推荐使用湿装转膜效率更高二、制胶1、凝胶质量不连续SDS-PAGE胶对凝胶的要求较高,分离胶的PH值应在8.8左右,而浓缩胶的PH应在6.8左右,最好不要差过0.5个PH单位,因为这个PH条件是保证电泳液中的甘氨酸不电离的必要条件,也是保证能充分压缩样品的前提。
因此,制备凝胶的时候所用Tris-HCl缓冲液的PH值是否稳定是很重要的。
2、在用ddH2O压分离胶的时候为什么经常存在中间凸的现象1)加水时不能对着胶冲,要沿着玻璃板缓慢流行2)加水满后一定要保证上方水平面是平齐的3)加胶要避免气泡,也要避免加胶太慢而提前凝固等现象4)有其他人的经验是用异丙醇封胶封胶后左右晃一下三、加样1、点样样品尽量不要与电泳液混合,这样能提高浓缩的效果,因为电泳液PH值为8.3,而样品为7.5,混合后会影响到样品的PH值,进而影响浓缩效果。




western blot技术的原理方法注意事项一、原理Westernblot是一种常用的蛋白质检测技术,其基本原理是蛋白质的印迹技术,即把蛋白质从复杂的样品中分离出来,并转移到固相支持物上,再与特异性抗体结合,通过显色或电子显微镜观察鉴定蛋白质的表达和分布情况。
二、方法1.样品处理:首先,需要将蛋白质样品进行提取、分离和纯化。
根据样品性质,可以采用不同的提取方法,如细胞裂解液、组织匀浆液等。
2.凝胶电泳:将分离纯化的蛋白质样品转移到分离胶中,通过电泳将不同分子量的蛋白质分离。
3.免疫反应:将膜上的蛋白质与特异性抗体结合,形成抗原-抗体复合物。
4.显色反应:通过化学反应,使抗原-抗体复合物显色,便于观察和拍照。
5.电子显微镜观察:对于较小的样品,可以采用电子显微镜对蛋白质进行观察和定量分析。
三、注意事项1.样品处理:提取的蛋白质样品应尽可能保持完整性和纯度,避免在提取、分离和转移过程中发生变性或降解。
2.凝胶电泳:分离胶的选择应根据待测蛋白质的分子量大小进行,以确保蛋白质能够完全分离。
同时,应注意电泳过程中的电压、电流和时间等参数,避免过度电泳导致蛋白质失活或降解。
3.免疫反应:应注意抗体滴度的选择,确保抗体能够充分识别目标蛋白质。
同时,应避免使用过期或质量不佳的抗体。
4.显色反应:应注意显色试剂盒的质量和操作步骤,确保显色反应充分且颜色易于观察。
同时,应注意显色颜色的稳定性,避免因颜色不稳定影响结果判断。
5.电子显微镜观察:应注意电子显微镜的操作步骤和设备维护,确保电子显微镜能够正确成像。
同时,应注意样品的制备和处理,确保样品能够被电子显微镜准确观察。
6.实验条件:实验过程中应注意调整实验条件,如孵育时间、洗膜次数、抗体稀释度等,以确保实验结果的准确性和可靠性。
7.重复性:在进行Westernblot实验时,应注意重复性实验的开展,以减少实验误差和提高实验结果的可靠性。
总之,Westernblot技术虽然复杂,但只要掌握了其原理和方法,并注意以上注意事项,就能够获得准确可靠的结果。



Western Blot详解Western免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测。
对已知表达蛋白,可用相应抗体作为一抗进行检测,对新基因的表达产物,可通过融合部分的抗体检测。
该文主要通过以下几个方面来详细地介绍一下W e stern Blot技术。
Conten ts:(1)原理(2)分类i. 放射自显影ii. 底物化学发光ECLiii. 底物荧光EC Fiv. 底物DAB呈色(3)主要试剂(4)主要程序(5)实验常见的问题指南1. 参考书推荐2. 针对样品的常见问题3. 抗体4. 滤纸、胶和膜的问题5. Marker的相关疑问6. 染色的选择7. 参照的疑问8. 缓冲液配方的常见问题9. 条件的摸索10. 方法的介绍11. 结果分析(1)原理与South ern或N o rthe rn杂交方法类似,但Weste rn Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。
经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
该技术也广泛应用于检测蛋白水平的表达。
(2)分类wester n显色的方法主要有以下几种:i. 放射自显影ii. 底物化学发光ECLiii. 底物荧光EC Fiv. 底物DAB呈色现常用的有底物化学发光ECL和底物DAB呈色,体同水平和实验条件的是用第一种方法,目前发表文章通常是用底物化学发光ECL。
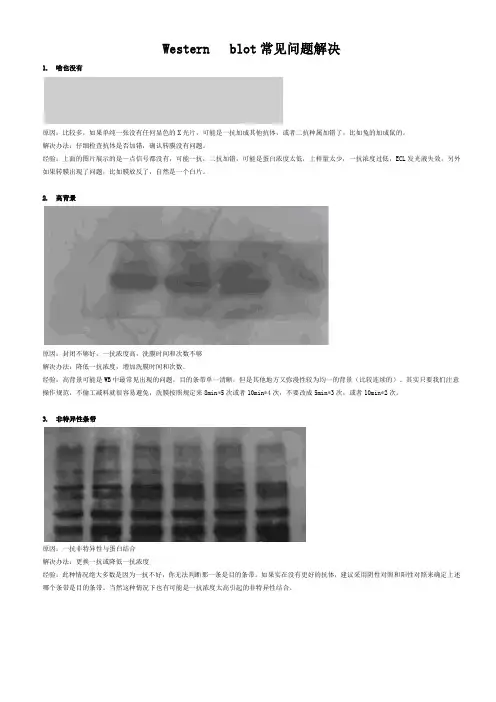
Western blot常见问题解决1. 啥也没有原因:比较多,如果单纯一张没有任何显色的X光片,可能是一抗加成其他抗体,或者二抗种属加错了,比如兔的加成鼠的。
解决办法:仔细检查抗体是否加错,确认转膜没有问题。
经验:上面的图片展示的是一点信号都没有,可能一抗,二抗加错,可能是蛋白浓度太低,上样量太少,一抗浓度过低,ECL发光液失效。
另外如果转膜出现了问题,比如膜放反了,自然是一个白片。
2. 高背景原因:封闭不够好,一抗浓度高,洗膜时间和次数不够解决办法:降低一抗浓度,增加洗膜时间和次数。
经验:高背景可能是WB中最常见出现的问题,目的条带单一清晰,但是其他地方又弥漫性较为均一的背景(比较连续的)。
其实只要我们注意操作规范,不偷工减料就很容易避免,洗膜按照规定来8min*5次或者10min*4次,不要改成5min*3次,或者10min*2次。
3. 非特异性条带原因:一抗非特异性与蛋白结合解决办法:更换一抗或降低一抗浓度经验:此种情况绝大多数是因为一抗不好,你无法判断那一条是目的条带。
如果实在没有更好的抗体,建议采用阴性对照和阳性对照来确定上述哪个条带是目的条带。
当然这种情况下也有可能是一抗浓度太高引起的非特异性结合。
4. 条带中出现边缘规则的白圈原因:电转中膜和胶之间存在气泡。
解决办法:转膜前去掉膜和胶之间的气泡经验:我们常常将电转液倒入一个盘子里,倒入的液体不能太多也不能太少,最好的高度是与放上第一层滤纸齐平,然后往滤纸上浇点转膜液,把电泳胶用清水清洗下,将电泳胶平铺到滤纸上,仔细检查滤纸与胶之间是否有气泡,可以左右前后观察,不同方向观察之后确认无气泡,然后再往胶上面浇点电转液,用两只手的拇指和食指轻轻夹住PVDF膜的两侧,使膜成U型,然后将U型的底部接触胶的中间,慢慢往两边放下膜,这样一般气泡很少。
然后上层滤纸同样用U型的放置方法,用玻璃棒稍微贴实下,然后盖上海绵。
注意不要来回赶气泡,这样反而会带入气泡。
Western Blot(蛋白质印迹)技术是生物医学研究中常用的蛋白质分析技术之一,可以用于检测蛋白质样品中的特定抗原。
然而,在进行Western Blot实验时,可能会遇到一些问题,下面列举了一些常见问题及解决方法:1.电泳条带不清晰或无条带:解决方法:•检查样品质量,确保待检测样品是可用的,无降解或污染。
•调整电泳参数,如电压、电流和时间等,以优化电泳效果。
•更换抗体,确认抗体的特异性,避免非特异性结合。
2.膜上背景过重:解决方法:•在抗体孵育之前,使用封闭剂封闭膜上的非特异性位点,减少抗体非特异性结合。
•减少一抗和二抗的浓度,减轻非特异性结合。
•增加洗涤次数和时间,以清除未结合的抗体和蛋白质。
3.目的蛋白信号弱或无:解决方法:•调整一抗和二抗的浓度,提高特异性结合的信号强度。
•选择更灵敏的显色方法,如化学发光法等。
•在转膜前,优化样品处理,如提取、纯化和浓缩等步骤。
4.非特异性条带:解决方法:•检查抗体特异性,确认抗体的特异性,更换抗体以减少非特异性结合。
•检查样品处理步骤,避免样品中的杂蛋白干扰。
•增加洗涤次数和时间,以清除未结合的抗体和非特异性结合的蛋白质。
5.显影后膜上条带处变为黄色或白色:解决方法:•可能是由于曝光时间过长或显影液浓度过高导致的,可以降低曝光时间和减少显影液浓度来解决问题。
•在膜清洗时使用甲醇或乙醇等有机溶剂,清除膜上的多余抗体和显色剂。
6.条带内无显影的白点:解决方法:•在转膜前检查是否存在气泡,气泡会影响转膜效果和条带形成。
•增加转膜时间和电流,以促进蛋白质的转移。
•检查显影液是否过期或存在质量问题。
7.存在散在小圆斑:解决方法:•这可能是由于封闭液中的杂质颗粒导致的,可以通过过滤封闭液来清除杂质。
•检查一抗和二抗是否含有杂质抗体或存在抗体污染的情况,更换抗体可以解决问题。
•检查显色液是否存在问题,如过期或存在杂质等,更换显色液可以解决问题。
8.条带变形或不均匀:解决方法:•检查电泳胶的质量和制备过程是否存在问题。
westernblot实验步骤中常见问题和处理方法Western blot 结果中背景较高 (high background):膜封闭不够/封闭液(blocking buffer)不适合:延长封闭时间,增加封闭液的浓度;尝试不同种类的封闭液,对比结果后选出效果最佳的。
洗膜不够彻底:增长洗涤时间;增加洗涤剂的浓度。
一抗/二抗(primary/secondary antibodies) 稀释度不适宜:对抗体进行滴度测试(titre test),选择最适宜的抗体稀释度。
一抗是多克隆抗体 (polyclonal antibody): 特异性降低,可能与其他蛋白结合,建议换用单克隆抗体(monoclonal antibody)。
膜在实验过程中干过: 实验过程中要切记保持膜的湿润。
检测时曝光时间过长: 减少曝光时间。
Western blot 结果中杂带较多 (multiple/non-specific bands):目的蛋白有多个修饰位点(磷酸化位点(phosphorylation site)、糖基化位点(glycosylation site)、乙酰化位点(acetylation site) 等),本身可以呈现多条带。
样本处理过程中目的蛋白发生降解(protein degradation): 加入蛋白酶抑制剂 (protease inhibitor);样本处理时在冰上操作; 避免/减少样本的冻融循环(free-and-thaw cycle)。
样本处理过程中目的蛋白发生聚集(protein aggregation):增加DTT的浓度;增长加热的时间。
上样量(sample loading)/ 样本浓度过高:适当减少上样量/样本浓度。
一抗是多克隆抗体 (polyclonal antibody): 特异性降低,可能与其他蛋白结合,建议换用单克隆抗体(monoclonal antibody)。
一抗/二抗不纯:纯化抗体;购买高纯度抗体。
关于western blot原理和常见故障分析关于western blot原理:通过电泳区分不同的组分,并转移至固相支持物,通过特异性试剂(抗体作为探针,对靶物质进行检测,蛋白质的Western印迹技术结合了凝胶电泳的高分辨率和固相免疫测定的特异敏感等多种特点,可检测到低至1~5ng(最低可到10-100pg中等大小的靶蛋白。
一、抗原的选择和制备A:样品的制备1组织:组织的处理方法:组织洗涤后加入3倍体积预冷的PBS,0℃研磨,加入5×STOP buffer,180W,6mins,0℃超声波破碎,5000rpm,5mins离心,取上清。
加入β-ME(9.5ml加入0.5ml,溴酚蓝(9.5ml加入0.5ml煮沸10min,分装后于-20℃保存,用时取出,直接溶解上样。
2细胞:细胞的处理方法:离心收集细胞或者直接往细胞培养瓶内加入5×STOP buffer,收集,180W,6mins,0℃超声波破碎,5000rpm,5mins离心,取上清。
加入β-ME(9.5ml 加入0.5ml,溴酚蓝(9.5ml加入0.5ml煮沸10min,分装后于-20℃保存,用时取出,直接溶解上样。
3分泌蛋白的提取(特例:直接收集分泌液,加入β-ME、溴酚蓝制样。
B:蛋白的定量方法及影响蛋白定量原因1.双缩脲法:双缩脲法是第一个用比色法测定蛋白质浓度的方法。
在需要快速,但不很准确的测定中,常用此法。
硫铵不干扰显色,这对蛋白质提纯的早期阶段是非常有利的。
双缩脲法的原理是Cu2+与蛋白质的肽键,以及酪氨酸残基络合,形成紫蓝色络合物,此物在540nm波长处有最大吸收。
双缩脲法常用于0.5g/L~10g/L含量的蛋白质溶液测定。
干扰物有硫醇,以及具有肽性质缓冲液,如Tris、Good缓冲液等。
可用沉淀法除去干扰物,即用等体积10%冷的三氯醋酸沉淀蛋白质,然后弃去上清液,再用已知体积的1m NaOH溶解沉淀的蛋白质进行定量测定。
根据笔者多年实际操作经验,介绍了wb实验概念和步骤,最后归纳总结了wb 实验常见问题以及解决方法,希望对您的科研提供一些帮助。
1. 什么是western blot?答:WB又称免疫印记法.是将生物大分子物质通过不同途径转移到固相载体的过程。
2. western blot 有什么优点?答:灵敏,可达ng级,用Ecl显色法理论上可达pg 级。
方便,特异性高。
3. western blot 的具体步骤是什么?一. 制样(以提动物组织总蛋白为例),1)组织洗涤后加入3 倍体积PBS,0℃研磨。
2)加入5×STOP buffer3)180W, 6mins,0℃超声波破碎4)5000rpm,5mins 离心,取上清。
5)加入REB(9.5ml加入0.5ml),溴酚蓝(9.5ml加入0.5ml)6)煮沸,10min7)分装,于-20℃保存,用时取出,直接溶解上样。
二.电泳(SDS-PAGE)建议欲检测抗原10-30kd, 用15%胶;30-100kd, 用10%胶;100-200kd,用7.5 %胶。
1)配胶(one piece)A.分离胶。
单位:ml。
Total: 8ml 7.5%10%15%2×Sep. buffer 4 4 430%Gel.sol 2.0 2.7 4ddH2O 1.9 1.2 0TEMED 8ul 8ul 8ul10%APS 80ul 80ul 80ulB. 浓缩胶。
单位:ml。
Total: 3.5ml 3%2×Stacking. buffer 1.730%Gel.sol 0.35ddH2O 1.4TEMED 5ul10%APS 50ul2)点样。
上样蛋白量不应超过30ug/mm2. (载荷面即:如果你的胶槽是5mm×1mm, 则载荷面为:1mm×5mm=5mm2),3)电泳。
开始用80V电压,但是当溴酚蓝至分离胶时,用100-120V电压。
Western Blot 操作技巧及常见问题分析
汉恒生物提供病毒包装服务
你的Western Blot结果是否出现过非特异性条带?条带变窄变宽了?条带哭了条带笑了?信号太弱了?等情况,所以现在需要提升一下你的Western Blot结果的颜值了!
如何使电泳条带漂亮些?
电泳注意事项
●为减少小蛋白条带的扩散,上样后应尽快开始电泳
●如用预染Marker,当要分辨的蛋白到达最佳分辨区——分离胶的2/3处,结束电泳
●电泳用恒压模式能保持蛋白质恒定的电泳迁移率,而电压先低后高可使样品更好的进入凝胶。
实际电压可根据时间安排调节,电压高时电泳发热大,电压低于50V时小蛋白容易弥散,凝胶分辨率会下降。
影响跑胶的质量,有以下因素:
●胶的均匀度,胶越均匀,条带越窄,分离越均匀。
倒胶之前,一定要充分混匀,玻璃板一定要干净,水或饱和正丁醇隔离时,一定要比较轻地加上去,避免稀释下层的分离胶,使胶不均匀。
●聚丙烯酰胺的充分聚合,可提高凝胶的分辨率。
建议做法:待凝胶在室温凝固后,可在室温下放置一段时间使用。
●电压,小的电压会使胶的分子筛效应得到充分发挥。
电压越小,条带越漂亮,浓缩胶80v,分离胶100v就能跑得很好。
●样品,在加样前离心,增加一些增溶辅助试剂如尿素,可以克服由于样品溶解不佳引起的
纹理和拖尾现象。
●减少上样量可以避免由于加样量太多引起蛋白带过宽或与邻近泳道的蛋白带相连。
WB常见问题分析
高背景
原因解决办法
蛋白浓度过高降低抗体浓度
膜的污染
使用干净镊子;戴手套操作;换一张新膜用足够的液体,膜始终保持湿
润;孵育时使用脱色摇床;避免膜重叠,互相覆盖;小心操作,勿毁损
膜
漂洗不完全增加漂洗时间和缓冲液体积
封闭液不适合比较尝试不同封闭液
封闭不完全延长封闭时间(可4℃过夜)
抗体浓度过高优化降低一抗、二抗浓度
曝光时间过长缩短曝光时间
缓冲液污染使用新配制缓冲液
信号弱或无信号
原因解决办法
抗原量不足增加上样量,使用阳性对照;减少漂洗,可将TBST改为TBS
蛋白质在储存过程中
降解
重新制备样品
转膜不完全
转膜后确定转膜效率、保证胶与膜充分结合、保证电极正确装配、
控制转膜温度(冰袋降温)、优化转膜电流及时间。
膜的错误选择选择合适膜的孔径:
>22kD 蛋白选用 0.45μm孔径<22kD 蛋白选用0.22μm孔径
抗原被封闭液遮蔽优化封闭液、缩短封闭时间、减小封闭液中蛋白浓度。
抗体增加抗体浓度、注意抗体储存条件(避免反复冻融)。
曝光时间过短延长曝光时间
底物延长底物孵育时间
非特异性条带
原因解决办法
底物太灵敏选择合适的底物
交叉反应选择单克隆抗体
抗原浓度太高降低抗原浓度
抗体浓度太高降低抗体浓度
曝光时间太长减少曝光时间
其他
现象原因解决办法
二抗浓度太高降低二抗浓度
荧光萃灭快
膜干燥保证膜的湿润度
条带内出现不显影圆点转膜过程中有气泡转膜时赶尽气泡
条带不完整底物孵育不均匀用保鲜膜均与孵育底物
反影(白色条带、黑色
HRP浓度过高降低二抗浓度
背景)
散在小圆斑封闭液有杂质颗粒静置牛奶使大颗粒沉淀
● 条带出现微笑的上扬形状,表示胶没有混匀或者电泳时散热不均匀,电压过高,缓冲液浓度过高。
● 垂直条纹,表示上样量过多或者样品有沉淀。
● 条带变窄,说明盐浓度过高,需脱盐; 凝胶不均匀,梳子没拔好。
● 条带变宽,说明电泳前样品扩散,故加样操作要快。
● 两个条带,说明蛋白没有完全还原,或又重新氧化,需配置新鲜缓冲液。