精品高中化学选修三晶胞参数计算
- 格式:doc
- 大小:101.00 KB
- 文档页数:3


第1页共6页晶胞计算晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。
晶体结 构的计算常常涉及如下数据:晶体密度、 N A 、M 、晶体体积、微粒间距离、微粒半径、夹角等,密度 的表达式往往是列等式的依据。
解决这类题,一是要掌握晶体 均摊法”的原理,二是要有扎实的立体 几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
有关晶胞各物理量的关系:1、晶胞质量二晶胞占有的微粒的质量二晶胞占有的微粒数X NM A 02、空间利用率二对角线长= 2a o ⑵体对角线长=,3a o ⑶体心立方堆积4r = 3a (r 为原子半径)。
⑷面心立方堆积4r = .2a (r 为原子半径)。
对于立方晶胞,可简化成下面的公式进行各物理量的计算:a 3Xp>N A = n XM , a 表示晶胞的棱长,p 表示密度,N A 表示阿伏加德罗常数的值,n 表示1 mol 晶胞中所含晶体的物质 的量,M 表示摩尔质量,a 3XpX N A 表示1 mol 晶胞的质量。
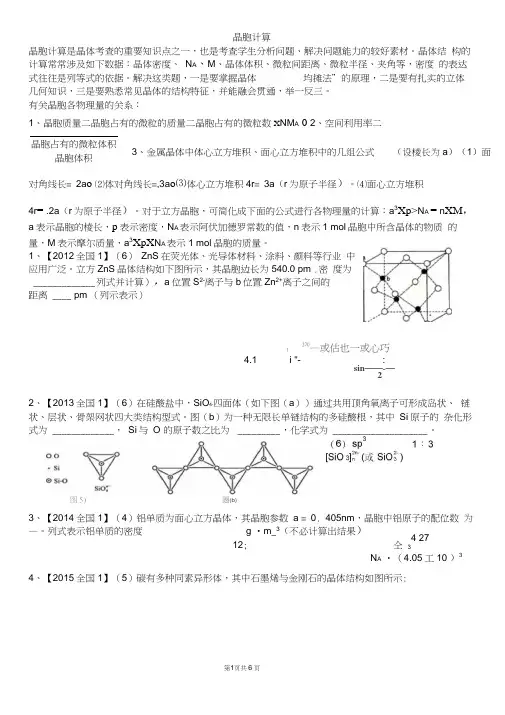
1、【2012全国1】(6) ZnS 在荧光体、光导体材料、涂料、颜料等行业 中应用广泛。
立方ZnS 晶体结构如下图所示,其晶胞边长为540.0 pm .密 度为 _____________ 列式并计算),a 位置S 2-离子与b 位置Zn 2+离子之间的 距离 ____ pm (列示表示)f270—或估也一或心巧4.1 i "- :sin ——-—22、【2013全国1】(6)在硅酸盐中,SiO 4-四面体(如下图(a ))通过共用顶角氧离子可形成岛状、 链状、层状、骨架网状四大类结构型式。
图(b )为一种无限长单链结构的多硅酸根,其中 Si 原子的 杂化形式为 _____________ , Si 与 O 的原子数之比为 _________ ,化学式为 ____________________ 。

高中化学选修三晶胞的计算总结!新课标Ⅰ、Ⅱ、Ⅲ卷、海南等地的高考真题中有一道选作题为选修3·物质结构与性质内容,分值约为15分,其中最后一问一般考查晶胞的相关计算,这部分内容很难,很多同学对此不知如何下手,甚至放弃,但只要掌握技巧,此问题就能迎刃而解,今天小编为大家进行了总结。
1、要清楚几个基本的计算公式:2、能用均摊法计算出晶胞中每种原子的个数。
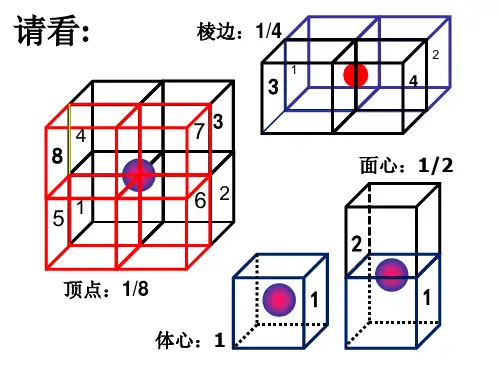
方法如下:(1)顶点上的原子,被8个晶体所共用,对每一个晶体只提供1/8(2)棱边上的原子,被4个晶体所共用,对每一个晶体只提供1/4(3)面心上的原子,被2个晶体所共用,对每一个晶体只提供1/2(4)体心上的原子,被1个晶体所共用,对每一个晶体只提供1栗子:如下图,是某晶体最小的结构单元,试写出其化学式。
根据均摊法,得出:化学式为xy3z。
3、得出晶胞中所含有的原子的个数。
4、根据题目要求,结合以上三点,计算所求的量如密度、空间利用率、晶胞参数等。
【好题演练】1(选自2016·新课标Ⅱ)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm.答案【解析】铜失去的是全充满的3d10电子,镍失去的是4s1电子,所以ICu>INi。
(4)①根据均摊法计算,晶胞中铜原子个数为6×1/2=3,镍原子的个数为8×1/8=1,则铜和镍的数量比为3:1。
②根据上述分析,该晶胞的组成为Cu3Ni,若合金的密度为dg/cm3,根据p=m÷V,则晶胞参数a=nm。
【考点】晶胞的计算。
2(选自2016·新课标Ⅲ)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
回答问题:GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。
该晶体的类型为________________,Ga与As以________键键合。

*晶胞参数的计算1. 均摊法确定晶体的化学式给出晶体的—部分(称为晶胞)的图形,要求确定晶体的化学式:通常采用均摊法.均摊法有如下规则,以NaCl的晶胞为例:①处于顶点的粒子,同时为8个晶胞所共有,所以,每个粒子只分摊1/8给该晶胞.②处于棱上的粒子,同时为4个晶胞所共有,所以,每个粒子只分摊1/4给该晶胞.③处于面上的粒子,同时为2个晶胞所共有,所以,每个粒子只分摊1/2给该晶胞.④处于晶胞内部的粒子,则完全属于该晶胞.\由此算出在NaCl的晶胞中:含数:含数:故NaCl晶体中,和数目之比为1∶1.2. 晶胞参数的计算根据(1)ρ= m/V(2)V=a【例.(1)化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。
某氧化镍样品组成,试计算该晶体中Ni3+与Ni2+的离子个数之比。
[练习]#1. 由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)两种。
在此晶体中,过氧离子和超氧离子的物质的量之比为-)和超氧离子(O2A. 2︰1B. 1︰1C. 1︰2D. 1︰32.食盐晶体如右图所示。
在晶体中,表示Na+,表示Cl。
已知食盐的密度为g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl的间距大约是A cmB cmA cm D cm3.某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为 ( );A.1:3:1 B.2:3:1C.2:2:1 D.1:3:34. 如右图所示,是一种晶体的晶胞,该离子晶体的化学式为()A.ABC B.ABC3 C.AB2C3 D.AB3C35.晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。

晶胞参数计算公式晶胞参数是材料表征的重要参数,因而晶胞参数的计算十分重要。
本文针对晶胞参数的计算,详细介绍了晶胞参数计算公式中的一些重要概念及计算方法。
首先,晶胞参数是描述物质电学性质的概念,包括晶胞体积、晶胞定律、晶格常数和晶体结构等。
其中晶胞体积指:物质经过特定初始条件下晶胞构型变化后占用的总空间,是两个基本晶胞参数。
晶胞定律指:晶胞的长、宽、高之间的关系,是一种结构参数的表示。
晶格常数指:两个原子之间的距离,是一种晶胞结构参数的表示。
晶体结构是指:物质中原子构成的定向三维晶体结构。
晶胞参数计算公式包括晶胞参数计算公式和晶格常数计算公式。
晶胞参数计算公式用于计算晶胞体积,晶胞定律及晶体结构,主要有两种计算方法:一种是基于原子坐标的公式,如Bravais(1848)公式、Voronoi(1908)公式和Ginzburg-Landau(1950)公式;另一种是基于晶胞参数的公式,如Hilbert(1912)公式、Madelung(1925)公式和Ladd(1977)公式。
晶格常数计算公式用于计算晶格参数,主要有两种计算方法:一种是基本元素计算法,如Weaire(1892)公式和Morse(1931)公式;另一种是分子力学计算法,如Lennard-Jones(1938)公式和Stillinger-Weber(1985)公式。
现代晶体学通过实验测量元素晶体中原子间距离,利用晶胞参数和晶格常数计算公式,可以准确地确定晶体结构,进而研究物质的物理性质,为应用物理学的发展作出贡献。
在电子结构的计算中,也使用晶胞参数和晶格常数计算公式,分析不同晶体结构的能带结构和电子电荷密度等。
因此,晶胞参数计算公式和晶格常数计算公式是材料表征的重要工具,它们是物理化学所不可缺少的技术手段,极大地提高了研究物质性质的精度。
无论是在材料物理研究中,还是在电子结构计算中,晶胞参数计算公式和晶格常数计算公式都是物理学家必备的技术工具,必将对物理研究和应用物理学的发展产生重要作用。

晶胞计算晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。
晶体结构的计算常常涉及如下数据:晶体密度、N A 、M 、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。
解决这类题,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
有关晶胞各物理量的关系:1、晶胞质量=晶胞占有的微粒的质量=晶胞占有的微粒数×MN A 。
2、空间利用率=晶胞占有的微粒体积晶胞体积。
3、金属晶体中体心立方堆积、面心立方堆积中的几组公式(设棱长为a )(1)面对角线长=2a 。
(2)体对角线长=3a 。
(3)体心立方堆积4r =3a (r 为原子半径)。
(4)面心立方堆积4r =2a (r 为原子半径)。
对于立方晶胞,可简化成下面的公式进行各物理量的计算:a 3×ρ×N A =n ×M ,a 表示晶胞的棱长,ρ表示密度,N A 表示阿伏加德罗常数的值,n 表示1 mol 晶胞中所含晶体的物质的量,M 表示摩尔质量,a 3×ρ×N A 表示1 mol 晶胞的质量。
1、【2012全国1】(6)ZnS 在荧光体、光导体材料、涂料、颜料等行业中应用广泛。
立方ZnS 晶体结构如下图所示,其晶胞边长为540.0 pm .密度为 (列式并计算),a 位置S 2-离子与b 位置Zn 2+离子之间的距离 pm (列示表示)44.1 2、【2013全国1】(6)在硅酸盐中,SiO 4- 4四面体(如下图(a ))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。
图(b )为一种无限长单链结构的多硅酸根,其中Si 原子的杂化形式为 ,Si 与O 的原子数之比为 ,化学式为 。
(6)sp 3 1∶3[SiO 3]2n- n (或SiO 2-3)3、【2014全国1】(4)铝单质为面心立方晶体,其晶胞参数a =0.405nm ,晶胞中铝原子的配位数为 。

二轮60练经典@59晶胞结构分析和密度等相关计算学生版【解题技能】1.晶胞结构的分析(1)判断某种微粒周围等距且紧邻的微粒数目时,要注意运用三维想象法。
如NaCl晶体中,Na+周围的Na+数目(Na+用“○”表示):每个面上有4个,共计12个。
(2)记住常见晶体如干冰、冰、金刚石、SiO2、石墨、CsCl、NaCl、K、Cu等的空间结构及结构特点。
当题中信息给出的某种晶胞空间结构与常见晶胞的空间结构相同时,可以直接套用该种结构。
2.晶胞中微粒数目的计算方法——均摊法长方体(包括立方体)晶胞中不同位置的粒子数的计算方法如图所示:3.计算化学式4.晶胞中微粒配位数的确定方法如:NaCl的晶胞模型如图,Na+配位数为6,Cl-配位数为6金属Po为简单立方堆积,Po的配位数为6金属Na、K、Fe为体心立方堆积,配位数为85.晶体密度的计算步骤[第一步]根据“均摊法”计算出每个晶胞实际含有各一类原子的个数,确定物质的化学式,计算出晶胞的质量[第二步]计算晶胞的体积[第三步]依据ρ=mV计算【考题探究】角度一:晶胞中微粒数目及晶体化学式的计算1.[2020全国Ⅰ]LiFePO4的晶胞结构示意图如(a)所示。
其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
每个晶胞中含有LiFePO4的单元数有____个。
电池充电时,LiFeO4脱出部分Li+,形成Li1−x FePO4,结构示意图如(b)所示,则x=_______,n(Fe2+)∶n(Fe3+)=_______。
2.(2019·全国卷Ⅱ)一种四方结构的超导化合物的晶胞如图1所示。
晶胞中Sm和As原子的投影位置如图2所示。
图1图2图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为________。
3.(2019·海南高考)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为________。


2025年高考化学一轮复习基础知识讲义—晶胞参数计算(新高考通用)【知识清单】 1、晶胞参数晶胞的形状和大小可以用6个参数来表示,包括晶胞的3组棱长a 、b 、c 和3组棱相互间的夹角α、β、γ,即晶格特征参数,简称晶胞参数。
2、晶体结构的相关计算(1)空间利用率=晶胞占有的微粒体积晶胞体积×100%。
(2)金属晶体中体心立方堆积、面心立方堆积中的几组计算公式(设棱长为a ) ①面对角线长=2a 。
①体对角线长=3a 。
①体心立方堆积4r =3a (r 为原子半径)。
①面心立方堆积4r =2a (r 为原子半径)。
(3)晶胞密度ρ=m V =NM∝VN A【题组练习一】1、[2020·全国卷①,35(4)]研究发现,氨硼烷NH 3BH 3在低温高压条件下为正交晶系结构,晶胞参数分别为a pm 、b pm 、c pm ,α=β=γ=90°。
氨硼烷的2×2×2超晶胞结构如图所示。
(N:14 H:1 B:11)氨硼烷晶体的密度ρ=________ g·cm -3(列出计算式,设N A 为阿伏加德罗常数的值)。
【答案】62N A abc ×10-30解析 由题意可知,晶胞的体积V (晶胞)=8abc ×10-30cm 3。
由晶胞结构可知,每个晶胞含有16个NH 3BH 3分子,则每个晶胞的质量m (晶胞)=16×31N A g ,氨硼烷晶体的密度ρ=m 晶胞V 晶胞=16×31N Ag 8abc ×10-30 cm 3=62N A abc ×10-30 g·cm-3。
2、[2020·天津,13(2)节选]CoO 的面心立方晶胞如图所示。
设阿伏加德罗常数的值为N A ,则CoO 晶体的密度为____________g·cm -3。
(O:16 Co:59)【答案】 3×1023N A ·a 3【解析】 由题给图示可知,O 2-位于顶点和面心,因此一个晶胞中含有O 2-的个数为8×18+6×12=4;Co 2+位于棱上和体心,因此一个晶胞中含有Co 2+的个数为12×14+1=4,即一个晶胞的质量为4×75N Ag ,一个晶胞的体积为(a ×10-7)3 cm 3,因此CoO 晶体的密度为3×1023N A ·a3g·cm -3。
高三选修3晶胞知识点晶胞是晶体中最小重复单元,它的形状和结构对于晶体性质的理解具有重要的作用。
在高三选修3中学习晶胞的知识点对于理解晶体结构和材料科学具有重要意义。
本文将从三个方面介绍高三选修3中的晶胞知识点。
第一部分:晶胞的定义和分类晶胞是晶体中最小重复单元,由原子或分子组成。
根据晶体的对称性,我们可以将晶胞分为7个晶系和14个晶格。
1. 立方晶系:晶胞为立方体,边长相等,相互垂直。
2. 正交晶系:晶胞为长方体,边长相互垂直,但不相等。
3. 单斜晶系:晶胞为斜方体,边长不相等,存在一个直角。
4. 斜方晶系:晶胞为斜方体,边长不相等,所有角均不为直角。
5. 三斜晶系:晶胞为斜四面体,边长不相等,所有角均不为直角。
6. 菱面晶系:晶胞为菱形面体,边长不相等,存在4个相邻的直角。
7. 六方晶系:晶胞为六面体,边长不相等,存在6个角为直角。
以上是根据晶体对称性所确定的晶胞分类,不同晶胞的形状和结构决定了晶体的不同性质和应用。
第二部分:晶胞参数及其计算方法晶体的晶胞参数是描述晶体结构的重要参数,包括晶胞长度、晶胞角度等。
1. 晶胞长度:晶胞的长度由晶格常数确定,晶格常数是指晶体沿不同方向上的原子、离子或分子排列的周期性重复距离。
2. 晶胞角度:晶胞的角度也由晶格常数决定,不同晶体的晶胞角度不同。
计算晶胞参数的方法包括使用X射线衍射、粉末衍射和电子衍射等实验方法,以及分子动力学模拟和第一性原理计算等理论方法。
这些方法可以精确确定晶体的晶胞结构,为材料科学的研究提供重要的依据。
第三部分:晶胞的应用和意义晶胞的形状和结构对晶体的性质和应用具有重要的影响。
1. 晶胞的形状决定了晶体的外观和结构,不同晶体的晶胞形状各异。
2. 晶胞的结构决定了晶体的物理和化学性质,如硬度、电导率、光学性质等。
3. 晶胞的研究为材料科学和固体物理学等领域提供了重要的基础,促进了材料的开发和应用。
总结:本文介绍了高三选修3中的晶胞知识点,包括晶胞的定义和分类、晶胞参数及其计算方法,以及晶胞的应用和意义。
晶胞参数的计算
1. 均摊法确定晶体的化学式
给出晶体的—部分(称为晶胞)的图形,要求确定晶体的化学式:通常采用均摊法.均摊法有如下规则,以NaCl的晶胞为例:
①处于顶点的粒子,同时为8个晶胞所共有,所以,每个粒子只分摊1/8给该晶胞.
②处于棱上的粒子,同时为4个晶胞所共有,所以,每个粒子只分摊1/4给该晶胞.
③处于面上的粒子,同时为2个晶胞所共有,所以,每个粒子只分摊1/2给该晶胞.
④处于晶胞内部的粒子,则完全属于该晶胞.
由此算出在NaCl的晶胞中:
含数:
含数:
故NaCl晶体中,和数目之比为1∶1.
2. 晶胞参数的计算
根据(1)ρ= m/V
(2)V=a3
例.(1)化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。
某氧化镍样品组成Ni0.97O,试计算该晶体中Ni3+与
Ni2+的离子个数之比。
[练习]
1. 由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。
在此晶体中,过氧离子和超氧离子的物质的量之比为()
A. 2︰1
B. 1︰1
C. 1︰2
D. 1︰3
2.食盐晶体如右图所示。
在晶体中,∙表示Na+,ο表示Cl-。
已知食盐的密度为ρ g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是
()
A.cm
B.cm
A.cm D.cm
3.某物质的晶体中,含A、B、C三种元素,其排列方式如右图所
示(其中前后两面心上的B原子不能画出),晶体中A、B、C的
原子个数比依次为( )
A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:
4. 如右图所示,是一种晶体的晶胞,该离子晶体的化学式为()
A.ABC B.ABC3 C.AB2C3 D.AB3C3
5.晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。
NaCl晶体结构如右图所示。
已知Fe x O晶体晶胞结构为NaCl型,由
于晶体缺陷,x值小于1。
测知Fe x O晶体密度为5.73 g/cm3,晶胞边长
为4.28×10-10m。
⑴Fe x O中x值(精确至0.01)为___________。
⑵晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小
数表示,精确至0.001)为___________。
⑶此晶体化学式为____________。
⑷与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何构型形状是__________。
⑸在晶体中,铁元素的离子间最短距离为__________m。
6.如图,直线交点处的圆圈为NaCl晶体中离子或离子所处的位置.这两种离子在空间3个互相垂直的方向上都是等距离排列的.
(1)请将其中代表离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图.
(2)晶体中,在每个离子的周围与它最接近的且距离相等的共有_________个.
(3)晶体中每一个重复的结构单元叫晶胞.在NaCl晶胞中正六面体的顶点上、面上、棱上的
或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-离子的个数等于_____________,即(填计算式)___________;离子的个数等于___________,即(填计算式)___________.(4)设NaCl的摩尔质量为,食盐晶体的密度为,阿伏加德罗常数为.食盐晶体中两个距离最近的钠离子中心间的距离为___________cm.。