高中化学选修三晶胞参数计算
- 格式:docx
- 大小:622.77 KB
- 文档页数:5


晶胞参数的计算1. 均摊法确定晶体的化学式给出晶体的—部分(称为晶胞)的图形,要求确定晶体的化学式:通常采用均摊法.均摊法有如下规则,以NaCl的晶胞为例:①处于顶点的粒子,同时为8个晶胞所共有,所以,每个粒子只分摊1/8给该晶胞.②处于棱上的粒子,同时为4个晶胞所共有,所以,每个粒子只分摊1/4给该晶胞.故NaCl晶体中,数目之比为例.(1)NaCl 相同,Ni)。
(2)一个Ni2+[练习]1. 由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。
在此晶体中,过氧离子和超氧离子的物质的量之比为??A. 2︰1B. 1︰1C. 1︰2D. 1︰32.食盐晶体如右图所示。
在晶体中,?表示Na+,?表示Cl?。
已知食盐的密度为? g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl?的间距大约是??A?cm B?cmA?cm D?cm3.某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( ):4.35NaCl为4.28×⑴Fe x O数6.如图,晶体中离子或(1)请将其中代表离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图.(2)晶体中,在每个离子的周围与它最接近的且距离相等的共有_________个.(3)晶体中每一个重复的结构单元叫晶胞.在NaCl晶胞中正六面体的顶点上、面上、棱上的或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-离子的个数等于_____________,即(填计算式)___________;离子的个数等于___________,即(填计算式)___________.(4)设NaCl的摩尔质量为,食盐晶体的密度为,阿伏加德罗常数为.食盐晶体中两个距离最近的钠离子中心间的距离为___________cm.。

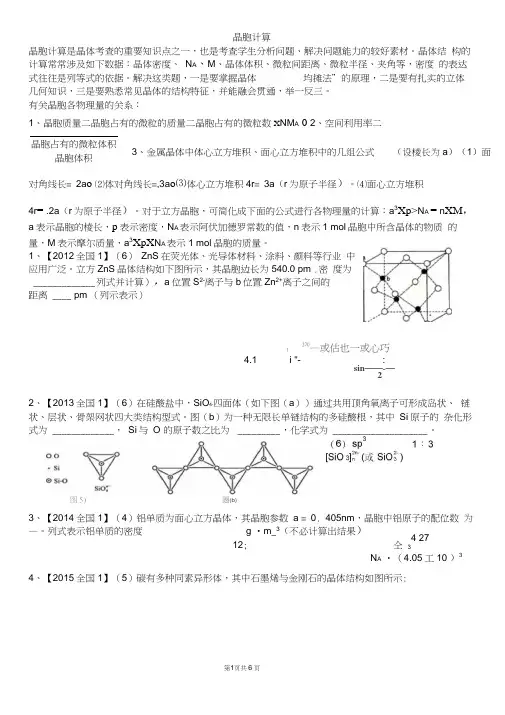
第1页共6页晶胞计算晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。
晶体结 构的计算常常涉及如下数据:晶体密度、 N A 、M 、晶体体积、微粒间距离、微粒半径、夹角等,密度 的表达式往往是列等式的依据。
解决这类题,一是要掌握晶体 均摊法”的原理,二是要有扎实的立体 几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
有关晶胞各物理量的关系:1、晶胞质量二晶胞占有的微粒的质量二晶胞占有的微粒数X NM A 02、空间利用率二对角线长= 2a o ⑵体对角线长=,3a o ⑶体心立方堆积4r = 3a (r 为原子半径)。
⑷面心立方堆积4r = .2a (r 为原子半径)。
对于立方晶胞,可简化成下面的公式进行各物理量的计算:a 3Xp>N A = n XM , a 表示晶胞的棱长,p 表示密度,N A 表示阿伏加德罗常数的值,n 表示1 mol 晶胞中所含晶体的物质 的量,M 表示摩尔质量,a 3XpX N A 表示1 mol 晶胞的质量。
1、【2012全国1】(6) ZnS 在荧光体、光导体材料、涂料、颜料等行业 中应用广泛。
立方ZnS 晶体结构如下图所示,其晶胞边长为540.0 pm .密 度为 _____________ 列式并计算),a 位置S 2-离子与b 位置Zn 2+离子之间的 距离 ____ pm (列示表示)f270—或估也一或心巧4.1 i "- :sin ——-—22、【2013全国1】(6)在硅酸盐中,SiO 4-四面体(如下图(a ))通过共用顶角氧离子可形成岛状、 链状、层状、骨架网状四大类结构型式。
图(b )为一种无限长单链结构的多硅酸根,其中 Si 原子的 杂化形式为 _____________ , Si 与 O 的原子数之比为 _________ ,化学式为 ____________________ 。

高中化学选修三晶胞的计算总结!新课标Ⅰ、Ⅱ、Ⅲ卷、海南等地的高考真题中有一道选作题为选修3·物质结构与性质内容,分值约为15分,其中最后一问一般考查晶胞的相关计算,这部分内容很难,很多同学对此不知如何下手,甚至放弃,但只要掌握技巧,此问题就能迎刃而解,今天小编为大家进行了总结。
1、要清楚几个基本的计算公式:2、能用均摊法计算出晶胞中每种原子的个数。
方法如下:(1)顶点上的原子,被8个晶体所共用,对每一个晶体只提供1/8(2)棱边上的原子,被4个晶体所共用,对每一个晶体只提供1/4(3)面心上的原子,被2个晶体所共用,对每一个晶体只提供1/2(4)体心上的原子,被1个晶体所共用,对每一个晶体只提供1栗子:如下图,是某晶体最小的结构单元,试写出其化学式。
根据均摊法,得出:化学式为xy3z。
3、得出晶胞中所含有的原子的个数。
4、根据题目要求,结合以上三点,计算所求的量如密度、空间利用率、晶胞参数等。
【好题演练】1(选自2016·新课标Ⅱ)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm.答案【解析】铜失去的是全充满的3d10电子,镍失去的是4s1电子,所以ICu>INi。
(4)①根据均摊法计算,晶胞中铜原子个数为6×1/2=3,镍原子的个数为8×1/8=1,则铜和镍的数量比为3:1。
②根据上述分析,该晶胞的组成为Cu3Ni,若合金的密度为dg/cm3,根据p=m÷V,则晶胞参数a=nm。
【考点】晶胞的计算。
2(选自2016·新课标Ⅲ)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
回答问题:GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。
该晶体的类型为________________,Ga与As以________键键合。


晶体结构——晶胞计算鲁科版高中化学选修晶体结构是指晶体中原子或离子的排列方式和几何结构。
晶体结构的研究对于理解晶体的性质和物理化学现象至关重要。
在化学选修课程中,晶体结构是一个重要的知识点,通过学习晶体结构的相关理论和计算方法,可以加深对晶体结构和性质的理解。
晶体结构的计算主要基于晶胞的概念。
晶胞是指晶体中最小的周期性结构单元,通过复制和堆积晶胞,构成了整个晶体的结构。
晶胞一般是一个或多个原子或离子所组成的空间集合体,晶胞中包含了晶体中所有原子或离子的信息。
晶胞的计算需要通过晶体学标准符号来描述晶体的结构类型。
晶体学标准符号包括晶胞的晶格参数和晶胞的角度,通过这些参数可以确定晶体的晶胞类型。
晶胞有多种类型,常见的有立方晶系、四方晶系、正交晶系、斜方晶系、单斜晶系和三斜晶系。
每一种晶胞类型都有其特定的晶格参数和角度范围。
晶胞的计算还需要确定晶胞内原子或离子的排列方式和坐标位置。
一般情况下,晶胞内的原子或离子是有序排列的,根据晶格的对称性,可以通过推导和计算确定原子或离子的位置。
晶胞内的原子或离子的位置通常用晶胞坐标或直角坐标表示,以便计算和描述晶体的结构。
在晶体结构的计算中,晶胞的参数和原子或离子的位置可以通过实验方法或计算方法获得。
实验方法包括X射线衍射、电子衍射和中子衍射等,这些方法可以通过分析衍射图案来确定晶体的结构。
计算方法主要包括理论计算和模拟计算,通过建立晶体结构的模型和应用物理化学理论进行计算,可以得到晶胞参数和原子或离子的位置。
晶体结构的计算在理论和实际应用中都有重要的意义。
在理论方面,晶体结构的计算可以帮助研究人员深入理解晶体的基本结构和性质,探索晶体中物质的行为和相互作用。
在应用方面,晶体结构的计算可以用于材料设计和功能材料的开发。
通过计算晶体结构,可以预测材料的物理化学性质,指导材料合成和工艺流程优化。
总之,在高中化学选修课程中学习晶体结构的相关理论和计算方法,可以帮助学生深入理解晶体的基本结构和性质,为进一步学习和研究材料科学奠定基础。
一.晶体常识
1 .晶体与非晶体比较
2 .获得晶体的三条途径
①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
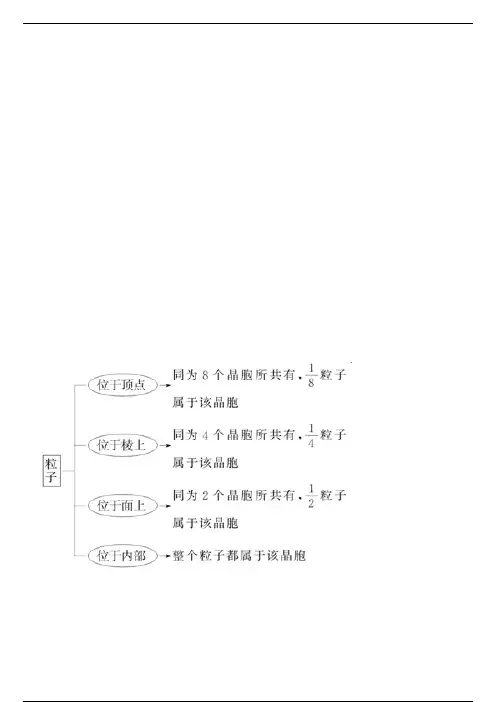
3 .晶胞
晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”。
4 .晶胞中微粒数的计算方法 —— 均摊 法
如某个粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学中常见的晶胞为立方晶胞
立方晶胞中微粒数的计算方法如下:
注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状
二.四种晶体的比较
晶体熔、沸点高低的比较方法
(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体
由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高.如熔点:金刚石>碳化硅>硅
(3)离子晶体
一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。
(4)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。
④同分异构体,支链越多,熔、沸点越低。
(5)金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
三.几种典型的晶体模型。

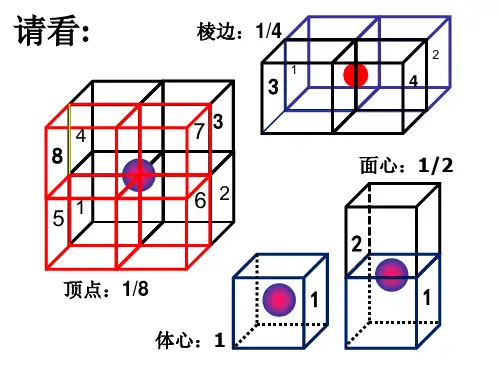

6.晶体结构的计算【考点归纳】 1.晶胞化学式的计算晶体中微粒的排列具有周期性,晶体中最小的结构重复单元称为晶胞,利用“均摊法”可以计算一个晶胞中的粒子数,从而确定晶体的化学式。
“均摊法”的基本思想是晶胞中任意位置上的一个粒子被n 个晶胞共用,那么每个晶胞对这个原子分得份额就是。
常见考题里涉及的晶胞有立方晶胞、六方晶胞、三棱晶胞,以立方晶胞最为常见。
(1)立方晶胞:每个顶点上的粒子被8个晶胞共用,每个粒子只有属于该晶胞;每条棱上的粒子被4个晶胞共用,每个粒子只有属于该晶胞;每个面心上的粒子被2个晶胞共用,每个粒子只有属于该晶胞;晶胞内的粒子完全属于该晶胞。
(2)六方晶胞:每个顶点上的粒子被6个晶胞共用;每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被3个晶胞共用;每个面心上的粒子被2个晶胞共用;晶胞内的粒子完全属于该晶胞。
(3)三棱晶胞:每个顶点上的粒子被12个晶胞共用;每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被6个晶胞共用;每个面心上的粒子被2个晶胞共用;晶胞内的粒子完全属于该晶胞。
2.晶体密度及微粒间距离的计算(1)晶体微粒与M 、ρ之间的关系:若1个晶胞中含有x 个微粒,则1mol 晶胞中含有x mol 微粒,其质量为xM g(M 为微粒的相对“分子”质量);1个晶胞的质量为ρa 3g(a 3为晶胞的体积,ρ为晶胞的密度),则1mol晶胞的质量为ρa 3N A g ,因此有xM =ρa 3N A 。
(2)金属晶体中体心立方堆积、面心立方堆积中的几组公式(设棱长为a ):面对角线长=2a ;体对角线长=3a ;体心立方堆积4r =3a (r 为原子半径);面心立方堆积4r =2a (r 为原子半径)。
(3)空间利用率的计算:空间利用率=晶胞占有的微粒体积晶胞体积。
【过关练习】1.下图是甲、乙、丙三种晶体的晶胞,则甲晶体中x 与y 的个数比是______,乙中a 与b 的个数比是______,丙中一个晶胞中有________个c 离子和________个d 离子。
晶胞参数计算公式晶胞参数是材料表征的重要参数,因而晶胞参数的计算十分重要。
本文针对晶胞参数的计算,详细介绍了晶胞参数计算公式中的一些重要概念及计算方法。
首先,晶胞参数是描述物质电学性质的概念,包括晶胞体积、晶胞定律、晶格常数和晶体结构等。
其中晶胞体积指:物质经过特定初始条件下晶胞构型变化后占用的总空间,是两个基本晶胞参数。
晶胞定律指:晶胞的长、宽、高之间的关系,是一种结构参数的表示。
晶格常数指:两个原子之间的距离,是一种晶胞结构参数的表示。
晶体结构是指:物质中原子构成的定向三维晶体结构。
晶胞参数计算公式包括晶胞参数计算公式和晶格常数计算公式。
晶胞参数计算公式用于计算晶胞体积,晶胞定律及晶体结构,主要有两种计算方法:一种是基于原子坐标的公式,如Bravais(1848)公式、Voronoi(1908)公式和Ginzburg-Landau(1950)公式;另一种是基于晶胞参数的公式,如Hilbert(1912)公式、Madelung(1925)公式和Ladd(1977)公式。
晶格常数计算公式用于计算晶格参数,主要有两种计算方法:一种是基本元素计算法,如Weaire(1892)公式和Morse(1931)公式;另一种是分子力学计算法,如Lennard-Jones(1938)公式和Stillinger-Weber(1985)公式。
现代晶体学通过实验测量元素晶体中原子间距离,利用晶胞参数和晶格常数计算公式,可以准确地确定晶体结构,进而研究物质的物理性质,为应用物理学的发展作出贡献。
在电子结构的计算中,也使用晶胞参数和晶格常数计算公式,分析不同晶体结构的能带结构和电子电荷密度等。
因此,晶胞参数计算公式和晶格常数计算公式是材料表征的重要工具,它们是物理化学所不可缺少的技术手段,极大地提高了研究物质性质的精度。
无论是在材料物理研究中,还是在电子结构计算中,晶胞参数计算公式和晶格常数计算公式都是物理学家必备的技术工具,必将对物理研究和应用物理学的发展产生重要作用。
高中化学选修三晶胞参
数计算
Modified by JACK on the afternoon of December 26, 2020
晶胞参数的计算
1. 均摊法确定晶体的化学式
给出晶体的—部分(称为晶胞)的图形,要求确定晶体的化学式:通常采用均摊法.均摊法有如下规则,以NaCl的晶胞为例:
①处于顶点的粒子,同时为8个晶胞所共有,所以,每个粒子只分摊1/8给该晶胞.
②处于棱上的粒子,同时为4个晶胞所共有,所以,每个粒子只分摊1/4给该晶胞.
③处于面上的粒子,同时为2个晶胞所共有,所以,每个粒子只分摊1/2给该晶胞.
④处于晶胞内部的粒子,则完全属于该晶胞.
由此算出在NaCl的晶胞中:
含数:
含数:
故NaCl晶体中,和数目之比为1∶1.
2. 晶胞参数的计算
根据(1)ρ= m/V
(2)V=a3
例.(1)化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。
某氧化镍样品组成,试计算该晶体中Ni3+与Ni2+的离子个数之比。
[练习]
1. 由钾和氧组成的某种离子晶体中含钾的质量分数为
78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。
在此晶体中,过氧离子和超氧离子的物质的量之比为
A. 2︰1
B. 1︰1
C. 1︰2
D. 1︰3
2.食盐晶体如右图所示。
在晶体中,表示Na+,表示Cl。
已知食盐的密度为g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl的间距大约是
A cm
B cm
A cm D cm
3.某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:3
4. 如右图所示,是一种晶体的晶胞,该离子晶体的化学式为()
A.ABC B.ABC3 C.AB2C3 D.AB3C3
5.晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。
NaCl晶体结构如右图所示。
已知Fe x O晶体晶胞结构为NaCl型,由
于晶体缺陷,x值小于1。
测知Fe x O晶体密度为g/cm3,晶胞边长
为×10-10m。
⑴Fe x O中x值(精确至为___________。
⑵晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小
数表示,精确至为___________。
⑶此晶体化学式为____________。
⑷与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何构型形状是__________。
⑸在晶体中,铁元素的离子间最短距离为__________m。
6.如图,直线交点处的圆圈为NaCl晶体中离子或离子所处的位置.这两种离子在空间3个互相垂直的方向上都是等距离排列的.
(1)请将其中代表离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图.
(2)晶体中,在每个离子的周围与它最接近的且距离相等的共有_________个.
(3)晶体中每一个重复的结构单元叫晶胞.在NaCl晶胞中正六面体的顶点上、面上、棱上的或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-离子的个数等于_____________,即(填计算式)___________;离子的个数等于___________,即(填计算式)___________.
(4)设NaCl的摩尔质量为,食盐晶体的密度为,阿伏加德罗常数为
.食盐晶体中两个距离最近的钠离子中心间的距离为___________cm.。