高中化学选修三第三章第一节晶胞计算
- 格式:ppt
- 大小:373.00 KB
- 文档页数:29



高中化学选修三晶胞的计算总结!新课标Ⅰ、Ⅱ、Ⅲ卷、海南等地的高考真题中有一道选作题为选修3·物质结构与性质内容,分值约为15分,其中最后一问一般考查晶胞的相关计算,这部分内容很难,很多同学对此不知如何下手,甚至放弃,但只要掌握技巧,此问题就能迎刃而解,今天小编为大家进行了总结。
1、要清楚几个基本的计算公式:2、能用均摊法计算出晶胞中每种原子的个数。
方法如下:(1)顶点上的原子,被8个晶体所共用,对每一个晶体只提供1/8(2)棱边上的原子,被4个晶体所共用,对每一个晶体只提供1/4(3)面心上的原子,被2个晶体所共用,对每一个晶体只提供1/2(4)体心上的原子,被1个晶体所共用,对每一个晶体只提供1栗子:如下图,是某晶体最小的结构单元,试写出其化学式。
根据均摊法,得出:化学式为xy3z。
3、得出晶胞中所含有的原子的个数。
4、根据题目要求,结合以上三点,计算所求的量如密度、空间利用率、晶胞参数等。
【好题演练】1(选自2016·新课标Ⅱ)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm.答案【解析】铜失去的是全充满的3d10电子,镍失去的是4s1电子,所以ICu>INi。
(4)①根据均摊法计算,晶胞中铜原子个数为6×1/2=3,镍原子的个数为8×1/8=1,则铜和镍的数量比为3:1。
②根据上述分析,该晶胞的组成为Cu3Ni,若合金的密度为dg/cm3,根据p=m÷V,则晶胞参数a=nm。
【考点】晶胞的计算。
2(选自2016·新课标Ⅲ)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
回答问题:GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。
该晶体的类型为________________,Ga与As以________键键合。


晶胞参数的估计之阳早格格创做1. 均摊法决定晶体的化教式给出晶体的—部分(称为晶胞)的图形,央供决定晶体的化教式:常常采与均摊法.均摊法犹如下准则,以NaCl的晶胞为例:①处于顶面的粒子,共时为8个晶胞所公有,所以,每个粒子只分摊1/8给该晶胞.②处于棱上的粒子,共时为4个晶胞所公有,所以,每个粒子只分摊1/4给该晶胞.③处于里上的粒子,共时为2个晶胞所公有,所以,每个粒子只分摊1/2给该晶胞.④处于晶胞里里的粒子,则实足属于该晶胞.由此算出正在NaCl的晶胞中:含数:含数:故NaCl晶体中,战数目之比为1∶1.2. 晶胞参数的估计根据(1)ρ= m/V(2)V=a3例.(1)化教课本中图示了NaCl晶体结构,它背三维空间蔓延得到完好晶体.NiO(氧化镍)晶体的结构与NaCl 相共,Ni2+与最临近O2-的核间距离为a×10-8cm,估计NiO晶体的稀度(已知NiO的摩我品量为74.7g/mol).(2)天然战绝大部分人为造备的晶体皆存留百般缺陷,比圆正在某氧化镍晶体中便存留如图所示的缺陷:一个Ni2+空缺,另有二个Ni2+被二个Ni3+所与代.其截止晶体仍呈电中性,但是化合物中Ni战O的比值却爆收了变更.某氧化镍样品组成Ni0.97O,试估计该晶体中Ni3+ 与Ni2+的离子个数之比.[训练]1. 由钾战氧组成的某种离子晶体中含钾的品量分数为78/126,其阳离子惟有过氧离子(O22-)战超氧离子(O2-)二种.正在此晶体中,过氧离子战超氧离子的物量的量之比为A. 2︰1B. 1︰1C. 1︰2D. 1︰32.食盐晶体如左图所示.正在晶体中,表示Na+,表示Cl.已知食盐的稀度为 g / cm3,NaCl摩我品量M g / mol,阿伏加德罗常数为N,则正在食盐晶体里Na+战Cl 的间距约莫是A cmB cmA cm D cm3.某物量的晶体中,含A、B、C三种元素,其排列办法如左图所示(其中前后二里心上的B本子没有克没有及绘出),晶体中A、B、C的本子个数比依次为 ( )A.1:3:1 B.2:3:1C.2:2:1 D.1:3:34.如左图所示,是一种晶体的晶胞,该离子晶体的化教式为()A.ABC B.ABC3 C.AB2C3 D.AB3C35.晶体具备准则的几许形状,晶体中最基础的沉复单位称为晶胞.NaCl晶体结构如左图所示.已知FexO晶体晶胞结构为NaCl 型,由于晶体缺陷,x值小于1.测知FexO晶体稀度为5.73g/cm3,晶胞边少为4.28×10-10m.⑴FexO中x值(透彻至0.01)为___________.⑵晶体中的Fe分别为Fe2+、Fe3+,正在Fe2+战Fe3+的总数中,Fe2+所占分数(用小数表示,透彻至0.001)为___________.⑶此晶体化教式为____________.⑷与某个Fe2+(或者Fe3+)距离迩来且等距离的O2-围成的空间几许构型形状是__________.⑸正在晶体中,铁元素的离子间最短距离为__________m.6.如图,曲线接面处的圆圈为NaCl晶体中离子或者离子所处的位子.那二种离子正在空间3个互相笔曲的目标上皆是等距离排列的.(1)请将其中代表离子的圆圈涂乌(没有必思量体积大小),以完毕NaCl晶体结构示企图.(2)晶体中,正在每个离子的周围与它最靠近的且距离相等的公有_________个.(3)晶体中每一个沉复的结构单元喊晶胞.正在NaCl晶胞中正六里体的顶面上、里上、棱上的或者Cl-为该晶胞与其相邻的晶胞所公有,一个晶胞中Cl-离子的个数等于_____________,即(挖估计式)___________;离子的个数等于___________,即(挖估计式)___________.(4)设NaCl的摩我品量为,食盐晶体的稀度为,阿伏加德罗常数为.食盐晶体中二个距离迩来的钠离子核心间的距离为___________cm.。


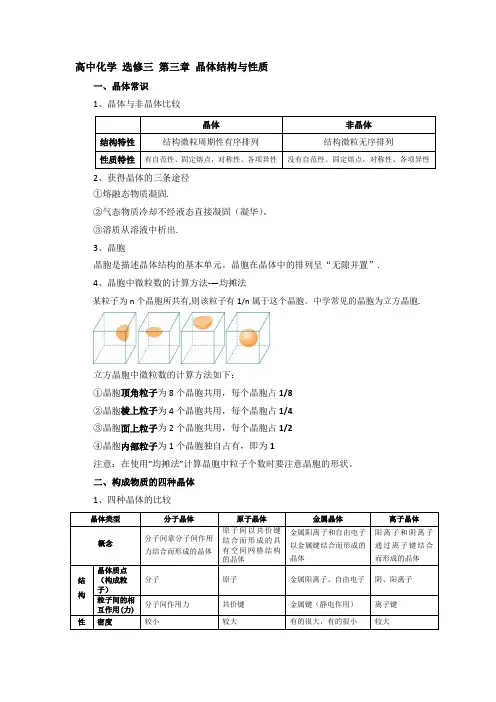
高中化学选修三第三章晶体结构与性质一、晶体常识1、晶体与非晶体比较2、获得晶体的三条途径①熔融态物质凝固.②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出.3、晶胞晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”.4、晶胞中微粒数的计算方法-—均摊法某粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学常见的晶胞为立方晶胞.立方晶胞中微粒数的计算方法如下:①晶胞顶角粒子为8个晶胞共用,每个晶胞占1/8②晶胞棱上粒子为4个晶胞共用,每个晶胞占1/4③晶胞面上粒子为2个晶胞共用,每个晶胞占1/2④晶胞内部粒子为1个晶胞独自占有,即为1注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状。
二、构成物质的四种晶体1、四种晶体的比较晶体类型分子晶体原子晶体金属晶体离子晶体质硬度一般较软很硬一般较硬,少部分软较硬熔沸点很低很高一般较高,少部分低较高溶解性相似相溶难溶于任何溶剂难溶于常见溶剂(Na等与水反应)大多易溶于水等极性溶剂导电传热性一般不导电,溶于水后有的导电一般不具有导电性(除硅)电和热的良导体晶体不导电,水溶液或熔融态导电延展性无无良好无物质类别及实例气态氢化物、酸(如HCl、H2SO4)、大多数非金属单质(如P4、Cl2)、非金属氧化物(如SO2、CO2,SiO2除外)、绝大多数有机物(有机盐除外)一部分非金属单质(如金刚石、硅、晶体硼),一部分非金属化合物(如SiC、SiO2)金属单质与合金(Na、Mg、Al、青铜等)金属氧化物(如Na2O),强碱(如NaOH),绝大部分盐(如NaCl、CaCO3等)2、晶体熔、沸点高低的比较方法(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体.金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。
如熔点:金刚石>碳化硅>硅(3)离子晶体一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。

