(精品)高中化学选修三晶胞参数计算教学文稿
- 格式:doc
- 大小:101.50 KB
- 文档页数:12

晶体结构——晶胞计算鲁科版高中化学选修晶体结构是指晶体中原子或离子的排列方式和几何结构。
晶体结构的研究对于理解晶体的性质和物理化学现象至关重要。
在化学选修课程中,晶体结构是一个重要的知识点,通过学习晶体结构的相关理论和计算方法,可以加深对晶体结构和性质的理解。
晶体结构的计算主要基于晶胞的概念。
晶胞是指晶体中最小的周期性结构单元,通过复制和堆积晶胞,构成了整个晶体的结构。
晶胞一般是一个或多个原子或离子所组成的空间集合体,晶胞中包含了晶体中所有原子或离子的信息。
晶胞的计算需要通过晶体学标准符号来描述晶体的结构类型。
晶体学标准符号包括晶胞的晶格参数和晶胞的角度,通过这些参数可以确定晶体的晶胞类型。
晶胞有多种类型,常见的有立方晶系、四方晶系、正交晶系、斜方晶系、单斜晶系和三斜晶系。
每一种晶胞类型都有其特定的晶格参数和角度范围。
晶胞的计算还需要确定晶胞内原子或离子的排列方式和坐标位置。
一般情况下,晶胞内的原子或离子是有序排列的,根据晶格的对称性,可以通过推导和计算确定原子或离子的位置。
晶胞内的原子或离子的位置通常用晶胞坐标或直角坐标表示,以便计算和描述晶体的结构。
在晶体结构的计算中,晶胞的参数和原子或离子的位置可以通过实验方法或计算方法获得。
实验方法包括X射线衍射、电子衍射和中子衍射等,这些方法可以通过分析衍射图案来确定晶体的结构。
计算方法主要包括理论计算和模拟计算,通过建立晶体结构的模型和应用物理化学理论进行计算,可以得到晶胞参数和原子或离子的位置。
晶体结构的计算在理论和实际应用中都有重要的意义。
在理论方面,晶体结构的计算可以帮助研究人员深入理解晶体的基本结构和性质,探索晶体中物质的行为和相互作用。
在应用方面,晶体结构的计算可以用于材料设计和功能材料的开发。
通过计算晶体结构,可以预测材料的物理化学性质,指导材料合成和工艺流程优化。
总之,在高中化学选修课程中学习晶体结构的相关理论和计算方法,可以帮助学生深入理解晶体的基本结构和性质,为进一步学习和研究材料科学奠定基础。

晶胞参数的估计之阳早格格创做1. 均摊法决定晶体的化教式给出晶体的—部分(称为晶胞)的图形,央供决定晶体的化教式:常常采与均摊法.均摊法犹如下准则,以NaCl的晶胞为例:①处于顶面的粒子,共时为8个晶胞所公有,所以,每个粒子只分摊1/8给该晶胞.②处于棱上的粒子,共时为4个晶胞所公有,所以,每个粒子只分摊1/4给该晶胞.③处于里上的粒子,共时为2个晶胞所公有,所以,每个粒子只分摊1/2给该晶胞.④处于晶胞里里的粒子,则实足属于该晶胞.由此算出正在NaCl的晶胞中:含数:含数:故NaCl晶体中,战数目之比为1∶1.2. 晶胞参数的估计根据(1)ρ= m/V(2)V=a3例.(1)化教课本中图示了NaCl晶体结构,它背三维空间蔓延得到完好晶体.NiO(氧化镍)晶体的结构与NaCl 相共,Ni2+与最临近O2-的核间距离为a×10-8cm,估计NiO晶体的稀度(已知NiO的摩我品量为74.7g/mol).(2)天然战绝大部分人为造备的晶体皆存留百般缺陷,比圆正在某氧化镍晶体中便存留如图所示的缺陷:一个Ni2+空缺,另有二个Ni2+被二个Ni3+所与代.其截止晶体仍呈电中性,但是化合物中Ni战O的比值却爆收了变更.某氧化镍样品组成Ni0.97O,试估计该晶体中Ni3+ 与Ni2+的离子个数之比.[训练]1. 由钾战氧组成的某种离子晶体中含钾的品量分数为78/126,其阳离子惟有过氧离子(O22-)战超氧离子(O2-)二种.正在此晶体中,过氧离子战超氧离子的物量的量之比为A. 2︰1B. 1︰1C. 1︰2D. 1︰32.食盐晶体如左图所示.正在晶体中,表示Na+,表示Cl.已知食盐的稀度为 g / cm3,NaCl摩我品量M g / mol,阿伏加德罗常数为N,则正在食盐晶体里Na+战Cl 的间距约莫是A cmB cmA cm D cm3.某物量的晶体中,含A、B、C三种元素,其排列办法如左图所示(其中前后二里心上的B本子没有克没有及绘出),晶体中A、B、C的本子个数比依次为 ( )A.1:3:1 B.2:3:1C.2:2:1 D.1:3:34.如左图所示,是一种晶体的晶胞,该离子晶体的化教式为()A.ABC B.ABC3 C.AB2C3 D.AB3C35.晶体具备准则的几许形状,晶体中最基础的沉复单位称为晶胞.NaCl晶体结构如左图所示.已知FexO晶体晶胞结构为NaCl 型,由于晶体缺陷,x值小于1.测知FexO晶体稀度为5.73g/cm3,晶胞边少为4.28×10-10m.⑴FexO中x值(透彻至0.01)为___________.⑵晶体中的Fe分别为Fe2+、Fe3+,正在Fe2+战Fe3+的总数中,Fe2+所占分数(用小数表示,透彻至0.001)为___________.⑶此晶体化教式为____________.⑷与某个Fe2+(或者Fe3+)距离迩来且等距离的O2-围成的空间几许构型形状是__________.⑸正在晶体中,铁元素的离子间最短距离为__________m.6.如图,曲线接面处的圆圈为NaCl晶体中离子或者离子所处的位子.那二种离子正在空间3个互相笔曲的目标上皆是等距离排列的.(1)请将其中代表离子的圆圈涂乌(没有必思量体积大小),以完毕NaCl晶体结构示企图.(2)晶体中,正在每个离子的周围与它最靠近的且距离相等的公有_________个.(3)晶体中每一个沉复的结构单元喊晶胞.正在NaCl晶胞中正六里体的顶面上、里上、棱上的或者Cl-为该晶胞与其相邻的晶胞所公有,一个晶胞中Cl-离子的个数等于_____________,即(挖估计式)___________;离子的个数等于___________,即(挖估计式)___________.(4)设NaCl的摩我品量为,食盐晶体的稀度为,阿伏加德罗常数为.食盐晶体中二个距离迩来的钠离子核心间的距离为___________cm.。



二轮60练经典@59晶胞结构分析和密度等相关计算学生版【解题技能】1.晶胞结构的分析(1)判断某种微粒周围等距且紧邻的微粒数目时,要注意运用三维想象法。
如NaCl晶体中,Na+周围的Na+数目(Na+用“○”表示):每个面上有4个,共计12个。
(2)记住常见晶体如干冰、冰、金刚石、SiO2、石墨、CsCl、NaCl、K、Cu等的空间结构及结构特点。
当题中信息给出的某种晶胞空间结构与常见晶胞的空间结构相同时,可以直接套用该种结构。
2.晶胞中微粒数目的计算方法——均摊法长方体(包括立方体)晶胞中不同位置的粒子数的计算方法如图所示:3.计算化学式4.晶胞中微粒配位数的确定方法如:NaCl的晶胞模型如图,Na+配位数为6,Cl-配位数为6金属Po为简单立方堆积,Po的配位数为6金属Na、K、Fe为体心立方堆积,配位数为85.晶体密度的计算步骤[第一步]根据“均摊法”计算出每个晶胞实际含有各一类原子的个数,确定物质的化学式,计算出晶胞的质量[第二步]计算晶胞的体积[第三步]依据ρ=mV计算【考题探究】角度一:晶胞中微粒数目及晶体化学式的计算1.[2020全国Ⅰ]LiFePO4的晶胞结构示意图如(a)所示。
其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
每个晶胞中含有LiFePO4的单元数有____个。
电池充电时,LiFeO4脱出部分Li+,形成Li1−x FePO4,结构示意图如(b)所示,则x=_______,n(Fe2+)∶n(Fe3+)=_______。
2.(2019·全国卷Ⅱ)一种四方结构的超导化合物的晶胞如图1所示。
晶胞中Sm和As原子的投影位置如图2所示。
图1图2图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为________。
3.(2019·海南高考)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为________。





2025年高考化学一轮复习基础知识讲义—晶胞参数计算(新高考通用)【知识清单】 1、晶胞参数晶胞的形状和大小可以用6个参数来表示,包括晶胞的3组棱长a 、b 、c 和3组棱相互间的夹角α、β、γ,即晶格特征参数,简称晶胞参数。
2、晶体结构的相关计算(1)空间利用率=晶胞占有的微粒体积晶胞体积×100%。
(2)金属晶体中体心立方堆积、面心立方堆积中的几组计算公式(设棱长为a ) ①面对角线长=2a 。
①体对角线长=3a 。
①体心立方堆积4r =3a (r 为原子半径)。
①面心立方堆积4r =2a (r 为原子半径)。
(3)晶胞密度ρ=m V =NM∝VN A【题组练习一】1、[2020·全国卷①,35(4)]研究发现,氨硼烷NH 3BH 3在低温高压条件下为正交晶系结构,晶胞参数分别为a pm 、b pm 、c pm ,α=β=γ=90°。
氨硼烷的2×2×2超晶胞结构如图所示。
(N:14 H:1 B:11)氨硼烷晶体的密度ρ=________ g·cm -3(列出计算式,设N A 为阿伏加德罗常数的值)。
【答案】62N A abc ×10-30解析 由题意可知,晶胞的体积V (晶胞)=8abc ×10-30cm 3。
由晶胞结构可知,每个晶胞含有16个NH 3BH 3分子,则每个晶胞的质量m (晶胞)=16×31N A g ,氨硼烷晶体的密度ρ=m 晶胞V 晶胞=16×31N Ag 8abc ×10-30 cm 3=62N A abc ×10-30 g·cm-3。
2、[2020·天津,13(2)节选]CoO 的面心立方晶胞如图所示。
设阿伏加德罗常数的值为N A ,则CoO 晶体的密度为____________g·cm -3。
(O:16 Co:59)【答案】 3×1023N A ·a 3【解析】 由题给图示可知,O 2-位于顶点和面心,因此一个晶胞中含有O 2-的个数为8×18+6×12=4;Co 2+位于棱上和体心,因此一个晶胞中含有Co 2+的个数为12×14+1=4,即一个晶胞的质量为4×75N Ag ,一个晶胞的体积为(a ×10-7)3 cm 3,因此CoO 晶体的密度为3×1023N A ·a3g·cm -3。
高三选修3晶胞知识点晶胞是晶体中最小重复单元,它的形状和结构对于晶体性质的理解具有重要的作用。
在高三选修3中学习晶胞的知识点对于理解晶体结构和材料科学具有重要意义。
本文将从三个方面介绍高三选修3中的晶胞知识点。
第一部分:晶胞的定义和分类晶胞是晶体中最小重复单元,由原子或分子组成。
根据晶体的对称性,我们可以将晶胞分为7个晶系和14个晶格。
1. 立方晶系:晶胞为立方体,边长相等,相互垂直。
2. 正交晶系:晶胞为长方体,边长相互垂直,但不相等。
3. 单斜晶系:晶胞为斜方体,边长不相等,存在一个直角。
4. 斜方晶系:晶胞为斜方体,边长不相等,所有角均不为直角。
5. 三斜晶系:晶胞为斜四面体,边长不相等,所有角均不为直角。
6. 菱面晶系:晶胞为菱形面体,边长不相等,存在4个相邻的直角。
7. 六方晶系:晶胞为六面体,边长不相等,存在6个角为直角。
以上是根据晶体对称性所确定的晶胞分类,不同晶胞的形状和结构决定了晶体的不同性质和应用。
第二部分:晶胞参数及其计算方法晶体的晶胞参数是描述晶体结构的重要参数,包括晶胞长度、晶胞角度等。
1. 晶胞长度:晶胞的长度由晶格常数确定,晶格常数是指晶体沿不同方向上的原子、离子或分子排列的周期性重复距离。
2. 晶胞角度:晶胞的角度也由晶格常数决定,不同晶体的晶胞角度不同。
计算晶胞参数的方法包括使用X射线衍射、粉末衍射和电子衍射等实验方法,以及分子动力学模拟和第一性原理计算等理论方法。
这些方法可以精确确定晶体的晶胞结构,为材料科学的研究提供重要的依据。
第三部分:晶胞的应用和意义晶胞的形状和结构对晶体的性质和应用具有重要的影响。
1. 晶胞的形状决定了晶体的外观和结构,不同晶体的晶胞形状各异。
2. 晶胞的结构决定了晶体的物理和化学性质,如硬度、电导率、光学性质等。
3. 晶胞的研究为材料科学和固体物理学等领域提供了重要的基础,促进了材料的开发和应用。
总结:本文介绍了高三选修3中的晶胞知识点,包括晶胞的定义和分类、晶胞参数及其计算方法,以及晶胞的应用和意义。
晶胞参数的计算
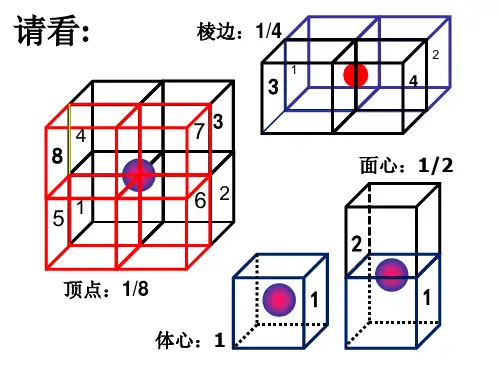
1. 均摊法确定晶体的化学式
给出晶体的—部分(称为晶胞)的图形,要求确定晶体的化学式:通常采用均摊法.均摊法有如下规则,以NaCl的晶胞为例:
①处于顶点的粒子,同时为8个晶胞所共有,所以,每个粒子只分摊1/8给该晶胞.
②处于棱上的粒子,同时为4个晶胞所共有,所以,每个粒子只分摊1/4给该晶胞.
③处于面上的粒子,同时为2个晶胞所共有,所以,每个粒子只分摊1/2给该晶胞.
④处于晶胞内部的粒子,则完全属于该晶胞.
由此算出在NaCl的晶胞中:
含数:
含数:
故NaCl晶体中,和
数目之比为1∶1.
2. 晶胞参数的计算
根据(1)ρ= m/V
(2)V=a3
例.(1)化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+
所取代。
其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。
某氧化镍样品组成Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子个数之比。
[练习]
1. 由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。
在此晶体中,过氧离子和超氧离子的物质的量之比为()
A. 2︰1
B. 1︰1
C. 1︰2
D. 1︰3
2.食盐晶体如右图所示。
在晶体中,•表示Na+,ο表示Cl-。
已知食盐的密度为ρ g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是
()
A.cm
B.
cm
A.cm D.
cm
3.某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:3
4. 如右图所示,是一种晶体的晶胞,该离子晶体的化学式为()
A.ABC B.ABC3 C.AB2C3 D.AB3C3
5.晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。
NaCl晶体结构如右图所示。
已知Fe x O晶体晶胞结构为NaCl型,由
于晶体缺陷,x值小于1。
测知Fe x O晶体密度为5.73 g/cm3,晶胞边长
为4.28×10-10m。
⑴Fe x O中x值(精确至0.01)为___________。
⑵晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小
数表示,精确至0.001)为___________。
⑶此晶体化学式为____________。
⑷与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何构型形状是__________。
⑸在晶体中,铁元素的离子间最短距离为__________m。
6.如图,直线交点处的圆圈为NaCl晶体中
离子或离子所处的位置.这两种离子在空间3个互相垂直的方向上都是等距离排列的.
(1)请将其中代表离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图.
(2)晶体中,在每个离子的周围与它最接近的且距离相等的共有_________个.
(3)晶体中每一个重复的结构单元叫晶胞.在NaCl晶胞中正六面体的顶点上、面上、棱上的
或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-离子的个数等于_____________,即(填计算式)___________;
离子的个数等于___________,即(填计算式)___________.
(4)设NaCl的摩尔质量为,食盐晶体的密度为,阿伏加德罗常数为
.食盐晶体中两个距离最近的钠离子中心间的距离为___________cm.。