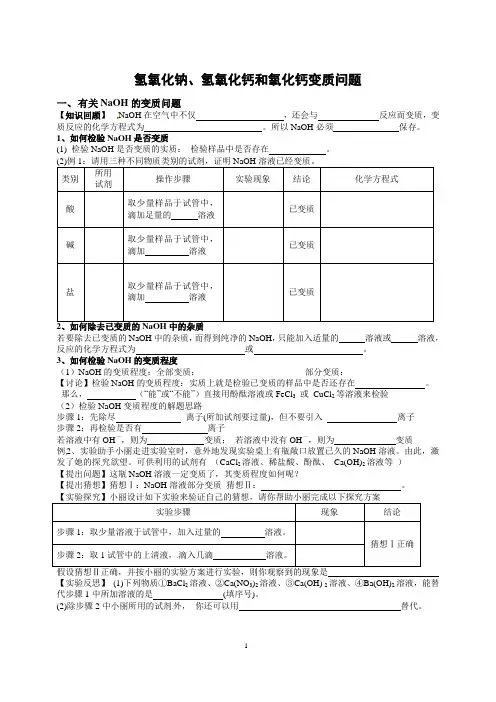
实验探究一有关氢氧化钠和氢氧化钙变质的探究
- 格式:doc
- 大小:63.00 KB
- 文档页数:5
![[原创]2015年《南方新中考》化学 第二部分 专题五 实验探究一 有关氢氧化钠和氢氧化钙变质的探究[配套课件]](https://uimg.taocdn.com/8ca1490fb7360b4c2e3f6460.webp)


氢氧化钠和氢氧化钙变质的探究一、氢氧化钠和氢氧化钙变质氢氧化钠变质:氢氧化钠变质的化学方程式_______________________________。
证明方法:(1)取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:NaOH+HCl=NaCl+H2O 和 Na2CO3+2HCl=2NaCl+H2O+CO2↑(2)取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓(3)取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:Na2CO3+CaCl2=2NaCl+CaCO3↓(或) Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓氢氧化钙变质:氢氧化钙变质的化学方程式______________________________。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:Ca(OH)2+2HCl=CaCl2+2H2O CaCO3+2HCl=CaCl2+H2O+CO2↑氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。
二、氢氧化钠和氢氧化钙部分变质氢氧化钠部分变质的证明方法:1、取样,(如果是固体,就需要加适量水,使固体完全溶解),加过量的氯化钡(或氯化钙)溶液,如果有白色沉淀产生,说明碳酸钠存在:Na2CO3+BaCl2=2NaCl+BaCO3↓ Na2CO3+CaCl2 =2NaCl+CaCO3↓2、过滤,向滤液中滴加酚酞溶液,如果滤液变红,说明氢氧化钠存在,氢氧化钠部分变质。
氢氧化钙固体部分变质的证明方法:取样,加适量水使固体溶解,过滤,得滤渣和滤液。
向滤渣中加入过量的稀盐酸,如果有气泡产生,说明碳酸钙存在,向滤液中滴加酚酞,溶液变红,证明有氢氧化钙存在在。
CaCO3+2HCl=CaCl2+H2O+CO2↑例1:(2014鄂州)化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。

实验探究一有关氢氧化钠和氢氧化钙变质的探究1.(2018年湛江)实验室有一瓶保管不当的试剂(如右图),其残缺的标签中只剩下“Na”和“10%”的字样。
已知它是无色液体,是初中化学常用的试剂。
小欣和小芳同学很感兴趣,决定对其成分进行探究。
【提出猜想】(1)这瓶试剂可能是什么溶液呢?①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaCl溶液。
(2)根据受损标签的情况判断,这瓶试剂不可能...是________(填字母代号)。
A.酸 B.碱 C.盐【收集资料】Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
物质NaCl NaOH Na2CO3NaHCO3溶解度/g 36 109 215 9.6【得出结论】(3)小欣根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能...是________(填物质名称)。
【设计实验】(4)①小芳用胶头滴管吸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能...是______。
操作步骤实验现象结论及化学方程式取样于试管中,滴加氢氧化钙溶液__________________猜想②正确,相关的化学方程式:__________________________________________________________________232.(2018年广州)实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。
某研究性学习小组发现一瓶未密闭保存的KOH固体,对其成分提出以下假设,并完成了实验探究。
假设1:只含KOH; 假设2:含KOH和K2CO3; 假设3:只含K2CO3。
(1)成分中可能含有K2CO3的原因是(用化学方程式回答)________________________。
(2)取少量样品于试管中,加入足量稀盐酸,观察到______________,说明假设2或假设3成立。
(3)进一步探究的过程如下:①“操作1”的名称是______________;②“固体A”的化学式是______________;③加入足量CaCl2溶液的作用是__________________________________。


氢氧化钠和氢氧化钙变质探究题1.CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质:〔1〕该兴趣小组用干燥管、烧杯、铜网等设计装配了一个在实验室中制取二氧化碳气体的装置,如右图所示.在干燥管的铜网上应盛放若将铜网换成铁网,可能产生的后果是其原因是〔用化学方程式表示〕〔2〕该兴趣小组同学将制得的CO2分别通人澄清石灰水和氢氧化钠溶液中,他们观察到前者变浑浊,后者无明显现象.CO2和NaOH是否发生了化学反应?①小明设计了甲、乙两个实验来验证C02与NaOH发生了化学反应,如右图所示.实验现象为:甲--软塑料瓶变瘪,乙--"瓶吞鸡蛋".小虎同学认为上述实验是可行的.其共同原理是小雯同学提出质疑,她认为上述实验还不足以说明CO2和NaOH发生了反应.其理由是小明同学针对小雯的质疑又补充了一个对照实验,这个实验是将②小虎向甲实验后变瘪塑料瓶的溶液中加入,观察到现象,从而证明CO2与NaOH已经发生了反应.2.一天,实验助手小娟走进实验室,和老师一起检查每个实验桌上的药品、仪器是否齐备,走到某组的时候,看到了一个不和谐的"音符"〔如右图〕。
〔1〕此情此景你首先想到的是它可能变质了,该变质反应的化学方程式为:。
〔2〕围绕此瓶NaOH溶液是否变质的问题,小娟利用实验室的三种试剂〔氯化钙溶液、稀盐酸、酚酞试液〕展开了探究活动。
①取少量溶液于试管中,滴加某种试剂,有气泡产生,由此证明NaOH溶液已经变质。
你认为小娟所加的试剂是②欲证明变质的溶液存NaOH,请你帮助小娟完成以下探究方案:探究目的探究步骤预计现象除尽溶液中的CO32-①:取少量溶液于试管中,滴加足量的试剂有白色沉淀产生证明溶液存NaOH ②:向实验①所得溶液中滴加酚酞试液〔4〕写出②中反应的方程时3.端午阳节后,小丽带着快乐的心情返回学校。
当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望。

【2022年中考复习】氢氧化钠和氢氧化钙的变质问题探究一、氢氧化钠变质的知识归纳氢氧化钠变质主要考点包括:变质原因、检验变质的方法、检验变质的程度、除去杂质得到就纯净的氢氧化钠。
变质程度分别有:①全部变质:Na2CO3;②部分变质:N a2CO3和NaOH。
1.氢氧化钠变质的原因:如果敞口放置,与空气中的二氧化碳反应,生成了碱性的碳酸钠。
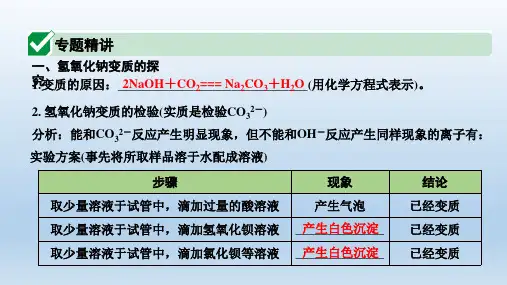
化学原理用化学方程式表示为:2NaOH+CO2=Na2CO3+ H2O2.检验氢氧化钠是否变质的方法(分别滴加酸、碱、盐溶液,各为一种方法)。
取少量样品于试管中,滴加足量稀盐酸(或者稀硫酸),如果产生气泡,说明已变质。
无明显现象,说明未变质。
化学原理用化学方程式表示为:Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑。
②取少量样品于试管中,滴加氢氧化钙溶液(或者氢氧化钡溶液),如果产生白色沉淀,说明已变质。
化学原理用化学方程式表示为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
③取少量样品于试管中,滴加氯化钙溶液(或者硝酸钙等其它可溶性钙盐、钡盐溶液)。
化学原理用化学方程式表示为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
3.检验氢氧化钠变质程度的方法:取少量样品于试管中,滴加足量的中性的CaCl2溶液,有白色沉淀生成;过滤,向滤液中滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
分析原理:⑵氢氧化钠和变质后生成的碳酸钠溶液都呈碱性,滴加足量的氯化钙溶液是为了除尽生成的碳酸钠,这时会产生白色沉淀,然后滴加酚酞溶液,如果溶液呈红色,说明溶液呈碱性,有未变质的氢氧化钠,部分变质。
如果溶液不变红,说明没有氢氧化钠了,完全变质了。
化学原理用化学方程式表示为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
还可以加入:MgCl2(白色沉淀)、CuCl2(蓝色沉淀)、FeCl3(红褐色沉淀)、FeCl2(白色沉淀)、NH4Cl(刺激性气味)、紫色石蕊溶液等。


初三化学专题复习—NaOH 、Ca(OH)2变质问题【探究1:NaOH变质问题】氢氧化钠没密封保存会因吸收空气中的二氧化碳,生成碳酸钠而变质。
2NaOH+CO2===Na2CO3+H2O。
一、氢氧化钠的变质存在这样三种情况(猜想):(1)没有变质:(成分NaOH)(2)部分变质:(成分NaOH 和Na2CO3)(3)完全变质:(成分Na2CO3)二、证明变质:(取样—-—-加试剂-——说操作——-描现象———下结论)检验是否有碳酸钠有三种不同的方法:(1)加入盐酸有气泡冒出:2HCl + Na2CO3=2NaC l+ H2O+CO2↑(2)加入石灰水有沉淀产生:Ca(OH)2 + Na2CO3 = CaCO3↓+2NaOH(3)加入氯化钙有沉淀产生:Na2CO3 +CaCl2= CaCO3↓+2NaCl取少许固体物质溶于水,配成溶液与试管中;可分别向其中滴加酸、碱、盐溶液中的一种。
【方法(1)】:取少许固体物质溶于水,配成溶液与试管中,向其中滴加稀盐酸或稀硫酸,如果产生气泡,说明已经变质。
原理:碳酸钠会与酸反应生成二氧化碳气体氧化钠与酸反应没有明显现象。
Na2CO3+2HCl=== 2NaCl+H2O+ CO2↑〖N l== NaCl+H2O〗【方法(2)】:取少许固体物质溶于水,配与试管中,向其中滴加氢氧化钡溶液或氢氧化如果产生白色沉淀,说明已经变质。
原理:碳酸钠会与氢氧化钡或氢氧化钙反应白色沉淀,而氢氧化钠与氢氧化钡或氢氧化钙应,没有明显现象。
Na2CO3+Ba(OH)2== BaCO3↓+ 2NaOH;NaO (OH)2≠【方法(3)】:取少许固体物质溶于水,液与试管中,向其中滴加氯化钡溶液或氯化钙(或硝酸钡等其他可溶性钙盐、钡盐溶液),生白色沉淀,说明已经变质.原理:碳酸钠会与氯化钡或氯化钙反应生沉淀,而氢氧化钠与氯化钡或氯化钙不反应,显现象。
Na2CO3+BaCl2== BaCO3↓+ 2NaCl;NaOH+ 2≠〖但是不能加指示剂来判断,因为NaOH 和3的溶液都显示碱性〗三、确定成分1. 没有变质(成分NaOH)的探究方法:取少许固体物质溶于水,配成溶液置与试管中,向其中滴加氯化钙溶液看到溶液无变化,滴无色酚酞试液显红色,说明没变质;Na2CO3+CaCl2== CaCO3↓+ 2NaCl ;NaOH+ Ca C l2≠2. 部分变质(成分NaOH 和Na2CO3)的探究方法:取少许固体物质溶于水,配成溶液与试管中,向其中滴加足量的氯化钙溶液,溶液变浑浊,向反应后的溶液滴加无色酚酞试液,溶液显红色,说明是部分变质;Na2CO3+CaCl2== CaCO3↓+ 2NaCl3。
氢氧化钠变质的探究1、变质原因与成分分析原因:氢氧化钠和空气中的二氧化碳发生反应。
化学方程式为成分分析:没有变质:NaOH;部分变质:NaOH和Na2CO3;全部变质:Na2CO3.2、检验是否氢氧化钠变质的方法:注意:在检验氢氧化钠是变质时,加入的酸必须是足量的!如果氢氧化钠部分变质时,成分为NaOH和Na2CO3,此时如果加入少量的酸,酸会先与NaOH反应后与Na2CO3反应,酸的量少的话不会与Na2CO3反应,看不到气泡。
题目1:一次用餐中,小丽同学对“固体酒精”产生好奇,于是她决定买回一袋,对其进行研究.【收集资料】通过阅读标签及查阅资料,她获得如下信息:(1)该固体酒精中含有酒精、氯化钙、氢氧化钠三种物质;(2)酒精的化学式为C2H5OH;(3)氯化钙、氯化钡的水溶液均呈中性.【提出问题】(1)酒精的化学式与NaOH相比,都有“OH”,那么酒精的水溶液是不是显碱性?(2)固体酒精中的氢氧化钠是否变质及变质的程度如何?【实验探究】实验一:她取少量酒精溶液于试管中,滴加硫酸铜溶液,未观察到蓝色沉淀,说明酒精溶液(填“显”或“不显”)碱性.实验二:(1)她先取少量固体酒精于烧杯中,加入足量水溶解后静置,发现烧杯底部有白色沉淀,再取沉淀于试管中加稀盐酸,观察到,说明氢氧化钠已变质.请写出氢氧化钠在空气中变质的化学方式.(3)她取上述烧杯中上层清液于试管中,先滴加足量澄清石灰水,发现生成白色沉淀,再滴入几滴无色酚酞溶液,液体呈红色,她认为氢氧化钠部分变质.老师发现后,提示她由该实验得出的结论不可靠.你认为只要将上述实验中的澄清石灰水变为(填化学式)溶液,即可得到氢氧化钠部分变质的结论.【拓展应用】除去部分变质的氢氧化钠溶液中的杂质,方法是(化学方程式表示)解析:(1)碱具有四个通性是因为碱溶液中都含有OH—,如果酒精呈碱性会有OH—,滴加硫酸铜溶液时会有蓝色沉淀生成,所以不显碱性。
(2)固体酒精中含有NaOH,如果NaOH变质会有Na2CO3,滴加稀盐酸时会看到有气泡生成。
氢氧化钠氢氧化钙变质问题
氢氧化钠和氢氧化钙是常见的化学物质,它们在工业生产和日
常生活中都有着重要的应用。
然而,当它们发生变质时,可能会带
来一些问题。
首先,让我们来看一下氢氧化钠和氢氧化钙的性质。
氢氧化钠,也被称为烧碱,是一种强碱,常用于清洁剂、肥皂和纸浆生产中。
而氢氧化钙,也被称为石灰,是一种强碱性物质,常用于水泥生产、矿石冶炼和环境修复等领域。
然而,当氢氧化钠和氢氧化钙发生变质时,可能会对人体健康
和环境造成危害。
例如,氢氧化钠在潮湿的环境中会吸收二氧化碳
并逐渐转变为碳酸钠,这会降低其碱性,从而影响其应用效果。
而
氢氧化钙在潮湿的环境中也会吸收二氧化碳并转变为碳酸钙,同样
会降低其碱性。
另外,当氢氧化钠和氢氧化钙与一些物质发生反应时,也会产
生有害的气体。
比如,当氢氧化钠与铝粉或锌粉发生反应时,会产
生氢气,而氢气是一种易燃易爆的气体。
而氢氧化钙与二氧化碳反
应时,会产生碳酸钙和水,但同时也会释放出大量热量。
因此,为了避免氢氧化钠和氢氧化钙的变质问题带来的危害,我们在储存和使用这些化学物质时,需要注意环境湿度和与其他物质的接触,以及采取适当的防护措施。
只有这样,我们才能更安全地使用这些化学物质,保护人体健康和环境安全。
实验探究一有关氢氧化钠和氢氧化钙变质的探究
1.(20XX年湛江)实验室有一瓶保管不当的试剂(如右图),其残缺的标签中只剩下“Na”和“10%”的字样。
已知它是无色液体,是初中化学常用的试剂。
小欣和小芳同学很感兴趣,决定对其成分进行探究。
【提出猜想】
(1)这瓶试剂可能是什么溶液呢?
①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaCl溶液。
(2)根据受损标签的情况判断,这瓶试剂不可能
...是________(填字母代号)。
A.酸B.碱C.盐
【收集资料】
Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ.
(3)小欣根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂
不可能
...是________(填物质名称)。
【设计实验】
(4)①小芳用胶头滴管吸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能
...是______。
23
__________ 溶液。
2.(20XX 年广州)实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。
某研究性学习小组发现一瓶未密闭保存的KOH 固体,对其成分提出以下假设,并完成了实验探究。
假设1:只含KOH; 假设2:含KOH 和K 2CO 3; 假设3:只含K 2CO 3。
(1)成分中可能含有K 2CO 3的原因是(用化学方程式回答)________________________。
(2)取少量样品于试管中,加入足量稀盐酸,观察到______________,说明假设2或假设3成立。
(3)进一步探究的过程如下:
①“操作1”的名称是______________;
②“固体A ”的化学式是______________;
③加入足量CaCl 2溶液的作用是__________________________________。
(4)变质试剂也有利用价值,从KOH 和K 2CO 3的组成和性质看,这瓶变质试剂的用途是________________(写出一条)。
3.(20XX 年北京)化学小组的同学探究二氧化碳与氢氧化钠的反应,实验方案如下:
(2)步骤②中的操作是________________________________________,其目的是
______________________________________________________________________________。
(3)步骤④中发生反应的化学方程式为:________________________________________。
(4)本实验的结论是________________________________________。
4.小明和小艳在实验室配制石灰水时,小明同学将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是他认为熟石灰样品已经变质。
小艳同学不同意他的判断,你认为小艳同学的理由是
__________________________。
针对该熟石灰样品的成分,同学们展开了讨论,请你参与讨论并完成实验报告。
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(OH)2; 乙同学猜想是CaCO 3;你认为是________________________。
灰。
5.(原创)某兴趣小组的同学在老师的指导下,对一瓶没有塞橡皮塞的氢氧化钙溶液进行探究,请你一起参与。
【提出问题】该氢氧化钙溶液是否全部变质?
【猜想与假设】猜想①:氢氧化钙溶液可能全部变质,变成碳酸钙。
猜想②:氢氧化钙溶液可能部分变质,其成分是______________。
【反思拓展】(1)氢氧化钙露置于空气中易变质,原因是__________________________(用化学方程式表示)。
(2)在分析化学反应的物质成分时,除了考虑生成物外,还需考虑的是______________。
6.某化学实验活动小组的同学为了探究实验室中久置氢氧化钠固体的成分,进行了有关实验,请你参与他们进行的探究活动:
【猜想与假设】
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:______________。
【实验与探究】
过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立。
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈______________性(填“酸”或“碱”),能使酚酞变红。
因此,他认为该方案的操作步骤中应该改进的是_______________________________。
(3)实验小组的同学展开讨论,又提出了一个定量试验方案,通过测定产生沉淀的质量来证明猜想Ⅱ或猜想Ⅲ成立。
试验如下:准确称量m克固体样品于试管中,加热蒸馏水完全溶解,然后滴加足量氯化钡溶液,充分反应后过滤、洗涤、干燥,称得沉淀的质量为n 克,若猜想Ⅱ成立,则m与n的关系式为(用含m和n的等式或不等式表示,下同)______________;若猜想Ⅲ成立,则m与n的关系式为______________。
【反思与交流】久置固体氢氧化钠变质的原因是(用化学方程式表示):________________________。
7.(原创)在化学实验室,小刚和小强意外发现实验桌上有一瓶敞口放置的氢氧化钠固体,他们对这瓶氢氧化钠固体是否变质进行了如下实验探究:
【提出问题】这瓶氢氧化钠固体是否变质?
氢氧化钠露置在空气中会发生变质。
变质的原因是____________________________(用化学方程式表示)。
【实验探究】为检验这瓶氢氧化钠固体是否变质,小刚和小强设计了如下实验方案:小刚:取少量样品加适量蒸馏水配成溶液后,滴入几滴酚酞溶液,若观察到溶液变红色,证明该瓶氢氧化钠固体没有变质。
小强:取少量样品加适量蒸馏水配成溶液后,滴入适量澄清石灰水,若观察到有白色沉淀生成,证明该瓶氢氧化钠固体已经变质。
你认为上述实验方案错误
..的是________,理由是__________________________________。
浓硫酸需要密封保存的原因:________________________________________。
有关氢氧化钠和氢氧化钙变质的探究
1.(2)A (3)碳酸氢钠 (4)①NaCl
②
(5)2.(1)2KOH +CO 2===K 2CO 3+H 2O
(2)有气泡产生 (3)①过滤 ②CaCO 3
③使碳酸钾完全反应,防止对氢氧化钾检验的干扰
(4)作钾肥(其他答案合理则可)
3.(1)NaOH 溶液吸收CO 2,装置内压强变小,气球鼓起
(2)向外拉注射器1(或充分振荡) 证明步骤1中装置内的CO 2已被完全吸收
(3)Ca(OH)2+CO 2===H 2O +CaCO 3↓
(4)CO 2能和NaOH 反应
4.Ca(OH)2微溶于水
[作出猜想]Ca(OH)2和CaCO 3的混合物
[实验与结论]酚酞溶液 稀盐酸 溶液变红色 固体逐渐溶解,有气泡产生
[拓展与应用]密封
5.[猜想与假设]碳酸钙和氢氧化钙
[实验探究]气泡 氢氧化钙
[实验结论]②
[反思拓展](1)CO 2+Ca(OH)2===CaCO 3↓+H 2O
(2)反应物是否有剩余
6.[猜想与假设]含NaOH 和Na 2CO 3
[实验与探究](1)Ⅰ 白色沉淀 Na 2CO 3+Ba(OH)2===BaCO 3↓+2NaOH
(2)碱 将步骤二中的氢氧化钡溶液改为加入过量的氯化钡溶液
(3)n =197m 106 n <197m 106
[反思与交流]2NaOH +CO 2===Na 2CO 3+H 2O
7.[提出问题]2NaOH +CO 2===Na 2CO 3+H 2O。