氢氧化钠、氢氧化钙变质问题探究
- 格式:ppt
- 大小:920.00 KB
- 文档页数:18


氢氧化钠和氢氧化钙变质的探究一、氢氧化钠和氢氧化钙变质氢氧化钠变质:氢氧化钠变质的化学方程式_______________________________。
证明方法:(1)取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:NaOH+HCl=NaCl+H2O 和 Na2CO3+2HCl=2NaCl+H2O+CO2↑(2)取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓(3)取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:Na2CO3+CaCl2=2NaCl+CaCO3↓(或) Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓氢氧化钙变质:氢氧化钙变质的化学方程式______________________________。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:Ca(OH)2+2HCl=CaCl2+2H2O CaCO3+2HCl=CaCl2+H2O+CO2↑氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。
二、氢氧化钠和氢氧化钙部分变质氢氧化钠部分变质的证明方法:1、取样,(如果是固体,就需要加适量水,使固体完全溶解),加过量的氯化钡(或氯化钙)溶液,如果有白色沉淀产生,说明碳酸钠存在:Na2CO3+BaCl2=2NaCl+BaCO3↓ Na2CO3+CaCl2 =2NaCl+CaCO3↓2、过滤,向滤液中滴加酚酞溶液,如果滤液变红,说明氢氧化钠存在,氢氧化钠部分变质。
氢氧化钙固体部分变质的证明方法:取样,加适量水使固体溶解,过滤,得滤渣和滤液。
向滤渣中加入过量的稀盐酸,如果有气泡产生,说明碳酸钙存在,向滤液中滴加酚酞,溶液变红,证明有氢氧化钙存在在。
CaCO3+2HCl=CaCl2+H2O+CO2↑例1:(2014鄂州)化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。


氢氧化钠氢氧化钙变质问题
氢氧化钠和氢氧化钙是两种常见的化学物质,它们在工业生产
和日常生活中都有着重要的应用。
然而,当它们发生变质时可能会
带来一些问题。
首先,让我们了解一下氢氧化钠和氢氧化钙的性质。
氢氧化钠,化学式为NaOH,是一种强碱,常见的用途包括制造肥皂、纸张和清
洁剂等。
而氢氧化钙,化学式为Ca(OH)2,也被称为熟石灰,常用
于水处理、建筑材料和农业等领域。
当氢氧化钠和氢氧化钙发生变质时,可能会导致以下问题:
1. 化学反应,氢氧化钠和氢氧化钙在一定条件下可能会发生化
学反应,产生新的化合物,这可能会影响到原本预期的使用效果。
2. 安全隐患,变质后的氢氧化钠和氢氧化钙可能会导致安全隐患,如释放有害气体或导致火灾等危险情况。
为了避免氢氧化钠和氢氧化钙的变质问题,我们需要注意以下
几点:
1. 储存条件,储存氢氧化钠和氢氧化钙时,应该避免高温、潮湿和阳光直射,以防止其发生变质。
2. 使用期限,在使用氢氧化钠和氢氧化钙时,应该注意其使用期限,避免使用过期或变质的产品。
3. 化学储存分开,在储存氢氧化钠和氢氧化钙的时候,应该避免与其他化学品混合储存,以免发生意外的化学反应。
总的来说,氢氧化钠和氢氧化钙是重要的化学物质,但是在使用和储存时需要注意其变质问题,以确保安全和有效地使用。

氢氧化钠和氢氧化钙变质探究题1.CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质:〔1〕该兴趣小组用干燥管、烧杯、铜网等设计装配了一个在实验室中制取二氧化碳气体的装置,如右图所示.在干燥管的铜网上应盛放若将铜网换成铁网,可能产生的后果是其原因是〔用化学方程式表示〕〔2〕该兴趣小组同学将制得的CO2分别通人澄清石灰水和氢氧化钠溶液中,他们观察到前者变浑浊,后者无明显现象.CO2和NaOH是否发生了化学反应?①小明设计了甲、乙两个实验来验证C02与NaOH发生了化学反应,如右图所示.实验现象为:甲--软塑料瓶变瘪,乙--"瓶吞鸡蛋".小虎同学认为上述实验是可行的.其共同原理是小雯同学提出质疑,她认为上述实验还不足以说明CO2和NaOH发生了反应.其理由是小明同学针对小雯的质疑又补充了一个对照实验,这个实验是将②小虎向甲实验后变瘪塑料瓶的溶液中加入,观察到现象,从而证明CO2与NaOH已经发生了反应.2.一天,实验助手小娟走进实验室,和老师一起检查每个实验桌上的药品、仪器是否齐备,走到某组的时候,看到了一个不和谐的"音符"〔如右图〕。
〔1〕此情此景你首先想到的是它可能变质了,该变质反应的化学方程式为:。
〔2〕围绕此瓶NaOH溶液是否变质的问题,小娟利用实验室的三种试剂〔氯化钙溶液、稀盐酸、酚酞试液〕展开了探究活动。
①取少量溶液于试管中,滴加某种试剂,有气泡产生,由此证明NaOH溶液已经变质。
你认为小娟所加的试剂是②欲证明变质的溶液存NaOH,请你帮助小娟完成以下探究方案:探究目的探究步骤预计现象除尽溶液中的CO32-①:取少量溶液于试管中,滴加足量的试剂有白色沉淀产生证明溶液存NaOH ②:向实验①所得溶液中滴加酚酞试液〔4〕写出②中反应的方程时3.端午阳节后,小丽带着快乐的心情返回学校。
当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望。

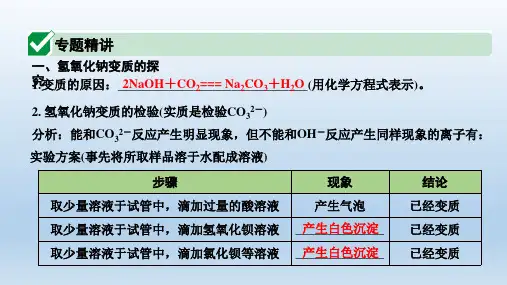
【2022年中考复习】氢氧化钠和氢氧化钙的变质问题探究一、氢氧化钠变质的知识归纳氢氧化钠变质主要考点包括:变质原因、检验变质的方法、检验变质的程度、除去杂质得到就纯净的氢氧化钠。
变质程度分别有:①全部变质:Na2CO3;②部分变质:N a2CO3和NaOH。
1.氢氧化钠变质的原因:如果敞口放置,与空气中的二氧化碳反应,生成了碱性的碳酸钠。
化学原理用化学方程式表示为:2NaOH+CO2=Na2CO3+ H2O2.检验氢氧化钠是否变质的方法(分别滴加酸、碱、盐溶液,各为一种方法)。
取少量样品于试管中,滴加足量稀盐酸(或者稀硫酸),如果产生气泡,说明已变质。
无明显现象,说明未变质。
化学原理用化学方程式表示为:Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑。
②取少量样品于试管中,滴加氢氧化钙溶液(或者氢氧化钡溶液),如果产生白色沉淀,说明已变质。
化学原理用化学方程式表示为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
③取少量样品于试管中,滴加氯化钙溶液(或者硝酸钙等其它可溶性钙盐、钡盐溶液)。
化学原理用化学方程式表示为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
3.检验氢氧化钠变质程度的方法:取少量样品于试管中,滴加足量的中性的CaCl2溶液,有白色沉淀生成;过滤,向滤液中滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
分析原理:⑵氢氧化钠和变质后生成的碳酸钠溶液都呈碱性,滴加足量的氯化钙溶液是为了除尽生成的碳酸钠,这时会产生白色沉淀,然后滴加酚酞溶液,如果溶液呈红色,说明溶液呈碱性,有未变质的氢氧化钠,部分变质。
如果溶液不变红,说明没有氢氧化钠了,完全变质了。
化学原理用化学方程式表示为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
还可以加入:MgCl2(白色沉淀)、CuCl2(蓝色沉淀)、FeCl3(红褐色沉淀)、FeCl2(白色沉淀)、NH4Cl(刺激性气味)、紫色石蕊溶液等。



初三化学专题复习—NaOH 、Ca(OH)2变质问题【探究1:NaOH变质问题】氢氧化钠没密封保存会因吸收空气中的二氧化碳,生成碳酸钠而变质。
2NaOH+CO2===Na2CO3+H2O。
一、氢氧化钠的变质存在这样三种情况(猜想):(1)没有变质:(成分NaOH)(2)部分变质:(成分NaOH 和Na2CO3)(3)完全变质:(成分Na2CO3)二、证明变质:(取样—-—-加试剂-——说操作——-描现象———下结论)检验是否有碳酸钠有三种不同的方法:(1)加入盐酸有气泡冒出:2HCl + Na2CO3=2NaC l+ H2O+CO2↑(2)加入石灰水有沉淀产生:Ca(OH)2 + Na2CO3 = CaCO3↓+2NaOH(3)加入氯化钙有沉淀产生:Na2CO3 +CaCl2= CaCO3↓+2NaCl取少许固体物质溶于水,配成溶液与试管中;可分别向其中滴加酸、碱、盐溶液中的一种。
【方法(1)】:取少许固体物质溶于水,配成溶液与试管中,向其中滴加稀盐酸或稀硫酸,如果产生气泡,说明已经变质。
原理:碳酸钠会与酸反应生成二氧化碳气体氧化钠与酸反应没有明显现象。
Na2CO3+2HCl=== 2NaCl+H2O+ CO2↑〖N l== NaCl+H2O〗【方法(2)】:取少许固体物质溶于水,配与试管中,向其中滴加氢氧化钡溶液或氢氧化如果产生白色沉淀,说明已经变质。
原理:碳酸钠会与氢氧化钡或氢氧化钙反应白色沉淀,而氢氧化钠与氢氧化钡或氢氧化钙应,没有明显现象。
Na2CO3+Ba(OH)2== BaCO3↓+ 2NaOH;NaO (OH)2≠【方法(3)】:取少许固体物质溶于水,液与试管中,向其中滴加氯化钡溶液或氯化钙(或硝酸钡等其他可溶性钙盐、钡盐溶液),生白色沉淀,说明已经变质.原理:碳酸钠会与氯化钡或氯化钙反应生沉淀,而氢氧化钠与氯化钡或氯化钙不反应,显现象。
Na2CO3+BaCl2== BaCO3↓+ 2NaCl;NaOH+ 2≠〖但是不能加指示剂来判断,因为NaOH 和3的溶液都显示碱性〗三、确定成分1. 没有变质(成分NaOH)的探究方法:取少许固体物质溶于水,配成溶液置与试管中,向其中滴加氯化钙溶液看到溶液无变化,滴无色酚酞试液显红色,说明没变质;Na2CO3+CaCl2== CaCO3↓+ 2NaCl ;NaOH+ Ca C l2≠2. 部分变质(成分NaOH 和Na2CO3)的探究方法:取少许固体物质溶于水,配成溶液与试管中,向其中滴加足量的氯化钙溶液,溶液变浑浊,向反应后的溶液滴加无色酚酞试液,溶液显红色,说明是部分变质;Na2CO3+CaCl2== CaCO3↓+ 2NaCl3。

一、氢氧化钠和氢氧化钙变质(理论)氢氧化钠变质:是因为与空气中的反应生成。
化学方程式1.氢氧化钠变质证明方法:a),滴加 (或者稀硫酸),如果产生,说明。
方程式和b)取少量样品于试管中,滴加氢氧化钙溶液(或者氢氧化钡溶液),如果产生,说明已变质。
方程式和c),滴加或硝酸钙)溶液,如果有产生,说明NaOH已经变质:方程式或2.氢氧化钙变质氢氧化钙变质是因为与空气中的反应生成。
证明方法:,加入,如果有气泡产生,说明氢氧化钙已经变质:方程式3.氢氧化钠固体和氢氧化钙固体变质时,固体质量都会。
二、氢氧化钠和氢氧化钙部分变质1.氢氧化钠部分变质的证明方法:①,(如果是固体,就需要加适量,使固体),加2.(或硝酸钙)溶液,如果有产生,说明有存在:方程式:或②,向,如果滤液变红,说明存在,氢氧化钠。
反之,如果滤液无明显现象,完全变质。
3.氢氧化钙固体部分变质的证明方法:①,加适量水使固体完全溶解,加入,如果有气泡产生,说明存在:方程式②,,如果闻到味,说明存在,氢氧化钙部分变质:方程式或3.如何除去部分变质的氢氧化钠中的碳酸钠。
,然后,就得到氢氧化钠溶液,再,就得到氢氧化钠固体。
反应方程式(注意:①不能选用盐酸或硫酸等酸液,因为酸与碳酸钠反应的同时也会与氢氧化钠反应,而且会生成NaCl或Na2SO4,引入了。
②不能用氯化钙等盐溶液,因为它们会碳酸钠反应生成了,引入了新的杂质。
)※专项训练※1、化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:[提出问题1] 该氢氧化钠溶液是否变质了呢?[实验探究1]实验操作实验现象实验结论取少量该溶液于试管中,向溶液中滴加有气泡冒出。
氢氧化钠溶液一定变质了。
稀盐酸,并不断振荡。
[提出问题2] 该氢氧化钠溶液是全部变质还是部分变质呢?[猜想与假设] 猜想1:氢氧化钠溶液部分变质。
猜想2:氢氧化钠溶液全部变质。
[查阅资料] (1)氯化钙溶液呈中性。
探究题专题2氢氧化钙、氢氧化钠(或溶液)、生石灰在空气中变质探究1.某同学做实验时发现,盛放NaOH溶液的瓶口与橡皮塞上,常有白色粉末出现。
为探究这种白色粉末的成分,设计了如下实验。
请你完成实验报告。
2.小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。
小刚叫来小军和小红,共同探究这种白色粉末的成分。
他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH :②可能是Na2CO3:③可能是NaOH与Na z CO s的混合物。
为了验证猜想,他们分别做了下面的实验。
(1 )小刚取少量白色粉末,滴加稀盐酸,有气体生成。
由此小刚认为白色粉末是Na2CO3。
请判断小刚所得结论是否正确,并简述理由。
(2)小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色。
由此小军认为白色粉末是NaOH。
请判断小军所得结论是否正确,并简述理由。
(3)小红取少量白色粉末溶于水,向所得溶液中滴加CaCl2试液,有白色沉淀产生。
由此判断白色粉末中含有为了验证猜想③,小红继续向溶液中滴加CaCl 2试液至不再产生沉淀,然后过滤你认为她接下来还应进行的实验是在小红所做的实验中,若把CaCl 2溶液换成Ca(OH) 2溶液是否可行?请简述理由。
3•纯净的烧碱由于敞口放置在空气中而含有杂质•现取此样品少量,请你设计一个实验方案:既可证明样品中含有上述杂质,又可将该杂质除去得到纯净的烧碱。
4•做中和反应实验时,我将稀盐酸滴入氢氧化钠溶液中,意外看到有气泡产生。
小伟提醒:是不是拿错了药品?我查验后确认药品没错,只是在瓶口发现有白色粉末状物质。
我认为是氢氧化钠溶液变质了。
⑴氢氧化钠溶液变质的原因是_______________________________________________ 。
⑵利用与上述实验不同的原理,我又设计了一个实验再次确认该氢氧化钠溶液已变质。
该氢氧化钠 溶液变质⑷如何除去变质氢氧化钠溶液中的杂质?5 •在实验室中,用于配制饱和石灰水的烧杯如果没有及时清洗,一段时间后,烧杯壁 上会附有一层白色固体。
实验探究:有关氢氧化钠和氢氧化钙变质的探究(一)练习题组A1.(2012年湛江)实验室有一瓶保管不当的试剂(如右图),其残缺的标签中只剩下“Na”和“10%”的字样。
已知它是无色液体,是初中化学常用的试剂。
小欣和小芳同学很感兴趣,决定对其成分进行探究。
【提出猜想】(1)这瓶试剂可能是什么溶液呢?①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaCl溶液。
(2)根据受损标签的情况判断,这瓶试剂不可能是________(填字母代号)。
A.酸B.碱C.盐【收集资料】Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ.测定室温(20 ℃)时,四种物质的溶解度的数据如下:物质NaCl NaOH Na2CO3 NaHCO3溶解度/g 36 109 215 9.6【得出结论】(3)小欣根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是________(填物质名称)。
【设计实验】(4)①小芳用胶头滴管吸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是______。
②小欣为了检验该溶液是NaOH溶液还是Na2CO3溶液,她又进行了如下实验:操作步骤实验现象结论及化学方程式取样于试管中,滴加氢氧化钙溶液__________________ 猜想②正确,相关的化学方程式:__________________________________________________________________(5)请你选择与小欣不同类别的试剂,来鉴别NaOH溶液和Na2CO3溶液,你选择__________ 溶液。
2.(2013年广州)实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。
某研究性学习小组发现一瓶未密闭保存的KOH固体,对其成分提出以下假设,并完成了实验探究。
假设1:只含KOH; 假设2:含KOH和K2CO3; 假设3:只含K2CO3。