仿制药与原研药20160405
- 格式:pptx
- 大小:7.76 MB
- 文档页数:35

深度剖析:从四个阶段看我国仿制药与原研药差距根源2015-05-26谢沐风医药经济报药品作为一种特殊商品,在国民经济生活中发挥着重要作用,而我国制药行业与发达国家存在巨大差距,从目前各大三甲医院处方中原研药独占鳌头的现状便可窥见一斑。
那么,我国仿制药的“症结”何在?本文以口服固体制剂为突破口,从产业链高度剖析解读。
[第一阶段]申报临床前的药学研究“两个要求”有差距1.对申报样品生产规模的要求。
发达国家是连续3批、每批至少10万片,这体现了工艺稳定性和工业药剂学,同时对研发资金提出要求。
而我国对该点要求较为模糊,导致很多研发单位1万~3万片就申报了,甚至更少。
2.对溶出度的要求。
溶出度试验是口服固体制剂重中之重的评价指标,是撬动制剂研发的“杠杆”,所以发达国家早在上个世纪90年代就提出“在有针对性的溶出度试验条件下(该针对性包含区分力、体内外相关性等要素),仿制制剂3批样品在多介质中的溶出行为均应与原研制剂一致”的研发要求,这一要求极大地促进和迫使研发单位对制剂各个要素(原料药、辅料、设备、工艺、人员等)开展深入研究。
2011年4月,我国也明确了这一要求,但之前仅按照质量标准中的“三个一”(一个介质、一个时间点、一个限度)来要求。
由于标准过低,使得研发单位无需细致的制剂开发便能符合要求并通过检验复核。
溶出度试验“三个一”远不够首先,针对六类仿制制剂开发,照搬既有质量标准。
由于既有质量标准很多均采用高转速或高浓度表面活性剂或高溶解性介质等没有区分力的试验条件,使得仿制制剂开发难度大大减低,质量也就难以匹敌原研制剂。
既有质量标准之所以制订得如此宽松,原因如下:1.国内质量标准。
我国的质量标准与发达国家仍然存在差距,如《中国药典(2010年版)》中的卡马西平片为:桨板法、150转、0.1mol/L盐酸1000ml、60min不得少于65%限度。
而日本要求为:桨板法、75转、在pH1.2、4.0、6.8和水共4种溶出介质中,5分钟均不得过60%和30分钟均不得少于70%(因该药物是治疗窗狭窄药物,故前点不能有“突释效应”)。


国家食品药品监管总局公告2016年第105号――关于发布仿制药质量和疗效一致性评价工作程序的公告【法规类别】药品管理【发文字号】国家食品药品监管总局公告2016年第105号【发布部门】国家食品药品监督管理总局【发布日期】2016.05.25【实施日期】2016.05.25【时效性】现行有效【效力级别】部门规范性文件国家食品药品监管总局公告(2016年第105号)关于发布仿制药质量和疗效一致性评价工作程序的公告为规范仿制药质量和疗效一致性评价工作,根据《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)的有关要求,国家食品药品监督管理总局组织制定了《仿制药质量和疗效一致性评价工作程序》,现予发布。
特此公告。
附件:仿制药质量和疗效一致性评价工作程序国家食品药品监管总局2016年5月25日附件仿制药质量和疗效一致性评价工作程序为贯彻落实国务院办公厅《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号),规范仿制药质量和疗效一致性评价工作申报流程,特制定本工作程序。
一、评价品种名单的发布国家食品药品监督管理总局发布开展仿制药质量和疗效一致性评价(以下简称一致性评价)的品种名单。
药品生产企业按照国家食品药品监督管理总局发布的品种名单,对所生产的仿制药品开展一致性评价研究。
二、企业开展一致性评价研究药品生产企业是开展一致性评价的主体。
对仿制药品(包括进口仿制药品),应参照《普通口服固体制剂参比制剂选择和确定指导原则》(国家食品药品监督管理总局公告2016年第61号),选择参比制剂,以参比制剂为对照药品全面深入地开展比对研究。
参比制剂需履行备案程序的,按照《仿制药质量和疗效一致性评价参比制剂备案与推荐程序》(国家食品药品监督管理总局公告2016年第99号)执行。
仿制药品需开展生物等效性研究的,按照《关于化学药生物等效性试验实行备案管理的公告》(。

原研药和仿制药的区别?第一,什么是原研药?指原创性的、自主开发的、新的药品。
由拥有药品专利权的企业进行生产的。
例如由美国吉利德公司生产的用于治疗丙肝的特效药——索非布韦和Harvoni,就是典型的国内目前未审批上市的原研药。
第二,什么是仿制药?非原创性的、只是对原研药的主要成分进行复制。
生产企业对药品没有专利权。
价格只有原研药的1/3。
仿制药与原研药含有相同的活性成分,具有生物等效性,且在剂型、规格及给药途径等方面也与原研药一致。
那么,两种看上去极其相似的药品,真正的区别究竟在哪里?一是生产上。
相同点:就是主要成分的复制。
不同点:原料的纯度、其余成分的添加、制造工艺。
以上三点不同直接导致药物进入靶组织的程度和速度的不同。
二是安全性上。
原研药由于其试验检验和临床检验时间较长,保证其疗效及安全性。
仿制药中的很大一部分实际效果、毒副反应的实践检验时间不长,病例有限,难以全面、准确地反映其实际性能。
三是价格差。
我国《药品政府定价办法》第六条规定:区别GMP 与非GMP药品、原研药品与仿制药品、新药和名优药品与普通药品定价,优质优价。
2004年6月通过国家最新核定的产品零售价,10个主要的用药量较大的产品中,最小的差价率为49%(硝苯地平片剂),最高的差价率为526%(头孢曲松钠针)。
国内现状:仿制药市场占比虽高,患者仍要求使用原研药。
上海医药产业也以仿制药为主导。
目前,全市现有批准文号5430个,其中仿制药占比超过95%。
北京协和医院则在采购药品时会将进口原研药或国产仿制药各进口一个。
按照药典标准,国内已上市的仿制药质量基本上都是合格的,和原研药做到了化学等价,但尚未做到完全的生物等效和临床等效。
以“中美上海施贵宝制药有限公司生产的降糖药——二甲双胍“(商品名格华止,国产仿制药一般称二甲双胍)举例。
虽然全国有上百家企业在仿制二甲双胍,但格华止在国内一年的销售额超过2亿美元,占中国整个二甲双胍市场的70%。

仿制药与原研药的攻与防作者:丁晓峰来源:《新财富》2018年第08期首先需要明确的是,仿制药不等于假药,仿制药也有合法与非法之分。
而合法与否,在于该药是否获得相应的国家上市批准。
电影男主人公原型陆勇所购买的印度仿制药Imacy并未得到中国的批准,所以属于假药。
下文提及的仿制药,非另行说明均指合法的仿制药。
仿制药的市场颇大,当今世界上的处方药品,80%均为仿制药,而在中国更是占到了95%。
且除了印度和中国,瑞士、以色列、美国也均是仿制药生产大国。
而生产仿制药的,不光是不知名的小药厂,还包括世界上数一数二的大厂。
比如,世界排名第二的诺华药业,旗下的山德士也是世界上销售第二的仿制药厂。
《我不是药神》中化名提及的治疗慢粒白血病的格列卫,正是出自诺华药业的原研药。
每种原研药都有一定的专利期,待过了专利期,或是专利权失效,其它药厂就有权利仿制相同的药,各个国家都鼓励这种行为。
这是因为,在市场独占期内,一般原研药只有一家厂商在售卖,定价相当贵,而仿制药一旦进入,激烈的竞争会让价格大幅下降,而价格下降意味着病人负担减轻、国家相关保险支付减轻。
据相关统计,一般而言,仿制药的价格在原研药的1/20左右。
单就美国一个国家,2005-2014年间,低价仿制药价就为医药系统节约了1.68万亿美元。
正出于此,1984年,美国颁布的《药品价格竞争和专利期修正案》同时涵盖了原研药保护和仿制药合法竞争的内容,规范了仿制药竞争规则,使仿制药行业成为正规的合法行业。
该法案之前,原研药专利未到期前,不允许研制仿制药,而这个法案撤销了该条限制,使得仿制药能够尽早地研发出来,在原研药专利权失效时同步上市,尽快地降低医疗成本。
该法案甚至还鼓励仿制药在原研药专利到期前就发起专利挑战,一旦专利挑战成功,意味着司法判定此仿制药不侵犯原研药专利,可以即刻上市。
为了加大这种鼓励,第一个专利挑战成功的首仿药,会享有180天的仿制药独占期,在这期间,美国食品药品监督管理局(Food and Drug Administration,以下简称FDA)不再批准其它仿制药上市,首仿药在180天内以原研药60%-90%的价格销售,可以迅速地回收成本。

仿制药与原研发药不同在何处原研发药是怎样走入我们生活的?要想了解这个问题,先得弄清楚原研发药与仿制药的区别。
原研发药,即指原创性的新药,经过对成千上万种化合物层层筛选和严格的临床试验才得以获准上市。
需要花费15年左右的研发时间和数亿美元,目前只有大型跨国制药企业才有能力研制。
仿制药与原研发药不同,仿制药仅复制原研发药的主要分子结构,省时省资省力。
但是,仿制药的疗效可能与原研发药不尽相同,自然医疗价值判别很大。
那么一个原创性研发的新药是怎样诞生的呢?新药的研发过程说白了就是优胜劣汰的过程1,确定疾病靶标不少疾病通常是因细胞内或细胞表面的某一蛋白的功能异常导致的。
通过药物阻断或者增强该蛋白的活性达到治病的目的。
研发新药首先必须明确关键蛋白,判定药物研发的疾病靶标。
2,活性筛选接着制造靶蛋白,筛选靶蛋白生物活性,只有0。
1%显示部分活性符合需要,建立靶蛋白科研模型,选择对靶蛋白有反应性的活性化合物进一步研究,确定活性稳定并能改造的中标化合物为先导结构。
3,优化好的药品,不仅要吸收好疗效好,还要避免不良反应,再经过长达三年反复地试验将先前初筛的先导结构改造为符合科研要求的优化分子结构物。
6,报告临床前先导结构的特性这些优化的先导结构还要在动物身上中进行各种毒性等试验,符合国家有关法规的,才能进入临床试验。
经过5-7年的临床观察,才能最后确定其对疾病治疗的疗效。
这里介绍的只是一个成功药品的研发过程,更多的研究由于这样那样的原因半途夭折,药厂蒙受的损失不言而喻,所以研发新药是一个高风险产业。
原研发药开发的工作并非到此结束,制药公司还要培训医生正确使用新药,控制可能出现的不良反应及应急处理方法。
这样才能使药品更好地服务患者,消除疾病痛苦。
而仿制药生产厂家很难做到这些。
原研发药与仿制药在疗效方面的差别中国是一个以生产仿制药为主的国家,随着中国加入WTO原研发药才被重视。
发达国家两者并存。
因此原研发药与仿制药疗效差别的概念已经深入到发达国家的医生和患者头脑中。
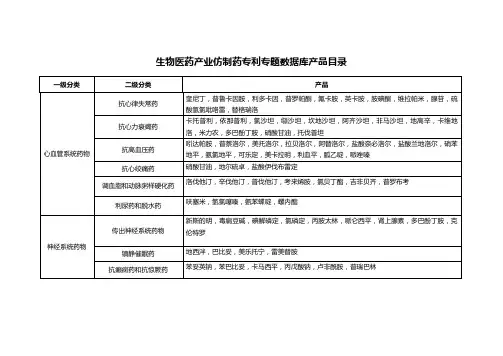

国家药监局关于发布仿制药参比制剂目录(第三十九批)的通告文章属性•【制定机关】国家药品监督管理局•【公布日期】2021.03.01•【文号】国家药品监督管理局通告2021年第20号•【施行日期】2021.03.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药品监督管理局通告2021年第20号国家药监局关于发布仿制药参比制剂目录(第三十九批)的通告经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第三十九批)。
特此通告。
附件:仿制药参比制剂目录(第三十九批)国家药监局2021年3月1日附件仿制药参比制剂目录(第三十九批)序号药品通用名称英文名称/商品名规格持证商备注1备注239-1 匹维溴铵片PinaveriumBromide Tablets/Dicetel50mgAbbottLaboratoriesLimited国内上市的原研药品原研进口39-2 盐酸阿莫罗芬乳膏AmorolfineHydrochlorideCream/Loceryl(罗每乐)0.25%GaldermaLaboratoriumGmbH国内上市的原研药品原研进口39-3 硫酸异帕米星注射液Isepamicin SulfateInjection/Exacin(依克沙)2ml:400mg(按异帕米星(C22H43N5O12)计)Asahi KaseiPharmaCorporation国内上市的原研药品原研进口39-4 硫酸异帕米星注射液Isepamicin SulfateInjection/Exacin(依克沙)2ml:200mg(按异帕米星(C22H43N5O12)计)Asahi KaseiPharmaCorporation国内上市的原研药品原研进口39-5 盐酸美金刚多奈哌齐缓释胶囊MemantineHydrochlorideExtended-releaseand DonepezilHydrochlorideCapsules/Namzaric7mg/10mgAllergan SalesLLC未进口原研药品美国橙皮书39-6 盐酸美金刚多奈哌齐缓释胶囊MemantineHydrochlorideExtended-releaseand DonepezilHydrochlorideCapsules/Namzaric14mg/10mgAllergan SalesLLC未进口原研药品美国橙皮书39-7 盐酸美金刚多奈哌齐缓释胶囊MemantineHydrochlorideExtended-releaseand DonepezilHydrochlorideCapsules/Namzaric21mg/10mgAllergan SalesLLC未进口原研药品美国橙皮书39-8 盐酸美金刚多奈哌齐缓释胶囊MemantineHydrochlorideExtended-releaseand DonepezilHydrochlorideCapsules/Namzaric28mg/10mgAllergan SalesLLC未进口原研药品美国橙皮书39-9 赖氨洛芬注射液Ibuprofen LysineInjection/NeoProfen20mg/2mlRecordati RareDiseases Inc.未进口原研药品美国橙皮书39-10 盐酸苯达莫司汀注射液BendamustineHydrochlorideInjection/Belrapzo100mg/4ml(25mg/ml)EaglePharmaceuticals,Inc.未进口原研药品美国橙皮书39-11 米哚妥林胶囊MidostaurinCapsules/Rydapt25mgNovartisPharmaceuticalsCorporation未进口原研药品美国橙皮书39-12 盐酸米诺环素缓释片MinocyclineHydrochlorideExtended ReleaseTablets/Solodyn55mgMedicisPharmaceuticalCorp未进口原研药品美国橙皮书39-13 盐酸米诺环素缓释片MinocyclineHydrochlorideExtended ReleaseTablets/Solodyn65mgMedicisPharmaceuticalCorp未进口原研药品美国橙皮书39-14 盐酸米诺环素缓释片MinocyclineHydrochlorideExtended ReleaseTablets/Solodyn80mgMedicisPharmaceuticalCorp未进口原研药品美国橙皮书39-15 盐酸米诺环素缓释片MinocyclineHydrochlorideExtended ReleaseTablets/Solodyn105mgMedicisPharmaceuticalCorp未进口原研药品美国橙皮书39-16 盐酸米诺环素缓释片MinocyclineHydrochlorideExtended ReleaseTablets/Solodyn115mgMedicisPharmaceuticalCorp未进口原研药品美国橙皮书39-17 盐酸去氧肾上腺素滴眼液PhenylephrineHydrochlorideOphthalmicSolution2.5%Akorn OperatingCo Llc未进口原研药品美国橙皮书39-18 盐酸去氧肾上腺素滴眼液PhenylephrineHydrochlorideOphthalmicSolution10%Akorn OperatingCo Llc未进口原研药品美国橙皮书39-19 奥利司他咀嚼片Orlistat ChewableTablet/Alli27mgGlaxoSmithKline(Ireland)Limited未进口原研药品欧盟上市39-20 依达拉奉注射液Edaravone Injection100ml:30mgMitsubishi TanabePharmaCorporation国内上市的原研药品原研进口39-21 马来酸阿伐曲泊帕片AvatrombopagMaleateTablets/Doptelet(苏可欣)20mg AkaRx Inc.国内上市的原研药品原研进口39-22 地高辛片DigoxinTablets/Lanoxin0.125mgConcordiaPharmaceuticalsInc未进口原研药品美国橙皮书39-23 盐酸奥洛他定滴眼液OlopatadineHydrochlorideophthalmic solution0.2%/ Pataday0.2%AlconLaboratories Inc未进口原研药品美国橙皮书39-24 富马酸喹硫平片QuetiapineFumarate Tablets/Seroquel25mgAstraZenecaPharmaceuticalsLP未进口原研产品美国橙皮书39-25 富马酸喹硫平片QuetiapineFumarate Tablets/Seroquel300mgAstraZenecaPharmaceuticalsLP未进口原研产品美国橙皮书39-26 沙美特罗替卡松吸入粉雾剂SalmeterolXinafoate andFluticasonePropionate PowderforInhalation/AdvairDiskus100mcg/50mcgGlaxo SmithKline未进口原研药品美国橙皮书39-27 沙美特罗替卡松吸入粉雾剂SalmeterolXinafoate andFluticasonePropionate PowderforInhalation/AdvairDiskus250mcg/50mcgGlaxo SmithKline未进口原研药品美国橙皮书39-28 沙美特罗替卡松吸入粉雾剂SalmeterolXinafoate andFluticasonePropionate PowderforInhalation/AdvairDiskus500mcg/50mcgGlaxo SmithKline未进口原研药品美国橙皮书39-29 沙美特罗替卡松吸入粉雾剂SalmeterolXinafoate andFluticasonePropionate PowderforInhalation/SeretideDiskus50mcg/100mcgGlaxo WellcomeUK Ltd未进口原研药品欧盟上市39-30 沙美特罗替卡松吸入粉雾剂SalmeterolXinafoate andFluticasonePropionate PowderforInhalation/SeretideDiskus50mcg/250mcgGlaxo WellcomeUK Ltd未进口原研药品欧盟上市39-31 沙美特罗替卡松吸入粉雾剂SalmeterolXinafoate andFluticasonePropionate PowderforInhalation/SeretideDiskus50mcg/500mcgGlaxo WellcomeUK Ltd未进口原研药品欧盟上市39-32 雷诺嗪缓释片RanolazineProlonged-ReleaseTablets /Ranexa500mgMenariniInternationalOperationsLuxembourg S.A未进口原研药品欧盟上市39-33 交联玻璃酸钠注射液Hyaluronic acid,stabilized singleinjection/ Durolane3 ml:玻璃酸钠60mgBioventus LLC未进口原研药品欧盟上市39-34 特立氟胺片TeriflunomideTablets/Aubagio14mgSanofi-AventisGroupe未进口原研药品欧盟上市39-35 盐酸美金刚片MemantineHydrochlorideTablets/Ebixa5mg H. Lundbeck A/S未进口原研药品欧盟上市39-36 盐酸美金刚片MemantineHydrochlorideTablets/Ebixa15mg H. Lundbeck A/S未进口原研药品欧盟上市39-37 中长链脂肪乳/氨基酸(16)/葡萄糖(30%)注射液Medium and LongChain Fat Emulsion/ Amino Acids (16)/ Glucose (30%)Injection/NuTRIflexLipid plus1875mlB.BraunMelsungen AG未进口原研药品欧盟上市39-38 脂肪乳氨基酸(17)葡萄糖(19%)注射液Fat Emulsion,Amino Acids(17) AndGlucose(19%)Injection/Kabiven2053ml Fresenius Kabi国际公认的同种药品欧盟上市39-39 左甲状腺素钠片LevothyroxineSodium Tablets200μgMerck SeronoGmbH/MerckSante/MerckGesellschaft mbH未进口原研药品欧盟上市39-40 依普利酮片Eplerenone Tablets25mgファイザー株式会社未进口原研药品日本上市39-41 依普利酮片Eplerenone Tablets50mgファイザー株式会社未进口原研药品日本上市39-42 依普利酮片Eplerenone Tablets100mgファイザー株式会社未进口原研药品日本上市39-43 枸橼酸坦度螺酮片TandospironeCitrate Tablets5mg大日本住友製薬株式会社未进口原研日本上市39-44 别嘌醇片Allopurinol Tablets/ Zyloric50mgグラクソ?スミスクライン株式会社未进口原研药品日本上市39-45 别嘌醇片Allopurinol Tablets/ Zyloric100mgグラクソ?スミスクライン株式会社未进口原研药品日本上市39-46 吡仑帕奈片PerampanelTablets/Fycompa2mgEisai Inc/Eisai EuropeLimited未进口原研药品英国上市39-47 吡仑帕奈片PerampanelTablets/Fycompa4mgEisai Inc/Eisai EuropeLimited未进口原研药品英国上市39-48 吡仑帕奈片PerampanelTablets/Fycompa8mgEisai Inc/Eisai EuropeLimited未进口原研药品英国上市39-49 吡仑帕奈片PerampanelTablets/Fycompa12mgEisai Inc/Eisai EuropeLimited未进口原研药品英国上市39-50 硫酸吗啡缓释片Morphine SulphateSustained-releaseTablets30mgNappPharmaceuticalsLimited未进口原研药品英国上市39-51 拉莫三嗪分散片LamotrigineDispersibleTablets/Lamictal2mgThe WellcomeFoundation Ltd.未进口原研药品英国上市7-25对乙酰氨基酚片ParacetamolTablets/PanadolAdvance Tablets0.5gGlaxoSmithKlineConsumerHealthcare欧盟上市备注1由“欧盟上市(上市国家:英国;产地:德国)”更正为“欧盟上市”7-88盐酸溴己新片BromhexineHydrochlorideTablets/Bisolvon8mgBoehringerIngelheim PharmaGmbH & Co.KG/Sanofi-AventisDeutschlandGmbH未进口原研药品持证商发生变更,增加持证商Sanofi-AventisDeutschlandGmbH23-219脂肪乳氨基酸(17)葡萄糖(19%)注射液FatEmulsion,AminoAcids(17)AndGlucose(19%)Injection/Kabiven1026mlFresenius KabiAB国内上市的国际公认药品持证商更新为FreseniusKabi AB23-220脂肪乳氨基酸(17)葡萄糖(19%)注射液FatEmulsion,AminoAcids(17)AndGlucose(19%)Injection/Kabiven2053mlFresenius KabiAB国内上市的国际公认药品持证商更新为FreseniusKabi AB27-104 米力农注射液MilrinoneInjection/Primacor 1mg/mlSolution forInjection10mg/10mlAventis PharmaLimited/Sanofi-Aventis/Sanofi未进口原研药品规格更新为10mg/10ml备注1.未在国内上市品种,需参照原食品药品监管总局2015年第230号公告等的相关要求开展研究,通用名、剂型等经药典委核准后为准。


创新药、仿制药、原研药为规范药品注册行为,保证药品的安全、有效和质量可控,《药品注册管理办法》(以下简称《办法》)将药品分为中药、化学药和生物制品进行管理。
其中,化学药可以分为化学药创新药、化学药改良型新药、仿制药等类别。
至于更为细化的分类,《办法》则授权国家药品监督管理局根据注册药品的产品特性、创新程度和审评管理需要组织制定。
国家药监局根据《办法》于2020年6月发布化学药品注册分类及申报资料要求的通告,将化学药分为5个类别进行管理。
化学药品注册分类分为创新药、改良型新药、仿制药、境外已上市境内未上市化学药品,分为以下5个类别:1类:境内外均未上市的创新药。
2类:境内外均未上市的改良型新药。
3类:境内申请人仿制境外上市但境内未上市原研药品的药品。
4类:境内申请人仿制已在境内上市原研药品的药品。
5类:境外上市的药品申请在境内上市。
通告中明确了原研药的概念。
原研药品是指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
根据通告,我们可以归纳总结出创新药和仿制药的相关概念。
创新药是指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品,通常称first in class。
改良型新药指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
通常指me better。
改良主要包含4种,分别是结构改良、剂型改良、新复方制剂和新适应症,前3种改良要求具有明显临床优势。
创新药(first in class)和改良型新药(me better)统称为新药,此处的新是指境内外都新,即全球新。
在境外已上市在境内未上市的药品分为第5类,不属于新药。
仿制药是仿制原研药的药品,根据仿制的标的分为两类,一是仿制境外原研药(境内没有)的药品(第3类);二是仿制境内的原研药的药品(第4类)。
仿制药与新药的注册流程不同,仿制药要求药品应与参比制剂的质量和疗效一致。
国家药品监督管理局关于同意辛伐他汀片以人体相对生物利用度研究代替临床试验的批复
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】1999.01.22
•【文号】药管注[1999]18号
•【施行日期】1999.01.22
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局关于同意辛伐他汀片
以人体相对生物利用度研究代替临床试验的批复
(药管注[1999]18号)
浙江省卫生厅:
你厅浙卫药(1998)253号收悉。
鉴于辛伐他汀片国内已批准进口多年,临床应用广泛,疗效、安全性肯定,经研究,同意清华紫光(集团)总公司与浙江长兴制药有限公司研制的该产品免作临床验证,仅进行以进口品作对照的人体生物等效性试验。
此复。
国家药品监督管理局药品注册司
一九九九年一月二十二日。