原研药与仿制药.ppt
- 格式:ppt
- 大小:4.18 MB
- 文档页数:6


原研药与仿制药品的区别(1)
原研药是指由药企从药物发现、开发到临床试验和申报上市等全过程
自主完成并取得新药批准文号的药品,具有独特的创新性、研发难度
较高和市场风险大等特点。
而仿制药是指依据原研药的安全和有效性
数据,经过合法程序、在专利保护期过后由其他药企生产的药品,其
品质、疗效和安全性均与原研药相当。
原研药与仿制药的区别主要体现在以下几个方面:
1. 创新性和专利保护:原研药具有独特的创新性,其研发过程需要进
行较长时间的预研、临床实验等工作,对药企的研发投入、计划和控
制能力要求较高。
而仿制药生产厂家无需再进行这些工作,也不存在
专利保护,可以在原研药专利期限过后立即生产和销售,降低了厂家
的研发成本和周期。
2. 价格和市场竞争:由于原研药生产商在研发过程中投入较高,还需
要进行大量的临床试验和营销宣传,从而导致原研药的价格较高,这
也是其与仿制药品最为显著的区别之一。
另外,由于仿制药在生产上
的成本较低,价格更加亲民,因此对市场的销售竞争也更加激烈。
3. 稳定性和规范性:原研药生产过程中需要严格的品质控制和审核,
确保每批产品的质量稳定可靠,同时也需要遵守国家的相关法规政策。
而仿制药厂商的生产过程相对更加简单,监管也更加宽松,这也意味
着一些生产不规范的仿制药可能存在安全隐患。
综上所述,原研药和仿制药在研发、价格以及市场竞争等方面存在着
明显的差别。
虽然两者均可用于治疗疾病,但是在使用过程中还需要
注意剂量和不良反应等问题,以进一步确保治疗效果和安全性。








原研药、仿制药、原料药有何区别⊙江西省九江市江西兄弟医药有限公司 朱 勇原研药、仿制药、原料药都属于药物,但是三者之间却存在着明显的差别。
对3种药物概念进行详细的解读并发现其中存在的差异,对于正确认识药物、选择药物有积极的意义。
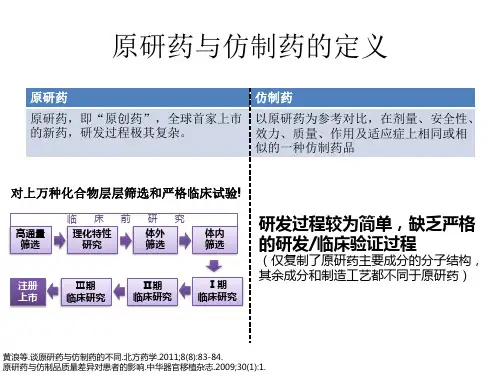
原研药所谓原研药,就是正版药,是指原创性的药物,是在经过对成千上万种化合物做层层筛选和严格的临床试验后,得以获准上市的药物。
从一般情况来看,原研药所花费的研发时间比较长,以目前的原研药实践为例做分析,一般周期为5~15年,投入的成本通常都大得惊人。
原研药上市一般需要经历如下步骤:(1)立项,这是原研药上市的基础环节之一,一般消耗周期为4个月左右。
(2)临床前研究,主要指的是基础资料的收集,这个过程一般为9~24个月。
(3)临床研究申请,这个环节是原研药研发过程中必须要强调的内容,一般的周期在1年以上。
(4)临床试验批件。
(5)临床研究,主要指的是药物的临床试验效果研究,一般的周期是3~5年。
(6)生产申请,在临床研究的基础上总结药物实效,并基于药物的具体效果提出生产申请,一般的周期为1年以上。
(7)受理通知书后的审核与现场考察,主要是确定药物生产的安全性。
(8)获批生产上市,一般的时间周期是6个月。
(9)监测期,即对出售药物的临床效果等进行监测,以此来收集更加广泛的药物数据。
从原研药的生产步骤入手做分析可知,原研药生产环节众多,且各个环节都会有巨大的成本消耗,所以原研药在刚刚进入市场的时候,其价格比较高。
仿制药原研药受到专利的保护,当专利到期之后,其他公司就可以申请制造并销售这类药,这就形成了仿制药。
“仿制药”与“原研药”具有相同的活性成分,相同的规格,相同的给药途径,还与原研药有相同的通用名。
仿制药复制原研药的主要分子结构,省时省资省力,研发成本低,故价格上一般会比原研药便宜许多。
但仿制药与原研药一样要经过程序化审批,是法律认可的药品,疗效也相当。
在《我不是药神》这部电影中,徐峥饰演的药贩子所售卖的印度仿制药便是原研药格列卫的仿制药。
原研药与仿制药品的区别-V1原研药与仿制药品的区别随着医疗技术的不断发展,药物种类也在不断丰富。
在药品市场中,原研药和仿制药品是两种重要的药物类型。
虽然两者都可以用于治疗疾病,但它们之间存在着一些区别。
1. 定义原研药指最早研制出该药物的制药公司生产的药品。
这些药品具有原始的治疗成分、剂量和性质。
它们经过多年的研究和开发,花费巨额资金用于安全性和效益的评估,因此其价格相对较高。
仿制药品是在原研药专利期满后,其他制药公司研制出来的药品。
它们与原研药相似,具有相同的治疗成分、剂量和性质,但因为不需要投入研究和开发费用,并且没有进行安全性和效益评估,所以价格相对较低。
2. 研发和生产原研药的研发需要投入大量的研究和开发费用,并经历多个阶段的严格审查,包括临床试验、审核等程序。
这些步骤通常需要3-10年的时间,然后才能获得药品上市许可。
原研药公司通常承诺为治疗某种疾病提供足够的生产能力。
仿制药品的研发相对简单,需要复制原研药的成分和剂量,以确保其具有相同的治疗效果。
在原研药专利期满后,其他制药公司可以使用与原研药相同的技术和方法生产仿制药品。
由于其生产流程相对简单,所以它们通常比原研药的价格低很多。
3. 包装和质量原研药通常在优质的生产环境中生产,包装和质量控制也严格。
包装上通常有该药品的商标和专利号码。
仿制药品的包装通常不带商标和专利号码。
其质量控制也相对松散,因为它们不需要研究公司进行研究和开发费用来评估其质量。
4. 安全性和有效性原研药的安全性和有效性已经通过了多个阶段的严格评估和临床试验,经过FDA或其他国家的药品监管机构批准上市。
因此原研药通常被认为是更安全和更有效的治疗方法。
仿制药品与原研药具有相同的治疗成分和剂量,因此它们具有相同的治疗效果。
但由于它们没有接受原始药的严格安全性和有效性评估,因此在确保安全性和有效性方面仍存在一些风险。
总结原研药和仿制药品是两种不同的药品类型。
原研药经过多年的研究和开发,具有更昂贵的价格,但它们通常被认为是更安全和更有效的治疗方法。
创新药、仿制药、原研药为规范药品注册行为,保证药品的安全、有效和质量可控,《药品注册管理办法》(以下简称《办法》)将药品分为中药、化学药和生物制品进行管理。
其中,化学药可以分为化学药创新药、化学药改良型新药、仿制药等类别。
至于更为细化的分类,《办法》则授权国家药品监督管理局根据注册药品的产品特性、创新程度和审评管理需要组织制定。
国家药监局根据《办法》于2020年6月发布化学药品注册分类及申报资料要求的通告,将化学药分为5个类别进行管理。
化学药品注册分类分为创新药、改良型新药、仿制药、境外已上市境内未上市化学药品,分为以下5个类别:1类:境内外均未上市的创新药。
2类:境内外均未上市的改良型新药。
3类:境内申请人仿制境外上市但境内未上市原研药品的药品。
4类:境内申请人仿制已在境内上市原研药品的药品。
5类:境外上市的药品申请在境内上市。
通告中明确了原研药的概念。
原研药品是指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
根据通告,我们可以归纳总结出创新药和仿制药的相关概念。
创新药是指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品,通常称first in class。
改良型新药指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
通常指me better。
改良主要包含4种,分别是结构改良、剂型改良、新复方制剂和新适应症,前3种改良要求具有明显临床优势。
创新药(first in class)和改良型新药(me better)统称为新药,此处的新是指境内外都新,即全球新。
在境外已上市在境内未上市的药品分为第5类,不属于新药。
仿制药是仿制原研药的药品,根据仿制的标的分为两类,一是仿制境外原研药(境内没有)的药品(第3类);二是仿制境内的原研药的药品(第4类)。
仿制药与新药的注册流程不同,仿制药要求药品应与参比制剂的质量和疗效一致。