3-4 双原子分子光谱
- 格式:ppt
- 大小:4.51 MB
- 文档页数:39



第四章振动光谱一、教学目的理解掌握震动光谱分析的基本理论,掌握红外光谱图的分析处理,了解红外光谱实验技术。
二、重点、难点重点:震动光谱分析的基本理论,红外光谱图的分析处理。
难点:震动光谱分析的基本理论。
三、教学手段多媒体教学四、学时分配4学时引言:●1900~1910年间,科布伦茨(W.W.C。
blentz)首先用红外光测量了一些有机物液体的吸收光谱而建立起一种新的分析方法——红外光谱法。
他发现分子中的一定原子群可以吸收特定的频率,这些特定的频率犹如人类的指纹,可以用来辨认分子中特定原子群的存在。
●它主要可以用作分子结构的基础研究和物质化学组成(物相)的分析(包括定性和定量)。
红外光谱法作分子结构的研究可以测定分子的键长、键角大小,并推断分子的立体构型,或根据所得的力常数,间接得知化学键的强弱,也可以从正则振动频率来计算热力学函数等。
●不过红外光谱法更多的用途是根据谱的吸收频率的位置和形状来判定本知物,并按其吸收的强度来测定它们的含量。
因此红外光谱法在目前已成为十分方便而有效的分析方法之一。
●红外光谱法应用得较多的是在有机化学领域,对无机化合物和矿物的红外鉴定开始较晚。
红外光谱法对测定矿物的结构或组分虽不如X射线衍射分析那么成熟,却也有其独特长处。
所谓振动光谱是指物质因受光的作用,引起分子或原子基团的振动,从而产生对光的吸收。
如果将透过物质的光辐射用单色器加以色散,使波长授长短依次排列,同时测量在不同波长处的辐射强度,得到的是吸收光谱。
如果用的光源是红外光波,即0.78~1000μm,就是红外吸收光谱。
如果用的是强单色光,例如激光,产生的是激光拉曼光谱。
本章主要介绍红外光谱的原理及其在无机非金属材料中的应用,对拉曼光谱只作简单的介绍。
红外光谱法就逐渐形成了一个极其有效而广泛的分析方法。
它主要可以用作分子结构的基础研究和物质化学组成(物相)的分(包括定性和定量)。
红外光谱法作分子结构研究可以测定分子的键长、键角大小,并推断分子的立体构型,或根据所得的力常数,间接得知化学键的强弱,也可以从正则振动频率来计算热力学函数等。

第3章双原子分子的结构与分子光谱习题答案1. CO是一个极性较小的分子还是极性较大的分子?其偶极距的方向如何?为什么?解:CO是一个异核双原子分子。
其中氧原子比碳原子多提供2个电子形成配位键::C=0:氧原子的电负性比碳原子的高,但是在CO分子中,由于氧原子单方面向碳原子提供电子,抵消了部分碳氧之间的电负性差别引起的极性,所以说CO是一个极性较小的分子。
偶极矩是个矢量,其方向是由正电中心指向负电中心,CO的偶极距4 = 0.37 10-30c m,氧原子端显正电,碳原子端显负电,所以CO分子的偶极距的方向是由氧原子指向碳原子。
2. 在N2, NO , O2, C2, F2, CN, CO, XeF中,哪几个得电子变为AB-后比原来中性分子键能大,哪几个失电子变为AB+后比原来中性分子键能大?解:就得电子而言,若得到的电子填充到成键电子轨道上,则AB-比AB键能大,若得到得电子填充到反键分子轨道上,则AB-比AB键能小。
就失电子而言,若从反键分子轨道上失去电子,则AB+比AB键能大,若从成键轨道上失去电子,则AB+比AB键能小。
2 2 4 2(1) N2 :(1「g) (1%) (V:u) (2^) 键级为3N2 :(l-g)2(l u)2(V:u)4(^g)1键级为2.5N2—:(16)2(1%)2(1L)4(26)2(2二u)1键级为2.5N2的键能大于N2+和N2的键能(2) NO : (1-)2(2-)2(1T)4(3-)2(27.)1键级为 2.5NO : (1;「)2(2二)2(1二)4(3二)2键级为32 2 4 2 2 ”NO:(1G (2G (1 二)(3匚)(2二) 键级为2所以NO的键能小于NO+的键能,大于NO-的键能⑶亠 2 2 2 2 2 4 1O2 :1;「g1;「u2;「g2;「u3;键级为2.5,2 2 2 2 2 4 2O2 :1;初汛2 汪2;二3汪1 二u1 二g 键级为2,2, 2 c 2 c 2小2, 4, 3O2 :1汪1汛2汪263;[1—1二9键级为1.5, 所以。

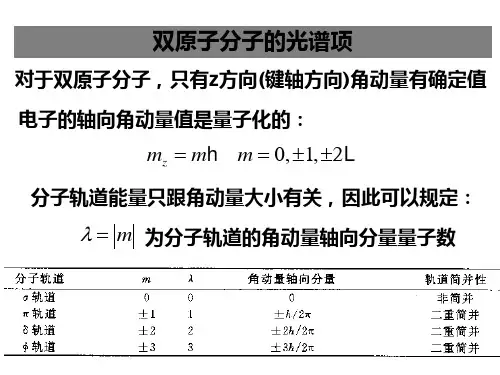
双原子分子光谱分子的能量状态与原子的能量状态一样存在能级,而且分子能级发生跃迁时发射或吸收辐射。
然而分子同原子相比,由于它的结构和运动状态的复杂性,分子光谱比原子光谱复杂得多。
双原子分子光谱是较简单的分子光谱。
分子光谱随分子能级跃迁间隔的不同,可以出现在从紫外到微波的不同光谱区。
本实验的目的是通过拍摄双原子分子的电子一振动光谱,来了解分子光谱的特点,测量各顺序谱带组的带头波长,计算分子的振动频率ω、非筒谐性常数ωx 和分子振动力常数k 等。
【预习提要】双原子分子是结构较为简单的分子。
因而反映分子结构特征和举动状态的双原子分子光谱也是较简单的分子光谱。
用色散率不大的摄谱仪伯摄的双原子分子光谱呈现带状,实际上,它们是由大量的、密集的、分布有规律的谱线所组成的。
不同波段的谱线反映分子不同运动状态的能级跃迁。
1.双原子分子有哪些不同形式的能量,怎样利用“不确定性关系”说明不同形式的能级间隔之间的数量关系?2.用莫尔斯函数表示双原子分子的势阱时,分子振动能级间隔有什么特点?3.什么叫顺序带组,试说明相邻顺序谱组带头的波数差出现“突变”的能级结构的内在原因。
4.试判断(0,0),(1,0)和(0,1)顺序带组列出b a ,或b a '',的测定方程和相应的正则方程。
5.利用近似的谐振子频率公式,求出分子振动力常数值。
【实验原理】一、双原子分子的结构与运动状态双原子分子是由两个原子核和电子相互结合而成的微观系统。
当两个原子相结合而构成一个双原子分子时,在每个原子内部构成完整壳层的电子仍然分别属于各自的原子核,而外层的价电子向对方原子核提供库仑引力,当两核过于靠近时产生斥力,从而使两个原子核相距一定地联系在一起构成稳定的结构。
分子具有三种基本运动:①外层价电子在两个原子核共同产生的电场中绕核间轴的运动,这种运动如同价电子在孤立的原子中运动一样形成各种不同的电子能量状态。
②双原子分子的原子核由于交替地受到来自对方价电子的引力和核的斥力,在平衡位置附近,带着其周围的电子沿核间轴方向振动,伸缩核间轴长短。


第九章分子光谱和分子结构前面我们从原子光谱、原子磁性了解了原子的结构,但在生产实践和生活中接触的物体极少是孤立的原子,往往是由原子结合而成的分子或分子集团,它是物质结构的一个重要层次.本章将简要介绍分子光谱和分子结构.§9.1 分子光谱和分子能级一、分子与化学键分子由原子组成,原子通过它们间的相互作用而结合在一起.而分子中相邻原子间存在的各种不同形式的相互作用称为化学键.化学键的力是电性质的,它只与原子的外层电子有关,与原子的内层电子关系较少.这是因为各元素的物理、化学性质的周期性由最外层电子的运动决定;而且较重元素的标识X射线不因该元素所在化合物而不同.内层电子在分子中和孤立原子中几乎一样,但价电子则大不相同.原子价电子间不同的结合会形成不同的化学键,常见的二类化学键是离子键和共价键,一般还有金属键和Van der Waals键. 1.离子键当电离能很小的金属原子(如碱金属和碱土金属原子价电子易脱落)和电子亲合能很大的非金属原子(如卤族原子和氧族非金属原子容易吸往电子)非常接近时,前者失去价电子而成为正离子,后者获得前者失去的电子而成为负离子,正负离子由于Coulomb力相互吸引结合成分子;但当二离子由于运动惯性而过分接近时,它们的外层电子相互排斥的力变得显著,表现为离子间的互斥力.当引力和斥力相等时,就形成稳定的分子.这种化学键称为离子键.如NaCl分子是由Na+离子与Cl-离子组成的离子键分子.Na是碱金属元素,具有较小的电离能5.14eV,电离过程为Na + 5.14eV →Na+ + e-Cl是卤族元素,Cl原子最外层在3p上有5个电子,再得到一个就构成稳定的闭合壳层,所以吸收一个电子形成Cl -离子是放能过程,这个能量称为亲合能,Cl-的亲合能为3.72eV ,此过程为Cl + e - →Cl - + 3.72eV上述两过程共增能5.14eV -3.72eV =1.42eV .虽然Na 、Cl 原子形成Na +、Cl -离子后能量增加了,但当它们相互接近时,由于正负离子的电荷将引起Coulomb 吸引位能,因此Na +、Cl -离子体系能量有可能小于Na 、Cl 原子体系的能量.ٛ 图9-1中的两条曲线分别表示离子和原子体系的位能变化.选Na 原子和Cl 原子相距无穷远时的位能为零点能,横坐标表示两离子或原子间距离,可以看到当距离小于某一数值后,离子间的位能将小于原子间的位能.ٛNa +、Cl -离子体系的位能曲线有一极小值,这是由于距离小到一定值后,两带正电原子核的Coulomb 斥力位能迅速增加,距离越小,此能量越大.位能曲线最低点对应的距离以r 0表示,称平衡距离.如NaCl 分子的r 0=2.51Å,其位能为-3.58eV .作用力方向总是指向位能减小的方向.当r >r 0时,位能曲线斜率为正,作用力使离子间距离减小,为吸引力;当r <r 0时,位能曲线斜率为负,作用力使距离增加,为斥力;当r = r 0时,位能曲线斜率为零,作用力亦为零,所以Na+、Cl-离子有可能在r 0附近振动,形成稳定的NaCl 分子.图9-1 NaCl分子的位能曲线2.共价键许多由两个相同原子组成的双原子分子和绝大多数有机化合物的分子不是由离子组成的,它们的化学键不再是离子键.它们有一对或多对电子为两个原子共有,内层电子仍然属于原来的原子.这类分子称为共价键分子或称原子键,同极键分子.如两个氢原子靠近时,每个氢原子中电子的状态都将重新分布,使系统处于能量最低的状态,这时两个电子起着连结两个原子的作用,为两个核所共有.从量子力学分析而知这一对组成共价键的电子自旋必是反平行的.一般地说,原子外层电子中,有未组成自旋相反的电子对的电子,就有可能与其它原子中未组成电子对的电子结合成共价键.如氢原子只有一个外层电子,显然在原子中不可能与其它电子组成自旋相反的电子对,这个电子就有可能与另一氢原子中同样的电子结合成共价键.锂原子有3个电子,而2s 态的外层电子未能与其它电子组成自旋相反的电子对,因此能与另一锂原子中的2s 电子组成共价单键,成为锂的双原子分子.如果两个原子各有两个或三个未成对的电子,则俩俩配对可构成共价双键或三键.共价键构成的分子可分为两类.第一类是无极分子,它由同类原子构成.如H 2、O 2等,分子内键电子分布对称,正负电荷“重心”重合,因而分子不具有电偶极矩.另一类是有极分子,由不同类原子组成.如HCl ,两种原子对电子的亲合力不同,分子内键电子的分布不对称,正负电荷“重心”不重合,分子具有电偶极矩. 图9-2 分子带光谱二、分子光谱原子光谱的特征是线状光谱,一个线系中各谱线间隔都较大,只在接近线系极限处越来越密,该处强度也较弱;若原子外层电子数目较少,谱线系也为数不多.分子光谱的一般分布如图9-2所示.许多谱线形成一段一段的密集区域成为连续带状,称为光谱带.所以分子光谱的特征是带光谱.它的波长分布范围很广,可出现在远红外区(波长是cm 或mm 数量级)、近红外区(波长是μm 数量级)、可见区和紫外区(波长约在10-1μm 数量级).分子光谱一般具有如下规律:(1)由光谱线组成光谱带;(2)几个光谱带组成一个光谱带组;(3)几个光谱带组组成分子光谱.ٛ三、分子能级据实验观察,分子光谱是由远红外光谱、近红外光谱、可见光和紫外光谱交织在一起的光谱.而远红外光谱是由于分子转动能级的变化引起的;近红外光谱是分子既有振动能级又有转动能级改变时产生的;而可见光和紫外光谱是分子既有电子能级又有振动和转动能级变化时产生的.所以分子内部既有分子转动,又有分子的振动,还有分子中电子的运动.ٛ1.分子的转动和转动能级即将分子看作一个整体绕某轴而转动.对于双原子分子,其转动轴通过分子的质心并垂直于分子轴(原子核间的联线).转动能量是量子化的,因而形成转动能级.转动能级的间隔约10-4~10-2eV.ٛ2.分子的振动和振动能级即组成分子的各原子在其平衡位置附近所做的微小振动.如双原子分子沿着轴线振动.与振动相联系的能量称为分子的振动能.振动能量也是量子化的,因而形成振动能级.振动能级间隔约10-1eV.3.分子中的电子运动和电子能级ٛ分子中外层电子的运动形成一些定态,电子在定态间跃迁运动.这些定态各具有一定能量,也就形成了电子的能级.当分子的电子能级间产生跃迁就产生光谱.电子能级间隔约为eV量级.ٛ若用E转、E振、E电分别代表上述三种运动状态的能量,分子能量可表示为E = E转 + E振 + E电(9-1)这三种能量的变化满足Δ>Δ>ΔE E E(9-2)振电转这样,在电子能级之上可以有较小间隔的振动能级;在振动能级之上又可以有更小间隔的转动能级.这些关系如图9-3所示,图中表示了振动能级和转动能级的特点,一组振动能级的间隔随能级的上升而减小;一组转动能级的间隔随着能级的上升而增加.由于分子能级的复杂结构,从而使分子光谱比原子光谱更复杂.图9-3 双原子分子能级示意图§9.2 分子的转动能级和转动光谱在辐射过程中,分子的电子状态和振动状态都没有改变,则辐射仅由分子的转动状态的改变而引起.由于△E 转ٛ最小,相应光子的能量很小,所产生的光谱一般在远红外区域.一、分子的转动能级假设分子是刚性分子.由于刚性分子不改变原子核间相对距离,所以它的转动是一个纯粹的转动,此简化模型忽略了振动对转动的影响.对双原子分子,其转动轴是通过质心而垂直于联接二原子核的直线的.分子的转动惯量ٛ (9-3) 2r I μ=其中1212m m m m μ=+是折合质量,r 是两原子核间的距离,如图9-4所示.对刚性分子r 是常数.若分子的转动角动量为P J .据经典力学,分子的转动动能IP I E J J 22122==ω (9-4) 其中P J =I ω,因为转动是自由的,所以势能为零,而体系总能量就等于转动动能.分子是微观粒子,它的角动量是量子化的,即=)1(+=J J P J ⋅⋅⋅=,,,,3210J (9-5)图9-4 刚性双原子分子的转动 J 称为转动量子数.代入(9-4) 式可得转动能级)1(22+=J J I E J = (9-6)由此所得能级图如图9-5所示.相邻二转动能级的间距ٛ)1(21+=−=Δ+J J IE E E J J J = (9-7)图9-5 双原子分子转动能级 可见转动能级的分布不是等间距的,J 越大,间隔也越大.ٛٛ二、分子的转动光谱实验和理论都证明转动能级间的跃迁须服从电偶极跃迁选择定则ٛ 1±=ΔJ (9-8)ΔJ =+1相当于吸收过程,ΔJ =-1相当于发射过程.当从能级J +1跃迁到能级J 的辐射频率12(1)2(14J J J J E E E h v J h h Iπ+)B J Δ−===+=+ (9-9)其中I hB 28π=称为转动常数.以波数表示2(1)Jv B J =+ B (9-10) 相邻二谱线间的波数差。


双原子分子振动转动光谱双原子分子振动转动光谱2010-05-10 16:35双原子分子通常同时具有振动和转动,振动能态改变时总伴随着转动能态的改变,产生的光谱称为振动-转动光谱,其波长范围一般位于红外区。
双原子分子的纯振动作为初步近似,可以先忽略双原子分子的转动,只考虑分子的振动。
实际分子的原子核振动不是严格的简谐振动。
采用非简谐振子模型,把质量为M1和M2的原子核相对振动视为具有折合质量的单一质点在平衡位置re附近作非简谐振动,这个质点处于分子的原子核的有效势能场(分子中电子能量与原子核库仑排斥势能之和)中。
势能函数包含偏离平衡位置的位移量的二次幂项和更高次幂项。
这时,分子的振动能级的能量值为相应的光谱项为式中h为普朗克常数,с为真空中光速,υ为振动量子数,为分子的经典振动频率,Ke为振动力常数。
式(2)中等号右边第一项是简谐振子的振动光谱项;其后各项是非简谐振动的修正项,wexe和weye为非简谐性常数。
通常可以忽略更小的高次项,但当光谱仪器分辨率很高时以及在激光光谱学研究中应予考虑。
分子的最低振动态(υ=0)的能量值E0不为零,称为零点能。
图1为双原子分子在电子基态下的振动能级示意图。
双原子分子的势能可以用经验公式表示,莫尔斯势能函数是广泛采用的一种形式。
如图1中实曲线所示。
式中De称为分子离解能,β是与电子态有关的参数。
取r=re处的势能U=0;当r→∞时,势能曲线趋于水平渐近线,这时分子被离解。
从势阱底部算起的离解能是De,从υ=0能级算起的离解能是D0(见分子的离解能)。
双原子分子的振动-转动同时考虑分子的振动和转动时,转动能量可以看成是振动能量的微扰。
按照转动振子模型,对给定非简谐振子势能曲线的确定电子态,振动-转动能级的能量值可用下式表示相应的光谱项为式中Bv、Dv是振动态υ的转动常数。
转动振子光谱项表示为非简谐振子振动光谱项G(υ)与转动光谱项Fv(J)之和,其中转动谱项不仅与转动量子数J有关,而且由于分子的振动-转动相互作用,还与振动量子数υ有关。