3. 双原子分子
- 格式:pdf
- 大小:3.80 MB
- 文档页数:54



第3章双原子分子的结构与分子光谱习题答案1. CO是一个极性较小的分子还是极性较大的分子?其偶极距的方向如何?为什么?解:CO是一个异核双原子分子。
其中氧原子比碳原子多提供2个电子形成配位键::C=0:氧原子的电负性比碳原子的高,但是在CO分子中,由于氧原子单方面向碳原子提供电子,抵消了部分碳氧之间的电负性差别引起的极性,所以说CO是一个极性较小的分子。
偶极矩是个矢量,其方向是由正电中心指向负电中心,CO的偶极距4 = 0.37 10-30c m,氧原子端显正电,碳原子端显负电,所以CO分子的偶极距的方向是由氧原子指向碳原子。
2. 在N2, NO , O2, C2, F2, CN, CO, XeF中,哪几个得电子变为AB-后比原来中性分子键能大,哪几个失电子变为AB+后比原来中性分子键能大?解:就得电子而言,若得到的电子填充到成键电子轨道上,则AB-比AB键能大,若得到得电子填充到反键分子轨道上,则AB-比AB键能小。
就失电子而言,若从反键分子轨道上失去电子,则AB+比AB键能大,若从成键轨道上失去电子,则AB+比AB键能小。
2 2 4 2(1) N2 :(1「g) (1%) (V:u) (2^) 键级为3N2 :(l-g)2(l u)2(V:u)4(^g)1键级为2.5N2—:(16)2(1%)2(1L)4(26)2(2二u)1键级为2.5N2的键能大于N2+和N2的键能(2) NO : (1-)2(2-)2(1T)4(3-)2(27.)1键级为 2.5NO : (1;「)2(2二)2(1二)4(3二)2键级为32 2 4 2 2 ”NO:(1G (2G (1 二)(3匚)(2二) 键级为2所以NO的键能小于NO+的键能,大于NO-的键能⑶亠 2 2 2 2 2 4 1O2 :1;「g1;「u2;「g2;「u3;键级为2.5,2 2 2 2 2 4 2O2 :1;初汛2 汪2;二3汪1 二u1 二g 键级为2,2, 2 c 2 c 2小2, 4, 3O2 :1汪1汛2汪263;[1—1二9键级为1.5, 所以。

同核双原子分子双原子分子是由一个原子核和两个电子构成的。
但是,两个原子核中的电子数目不一定相等。
如氢分子由一个原子核和两个质子构成,而其中的电子数却为三个,即电子层数为三。
但还有一些化合物,它们的两个原子核都是由一个质子和一个中子构成,但它们的电子层数却都为七个。
又如氯分子由一个原子核和三个质子构成,而其中的电子数却为六个,即电子层数为六。
当一个正离子与一个负离子结合时,就会出现多种同核双原子分子。
例如,二氧化硅分子由两个硅原子和一个氧原子构成,但这两个原子核中的电子数目并不相等,其中氧原子有四个电子,硅原子却只有一个电子。
二氧化硅分子由于存在多种同核双原子分子,才使得单晶硅片具有很高的折射率,可以应用于制造光学仪器和电子工业中,还可用于制作防辐射玻璃、 X射线屏幕等。
此外,二氧化硅还能被人们制成大理石和各种装饰品,如普通的文石可做成各种台面。
将精制的文石切磨成很小的薄片,贴到墙上,就变成了精美的壁纸。
把文石晶体掺进玛瑙里,经过加工后,便形成了非常美丽的珠宝——玛瑙珠。
还有,天然放射性铀235的衰变产物三铀氧钒具有“闪闪发光”的奇异色彩,很像黄金,所以又称三铀氧钒为黄金金属,即黄金铀。
一些黄金矿藏、铀矿床或冶炼厂的废水中,常含有大量的黄金铀,工业上可提取黄金,故而常被称为“天然放射性元素”。
此外,其它类似的有关黄金的同核双原子分子还有:铀、钍、镤、铒、铥、镱、镥等。
同样的事例也发生在含有稀有气体元素的化合物中,例如,氙原子的电子层结构为7S2,有3个电子层,所以有3个电子,由于含有稀有气体元素,因此有强烈的放射性,其放射性比镭强15倍。
在放射源中,它是强射线。
稀有气体元素还有氪、氡、氙、氡等,它们都是放射性元素,具有放射性。
虽然由于它们在空气中含量很少,但在人体内累积到一定程度时,仍可引起疾病。
此外,许多稀有气体元素在特定条件下还能够互相转化。
例如,氟有5个价态,即正5价、负5价、正4价、负4价和零价。


第三章双原子分子的结构和性质习题第三章共价键和双原子分子的结构习题一、是非题1.在LCAO-MO 中,所谓对称性匹配就是指两个原子轨道的位相相同。
2.两个能量不同的原子轨道线性组合成两个分子轨道。
在能量较低的分子轨道中,能量较低的原子轨道贡献较大;在能量较高的分子轨道中,能量较高的原子轨道贡献较大。
3.凡是成键轨道都具有中心对称性。
二、填空题1.描述分子中_______________空间运动状态的波函数称为分子轨道。
2.由原子轨道有效地形成分子轨道的条件为。
3.设φA 和φB 分别是两个不同原子A 和B 的原子轨道,其对应的原子轨道能量为E A 和E B ,如果两者满足________,____________,______原则可线性组合成分子轨道=c A φA +c B φB 。
对于成键轨道,如果E A ______E B ,则c A ______c B 。
(注:后二个空只需填"=",">"或"等比较符号)4.C 2+的分子轨道为_________________,键级___________________;5.按照简单分子轨道理论:(1)HF 分子基组态电子排布为___________________________,键级_______________,磁性________________。
(2)O 2-离子基组态电子排布为_____________________________,键级_______________,磁性________________。
6.写出CN -的价电子组态及键级。
7.下列分子中,键能比其正离子的键能小的是____________________。
键能比其负离子的键能小的是________________________。
O 2,NO ,CN ,C 2,F 28.O 2的键能比O 2+的键能_____________。

第三章 双原子分子结构3.1 +2H 的结构及共价键的本质基本内容—、定核近似和+2H 的薛定谔方程A BRe r e r e m H b a 02020*******ˆπεπεπε+--∇-= 我们常采用原子单位:单位长度:Pm e m h a e 9177.524422200==ππε(玻尔半径)单位质量:me=9.1095×10-31Kg (电子质量) 单位电荷:e=1.60219×10-19C (电子电量) 单位能量:024a e πε=27.2116eV单位角动量: =1.0546×10-34 J.S 单位介电常数:04πε=1采用原子单位、+2H 的哈密顿算符为:Rr r Hba 11121ˆ2+--∇-=其薛定谔方程为:ψψE Rr r b a =+--∇-)11121(2,式中E 、ψ分别为+2H 的波函数和能量。
二、变分原理及性线变分法 1. 变分原理对于任意一个品优波函数ψ,用体系的Hˆ算符求得的能量平均值将大于或接近等于体系基态的能量E 0即:*ˆ*E d d H E ≥>=<⎰⎰τψψτψψ 据此原理,利用求极值方法调节参数,找出能量最低时对应的波函数,即为和体系基态相近似的波函数。
2. 线性变分法在量化计算中,广泛采用的是线性变分函数,它是满足体系边界条件的 个线性无关的函数m φφφ,,,21 的线性组合:m m C C C φφφψ+++= 2211采用线性变分函数的变分法叫线性变分法。
根据变分原理求得使E 最低的一组组合系数Ci⎰⎰++++++++++++=τφφφφφφτφφφφφφd C C C C C C d C C C H C C C E m m mm m m m m ))(()(ˆ)(2211***2*2*1*12211***2*2*1*1mC EC E C E ∂∂==∂∂=∂∂ 21=0 由此得一组求解Ci 的m 个联立方程称为久期方程,运用线性代数法求得m 套非零解,由其中与最低E 相对应的一套解C 1,C 2,……,C m 便可组成基态分子轨道波函数,所对应的E 便是基态能量近似值。


双原子分子结构、填空题(在题中空格处填上正确答案)3101、描述分子中________________ 空间运动状态的波函数称为分子轨道。
3102、在极性分子AB中的一个分子轨道上运动的电子,在A原子的A原子轨道上出现的概率为80%, B原子的B原子轨道上出现的概率为20%,则该分子轨道波函数。
3103、设A和B分别是两个不同原子A和B的原子轨道,其对应的原子轨道能量为E A和E B,如果两者满足___________ ,_______________ , _______ 原则可线性组合成分子轨道=C A A + C B B。
对于成键轨道,如果E A_________ E B,贝U C A _____C B。
(注:后二个空只需填"=",">"或”等比较符号)3104、试以Z轴为键轴,说明下列各对原子轨道间能否有效地组成分子轨道,若可能,则填写是什么类型的分子轨道。
3105、判断下列轨道间沿z轴方向能否成键。
如能成键,则在相应位置上填上分子轨道的名称。
3106、AB为异核双原子分子,若A dyz与B P可形成型分子轨道,那么分子的键轴yzy编辑版word为____ 轴。
3107、若双原子分子AB的键轴是z轴,则A的d yz与B的P y可形成_________________ 型分子轨道。
3108、以z轴为键轴,按对称性匹配原则,下列原子轨道对间能否组成分子轨道?若能,写出是什么类型分子轨道,若不能,写出”不能",空白者按未答处理。
________________ ,磁性 _________________ 。
3110、在z方向上能与d xy轨道成键的角量子数l w 2的原子轨道是 _______________ 形成的分子轨道是___________ 轨道。
3111、在x方向上能与d xy轨道成键的角量子数K 2的原子轨道是__________________ 3112、用分子轨道表示方法写出下列分子基态时价层的电子组态:N2:_______________________________ ,02: ____________________________ 。
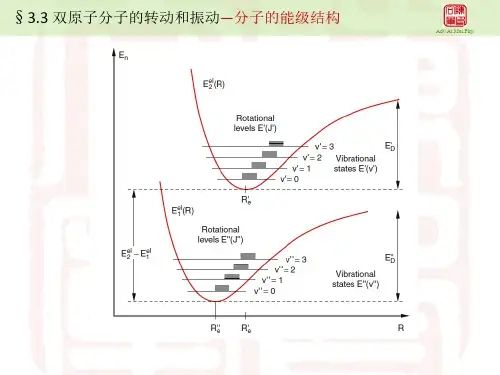
双原子分子的自由度
分子自由度是物体运动方程中可以写成的独立坐标数,单原子分子有3个自由度,双原子,三原子不考虑振动相当于刚体,分别有5个(3平2转)、6个自由度(3平3转),考虑振动后,双原子加1个,非线性加3个,线性加四个。
分子自由度
(1)单原子分子:如氦He、氖Ne、氩Ar等分子只有一个原子,可看成自由质点,所以有3个平动自由度i = t = 3。
(2)刚性双原子分子如氢、氧、氮、一氧化碳CO等分子,两个原子间联线距离保持不变。
就像两个质点之间由一根质量不计的刚性细杆相连着(如同哑铃),确定其质心O’的空间位置,需3个独立坐标(x,y,z);确定质点联线的空间方位,需两个独立坐标(如α,β),而两质点绕联线的的转动没有意义。
所以刚性双原子分子既有3个平动自由度,又有2个转动自由度,总共有5个自由度i = t + r =3 + 2 = 5。
(3)刚性三原子或多原子分子: 如H2O 、氨等,只要各原子不是直线排列的(故CO2的自由度为5,其为直线型),就可以看成自由刚体,共有6个自由度,i = t + r = 3 + 3 = 6。
(4) 对于非刚性分子,由于在原子之间相互作用力的支配下,分子内部还有原子的振动,因此还应考虑振动自由度(以S 表示)。
如非刚性双原子分子,好像两原子之间有一质量不计的细弹簧相连接,则振动自由度S = 1。
一般在常温下,气体分子都近似看成是刚性分子,振动自由度可以不考虑。
化学分子的分类化学分子是物质的基本组成单位,它们可以按照不同的分类方式进行划分。
以下是一些常见的分子分类方法。
1.按化学性质分类:有机分子:含有碳元素的分子,如烃、醇、醚、酮、酸、酯、氨基酸等。
无机分子:不含碳元素的分子,如水(H₂O)、二氧化碳(CO₂)、氨(NH₃)等。
2.按分子量大小分类:小分子:分子量较小的分子,如气体分子、简单有机分子等。
大分子:分子量较大的分子,如蛋白质、核酸、多糖等高分子化合物。
3.按分子中原子数量分类:单原子分子:由单个原子组成的分子,如稀有气体分子(He、Ne、Ar等)。
双原子分子:由两个原子组成的分子,如氧气(O₂)、氢气(H₂)等。
多原子分子:由三个或更多原子组成的分子,如水分子(H₂O)、甲烷(CH₄)等。
4.按分子结构分类:线性分子:分子中的原子排列成一条直线的分子。
支链分子:分子中的原子排列成分支结构的分子。
环状分子:分子中的原子排列成一个闭合环状结构的分子。
5.按分子间相互作用分类:极性分子:分子中正负电荷中心不重合,呈偏极性分布的分子。
非极性分子:分子中正负电荷中心重合,电荷分布均匀的分子。
6.按分子的功能分类:生物大分子:如蛋白质、核酸、多糖等,是生物体结构和功能的基础。
功能性分子:如酶、受体、激素等,具有特定生物学功能的分子。
药物分子:如抗生素、止痛药、维生素等,用于治疗疾病或改善生理状态的分子。
这些分类方法并不是相互独立的,一个分子可以同时属于多个分类。
化学分子的发展和分类对于理解物质的性质、合成新物质以及开发新技术具有重要意义。
化学选修三第二章第二节分子的立体构型2选修三第二章第2节 分子的立体构型 第2节 分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl 、NO 、O 2、N 2 等。
2.三原子分子有直线形,如CO 2、CS 2等;还有“V ”形,如H 2O 、H 2S 、SO 2等。
3.四原子分子有平面三角形,如BF 3、BCl 3、CH 2O 等; 有三角锥形,如NH 3、PH 3等; 也有正四面体,如P 4。
4.五原子分子有正四面体,如CH 4、CCl 4等,也有不规则四面体,如CH 3Cl 、CH 2Cl 2、CHCl 3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory )简称VSEPR 适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤: (1)确定中心原子A 价层电子对数目 法1.经验总结中心原子的价层电子对数=21(中心离子价电子数+配对原子提供电子总数)对于AB m 型分子(A 为中心原子,B 为配位原子),计算方法如下: n =中心原子的价电子数+每个配位原子提供的价电子数×m 2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4 中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断)N H +4 价层电子对数为21[5+(4×1)-1] = 4对 正四面体 PO -34 价层电子对数为21[5+(0×4)+3] = 4对 正四面体 NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形 法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP )VP是价层电子对,BP是成键电子对(BOND ),LP是孤对电子对(LONE PAIR)VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP=配位原子数+LPLp =21(中心原子价电子数—配位原子未成对电子数之和)IF5Lp =21[7-(5×1)] = 1 构型由八面体−→−四方锥NH+4Lp =21[(5-1)-(4×1)] = 0 正四面体PO-34Lp =21[(5+3)-(4×2)] = 0 正四面体SO-24Lp =21[(6+2)-(4×2)] = 0 正四面体NO2Lp =21[5-(2×2)] =21−→− 1 构型由三角形−→−V形SO-23Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis结构式或结构式直接写出,双键、三键都是1对电子PClClClClCl PCl Cl ClPClClClCl+ClPClClClClCl-ClClClCl+ClPClClClClCl-VP: 5 4 4 6 4(2)价层电子对数目23456价层电子对构型直线形三角形四面体三角双锥八面体(3)价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。