高中化学离子浓度大小比较专练
- 格式:doc
- 大小:27.91 KB
- 文档页数:3

溶液中离子浓度大小比较专题强化训练一、关于水的电离的有关叙述:例1、100℃时纯水电离出的氢离子是25℃纯水电离出的氢离子的多少倍(已知:100℃时Kw=1×10-12;25℃时Kw=1×10-14( )A 10-2B 2倍C 102D 10倍练习1:25℃时PH=3的盐酸溶液中由水电离出c(H+)是PH=5的盐酸溶液中由水电离出的c(H+)的多少倍( )A 103B 10-2C 10-3D 2练习2:常温下某溶液由水电离出的c(H+)=1×10-11mol/L,则该溶液的PH值可能等于( ) A 11 B 3 C 8 D 7练习3:25℃时,PH=11的NaOH溶液和NaCN溶液中,由水电离出的c(H+)的关系( )A 相等B 后者是前者的11倍C 后者是前者的108 D前者是后者的108练习4:将固体苛性钠溶于水配成100mL溶液,当溶液中由水本身电离产生的c(OH-)=1×10-13mol/l,则加入的苛性钠的质量为( )A 0.8gB 0.4gC 4gD 40g练习5:下列四种溶液(1)pH=0的盐酸溶液(2)0.1mol/L的盐酸溶液(3)0.01mol/L的NaOH (4)pH=11的NaOH溶液由水电离出的c(H+)浓度之比( )A 1:10:100:1000B 0:1:11:11C 14:13:12:11D 100;10:1:0练习6:在由水电离出的c(H+)=10-13mol·L-1的溶液中,一定能大量共存的离子组是( )A、 K+、Fe2+、 Br-、 NO3-B、 Ba2+、Na+、Cl-、 NO3-C、 NH4+、Na+、HCO3-、SO42-D、 Na+、Al3+、NO3-、Cl-二、单一溶质溶液中离子浓度大小关系:例2、H2S溶液中,各离子浓度大小关系为________________________________________,例3、Na2S溶液中有哪些微粒?_________________________________________________,例4、在2mol/L的CH3COONa溶液中,存在哪些平衡?存在哪些守恒关系?练习7: 在NH4Cl溶液中,离子浓度大小排队正确的是( )A、c(NH4+)> c(Cl-)> c(OH-)> c(H+)B、c(Cl-)> c(NH4+)> c(OH-)> c(H+)C、c(Cl-)>c(NH4+)> c(H+)> c(OH-)D、 c(NH4+)> c(Cl-)> c(H+)> c(OH-)练习8:常温下,下列关于0.1mol/LNH4Cl溶液的说法正确的是( ) ①c(NH4+)=0.1mol·L-1 ; ②溶液中 c(H+)· c(OH-)=1.0×10-14 ;③水电离出来的 c(H+)= c(OH-); ④溶液的pH=1 ;⑤ c(OH-)= c(NH4+)+ c(H+)- c(Cl-); ⑥升高温度,溶液的pH增大;⑦加热蒸干溶液,将得不到固体物质; ⑧ c(NH4+)+ c(NH3·H2O)=0.1mol·L-1;⑨ c(OH-)+ c(NH3·H2O)= c(H+); ⑩ NH4Cl水解的离子方程式为: NH4++OH-== NH3·H2O、练习9: Na2S溶液中各种离子的物质的量浓度关系不正确的是( )A、c(Na+)>c(S2-)>c(OH-)>c(HS-)B、c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)C、c(Na+)=2c(HS-)+2c(S2-)+2c(H2S)D、c(OH-)=c(H+) + c(HS-)练习10、在0.1 mol·L-1的NaHCO3溶液中,下列关系式正确的是( )A、c(Na+)>c(HCO3-)>c(H+)>c(OH-)B、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)C、c(Na+)=c(HCO3-)>c(OH-)>c(H+)D、c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)练习11、已知某温度下0.1mol·L-1的NaHB(强电解质)溶液中c(H+)> c(OH-),则下列有关说法或关系式一定正确的是( )①HB-的水解程度小于HB-的电离程度;②c(Na+)=0.1mol·L-1≥ c(B2-);③溶液的pH=1;④ c(Na+)= c(HB-)+2 c(B2-)+ c(OH-)、A、①②B、②③C、②④D、①②③练习12、已知某酸的酸式盐NaHY的水溶液的pH=8,则下列说法中正确的是( )A、在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同B、NaHY的溶液中,离子浓度大小顺序为:c(Na+)> c(Y-)> c(HY-)> c(OH-)> c(H+)C、HY-的水解离子方程式为:HY-+H2O Y-+H3O+D、相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者三、两种溶液混合后不同离子浓度的比较:1、两种物质混合不反应:例4、用物质的量都是0.1 mol的CH3COOH与CH3COONa配成1 L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液下列判断正确的是( )A、c(H+)>c(OH-)B、c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1C、c(CH3COOH)>c(CH3COO-)D、c(CH3COO-)+c(OH-)=0.1 mol·L-1练习13、CH3COOH与CH3COONa等物质的量混合配制成稀溶液,pH值为4.7,下列说法错误的( ) A、CH3COOH的电离作用大于CH3COONa的水解作用 B、CH3COOH的存在抑制了CH3COONa的水解C、CH3COONa的水解作用大于CH3COOH的电离作用D、CH3COONa的存在抑制了CH3COOH的电离2、两种物质恰好完全反应:例5:100 mL 0.1 mol·L-1 醋酸与50 mL 0.2 mol·L-1 NaOH溶液混合,在所得溶液中( )A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)B、c(Na+)>c(CH3COO-)>c(H+)>c(OH-)C、c(Na+)>c(CH3COO-)>c(H+)=c(OH-)D、c(Na+)=c(CH3COO-)>c(OH-)>c(H+)练习14:在甲酸溶液中加入一定量NaOH溶液,恰好完全反应,对于生成的溶液,下列判断一定正确的是( )A、c(HCOO-)<c(Na+)B、c(HCOO-)>c(Na+)C、c(OH-)>c(HCOO-)D、c(OH-)<c(HCOO-)练习15:等体积等浓度的醋酸与NaOH溶液相混合,所得溶液中离子浓度由大到小的顺序是( )A、c(Na+)>c(Ac-)>c(OH-)>c(H+)B、c(Na+)=c(Ac-)>c(OH-)>c(H+)C、c(Na+)>c(OH-)>c(Ac-)>c(H+)D、c(Na+)>c(OH-)>c(H+)>c(Ac-)如果一定量的醋酸和氢氧化钠混合后,溶液的pH=7,则各离子浓度的关系为()A、c(Na+)>c(Ac-)B、c(Na+)=c(Ac-)C、c(Na+)<c(Ac-)D、c(OH-)>c(H+)3、两种物质反应,其中一种有剩余:例6、把0.02 mol·L-1 HAc溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )A、c(Ac-)>c(Na+)B、c(HAc)>c(Ac-)C、2c(H+)=c(Ac-)+c(HAc)D、c(HAc)+c(Ac-)=0.01 mol·L-1例7、将0.2 mol·L-1 CH3COOK 与0.1 mol·L-1盐酸等体积混合后,溶液的pH<7,则溶液中下列微粒的物质的量浓度的关系正确的是( )A、c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)B、c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)C、c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)D、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)练习16:将0.4mol/LNH4Cl溶液和0.2mol/LNaOH溶液等体积混合后,溶液中下列微粒的物质的量关系正确的是( )A 、c(NH4+)=c(Na+)=c(OH-)>c(NH3·H 2O)B、c(NH4+)=c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)C、c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O)D、c(NH4+)>c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)4、未指明酸碱的强弱:例8、一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是( )A.[A-]≥[M+] B.[A-]≤[M+]C.若MA不水解,则[OH-]<[A-] D.若MA水解,则[OH-]>[A-]练习17、实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1, 0.1mol/L某一元碱(BOH)溶液里[H+]/[OH-]=10-12、将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是( )A.[B+]>[A-]>[OH-]>[H+] B.[A-]>[B+]>[H+]>[OH-]C.[B+]=[A-]>[H+]=[OH-] D.[B+]>[A-]>[H+]>[OH-] 5、pH之和等于14的酸和碱溶液的混合:例9、将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈_____性,溶液中c(NH4+)与c(Cl-)的大小关系是___________________;练习18:将pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后,所得的混合溶液中,下列关系式正确的是( )A、 c(Na+)>c(CH3COO-)>c(H+) >c(OH-)B、 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)C、 c(CH3COO-)>c(H+)>c(Na+)>c(OH-)D、c(CH3COO-)>c(Na+)> c(OH-) >c(H+)练习19:将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系式正确的是( )A、c(Cl-)>c(NH4+)>c(OH-)>c(H+)B、c(NH4+)>c(Cl-)> c(OH-)>c(H+)C、c(Cl-)=c(NH4+)>c(H+)=c(OH-)D、c(NH4+)>c(Cl-)>c(H+)>c(OH-)四、不同物质相同离子浓度的比较:练习20:物质的量浓度相同的下列溶液①(NH4)2CO3 ② (NH4)2SO4 ③NH4HCO3④NH4HSO4⑤NH4Cl ⑥NH3·H2O;按c(NH4+)由小到大的排列顺序正确的是( )A.③⑤④⑥①③B.⑥③⑤④①②C.⑥⑤③④①②D.⑥③⑤④②①高考模拟:1.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A H++HA-,HA-H++A2-已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:A.0.01 mol·L-1的H2A溶液B.0.01 mol·L-1的NaHA溶液C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液据此,填写下列空白(填代号):(1) c(H+)最大的是,最小的是。

.离子浓度大小比较专练1(07年山东理综·14)氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是A .在通入少量氯气,)()(-+ClO c H c 减小 B .通入少量SO 2,溶液的漂白性增强C .加入少量固体NaOH ,一定有c(Na +)=c(Cl -)+c(ClO -)D .加入少量水,水的电离平衡向正反应方向移动解析:在氯水中存在如下平衡:Cl 2+H 2O 错误!未找到引用源。
HCl +HClO 、H 2O 错误!未找到引用源。
H ++OH -、HClO 错误!未找到引用源。
H ++ClO -。
A 中在通入少量氯气,平衡右移,生成的次氯酸和盐酸增多,氢离子浓度增大有两个方面原因,次氯酸浓度增大和盐酸完全电离,而次氯酸根的增大只受次氯酸浓度增大的影响,故该值增大,错误;B 中通入二氧化硫,其与氯气反应生成无漂白性的盐酸和硫酸,漂白性减弱,错误;C 中加入少量固体氢氧化钠反应后的溶液仍是电中性的,但酸碱性不为中性,应为弱酸性。
溶液中阴阳离子所带正负电荷总数相等,故存在c(H +)+c(Na +)=c(OH -)+c(Cl -)+c(ClO -),但是c(H +)应该大于c(OH -),故此等式不成立,错误;D 中加水,即稀释氯水溶液的酸性减弱,即c(H +)减小,所以水的电离平衡向正向移动,正确。
答案:D2.(07年广东化学·15)下列各溶液中,微粒的物质的量浓度关系正确的是A .0.1mol·L -1 Na 2CO 3溶液:c (OH -)=c (HCO 3-)+c (H +)+2c (H 2CO 3)B .0.1mol·L -1NH 4Cl 溶液:c (NH 4+)=c (Cl -)C .向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c (Na +)>c (CH 3COO -)>c (H +)>c (OH -)D .向硝酸钠溶液中滴加稀盐酸得到的pH =5的混合溶液:C (Na +)=c (NO 3-)解析:溶液中离子浓度大小比较要综合运用电离平衡,盐类水解知识,要记住三个守恒:电荷守恒、物料守恒、质子守恒。

高二化学溶液中离子浓度大小比较专题〔用一、相关知识点梳理:1、电解质的电离强电解质在水溶液中是完全电离的,在溶液中不存在电解质分子。
弱电解质在水溶液中是少部分发生电离的。
多元弱酸如H2CO3还要考虑分步电离:H 2CO3H++HCO3-;HCO3-H++CO32-。
2、水的电离水是一种极弱的电解质,它能微弱地电离,H2O H++OH-。
水电离出的[H+]=[OH-]在一定温度下,纯水中[H+]与[OH-]的乘积是一个常数:水的离子积Kw=[H+]·[OH-],在25℃时,Kw=1×10-14。
在纯水中加入酸或碱,抑制了水的电离,使水的电离度变小,在纯水中加入弱酸强碱盐、弱碱强酸盐,促进了水的电离,使水的电离度变大。
3、盐类水解在溶液中盐的离子跟水所电离出的H+或OH-生成弱电解质的反应,叫做盐类的水解。
关于盐的水解有这么一个顺口溜"谁弱谁水解,谁强显谁性"多元弱酸盐还要考虑分步水解,如CO32-+H2O HCO3-+OH-、HCO3-+H 2O H2CO3+OH-。
4、电解质溶液中的守恒关系电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。
如Na2CO3溶液中:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。
如Na2CO3溶液中n<Na+>:n<c>=2:1,推出:c<Na+>=2c<HCO3->+2c<CO32->+2c<H2CO3>水的电离守恒〔也称质子守恒:是指在强碱弱酸盐或强酸弱碱盐溶液中,由水所电离的H+与OH-量相等。
如在0.1mol·L-1的Na2S溶液中:c<OH->=c<H+>+c<HS->+2c<H2S>。

高中化学离子浓度大小比较练习题附答案1. 将0.5mol/L的NaCl溶液和0.3mol/L的CaCl2溶液混合,哪个离子浓度更大?答:Ca2+离子浓度更大。
2. 将0.3mol/L的Na2SO4溶液和0.4mol/L的NaCl溶液混合,哪个离子浓度更大?答:Na+离子浓度相同。
3. 将0.2mol/L的K2SO4溶液和0.1mol/L的MgSO4溶液混合,哪个离子浓度更大?答:SO42-离子浓度相同。
4. 将0.1mol/L的Na3PO4溶液和0.2mol/L的Na2SO4溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。
5. 将0.4mol/L的NaCl溶液和0.2mol/L的KCl溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
6. 将0.3mol/L的Ca(NO3)2溶液和0.2mol/L的Na2CO3溶液混合,哪个离子浓度更大?答:Ca2+离子浓度更大。
7. 将0.1mol/L的NaOH溶液和0.2mol/L的HCl溶液混合,哪个离子浓度更大?答:H+离子浓度更大。
8. 将0.2mol/L的K2CO3溶液和0.1mol/L的CaCl2溶液混合,哪个离子浓度更大?答:CO32-离子浓度更大。
9. 将0.3mol/L的NaCl溶液和0.1mol/L的MgCl2溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
10. 将0.2mol/L的FeSO4溶液和0.1mol/L的MgSO4溶液混合,哪个离子浓度更大?答:SO42-离子浓度相同。
11. 将0.1mol/L的Na3PO4溶液和0.2mol/L的Ca(NO3)2溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。
12. 将0.3mol/L的KCl溶液和0.1mol/L的CaCl2溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
13. 将0.2mol/L的Na2CO3溶液和0.1mol/L的NaOH溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。

离子浓度大小比较专题一、电离理论和水解理论1.电离理论:⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在;例如NH3·H2O溶液中微粒浓度大小关系。
【分析】由于在NH3·H2O溶液中存在下列电离平衡:NH3·H2O NH4++OH-,H2O H++OH-,所以溶液中微粒浓度关系为:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
⑵多元弱酸的电离是分步的,主要以第一步电离为主;例如H2S溶液中微粒浓度大小关系。
【分析】由于H2S溶液中存在下列平衡:H2S HS-+H+,HS-S2-+H+,H2O H++OH-,所以溶液中微粒浓度关系为:c(H2S)>c(H+)>c(HS-)>c(OH-)。
2.水解理论:⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHCO3溶液中有:c(Na+)>c(HCO3-)。
⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及产生H+的(或OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的酸性溶液中c(H+)(或碱性溶液中的c(OH-))总是大于水解产生的弱电解质的浓度;例如(NH4)2SO4溶液中微粒浓度关系。
【分析】因溶液中存在下列关系:(NH4)2SO4=2NH4++SO42-,+2H2O 2OH-+2H+,2NH3·H2O,由于水电离产生的c(H+)水=c(OH-)水,而水电离产生的一部分OH-与NH4+结合产生NH3·H2O,另一部分OH-仍存在于溶液中,所以溶液中微粒浓度关系为:c(NH4+)>c(SO42-)>c(H+)>c(NH3·H2O)>c(OH-)。
⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中c(H+)>c(OH-),水解呈碱性的溶液中c(OH-)>c(H+);⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。

2020年03月21日高中化学盐溶液中的离子浓度大小比较专项练习学校:___________考号:___________注意事项:注意事项:1 2、请将答案正确填写在答题卡上第1卷一、单选题-)=0.1mol 的HA 、NaA 混合物溶于水形成1 L 溶液,溶液中c (HA)、c (A -)与pH 的关系如图所示。
下列叙述中正确的是( )A.a 线表示的是c (A -)的变化B.pH=6 时,c (Na +)+c (HA)>0.1 mol/LC.298 K 时,A -的水解平衡常数(K h )的数量级为10-10D.若将等物质的量的HA 、NaA 溶于水中,所得溶液pH 恰好为4.752.常温下,某化学学习小组对某些电解质溶液作出如下分析。
其中正确的是( ) ①将1mL pH=3的强酸溶液加水稀释至100mL 后,溶液的pH=1②1L 0.50mol·L -1的NH 4Cl 溶液与2L 0.25mol·L -1的NH 4Cl 溶液相比,前者所含+4NH 的物质的量大③pH=8.3的NaHCO 3溶液:[Na +]>[-3HCO ]>[2-3CO ]>[H 2CO 3]④pH=4、浓度均为0.1mol·L -1的CH 3COOH 、CH 3COONa 的混合溶液:[CH 3COO -]-[CH 3COOH]=2×(10-4-10-10)mol·L -1A.①②B.②③ C .①③ D.②④3.将0.2mol·L -1NaHCO 3溶液与0.1mol·L -1KOH 溶液等体积混合,下列关于所得溶液的关系式正确的是( )A.0.2mol·L -1=c(HCO 3-)+c(CO 32-)+c(H 2CO 3) B.c(Na +)>c(K +)>c(HCO 3-)>c(CO 32-)>c(OH -)>c(H +)C.c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1mol·L-1D.3c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)4.室温下向10mL 0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。

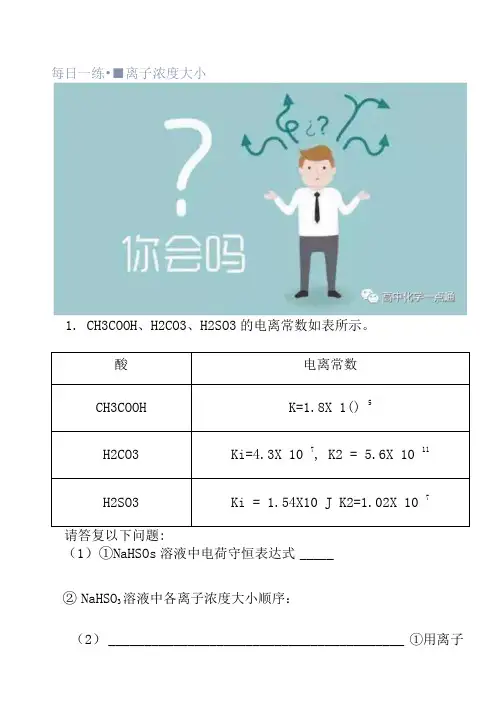
每日一练•■离子浓度大小1. CH3COOH、H2CO3、H2SO3的电离常数如表所示。
(1)①NaHSOs溶液中电荷守恒表达式_____②NaHSO3溶液中各离子浓度大小顺序:(2)_________________________________________ ①用离子方程式表示Na2C03溶液碱性的原因______________________②写出Na2C03溶液中物料守恒表达式 ____③写出NaHCO3溶液中质子守恒表达式_____(3)常温下,物质的量浓度相同的以下溶液:①NHK1②NH4HCO3③(NH.J)2S04 ④NH4HSO4⑤(NH4)2Fe (SO4)2溶液中c (NH4+)从大到小排列顺序为 ______ (填序号)(4)常温下,物质的量浓度均为O.lniol/L的六种溶液①NaOH、②NaCK @Na2C03.④H2SO3、⑤CH3COONa.⑥H2SO4, pH从大到小排列顺序为 ____ (填序号)(5)常温时,AIC13的水溶液呈酸性,原因是(用离了方程式表示): ____ 将A1C13溶液蒸干,灼烧,最后得到的固体产物主要是 ____ (填化学式)(6)证明CH3COOH是弱电解质的简单且可行的方法是:(7) _______ 以下混合溶液中,各离了浓度的大小顺序或等量关系正确的选项是A.10 mL 0.1 mol/L 氨水与10 mL 0.1 mol/L 盐酸混合:c (Cl ) >c (NH「)>C (OH ) >c (H )B.10 mL 0.1 mol/L NH4CI 溶液与5 mL 0.2 mol/L NaOH 溶液混合:c (Na*) =c (CD >c (OH ) >c (H )C.10 mL 0.1 mol/L CH3COOH 溶液与5 mL 0.2 mol/L NaOH 溶液混合:c (Na*) =c (CH3COC) >c (OH ) >c(H+)D.10 mL 0.5 moi/L CHsCOONa 溶液与6 mL 1 moi/L 盐酸混合:c (C「)>c (Na ) >c (OH- ) >c (H )+ 2E.在NaHSOi 溶液中,c (H ) =c (OH ) +c (SOi。

不同物质溶液中同种离子浓度比较一. 不同盐溶液中同种离子浓度大小比较【例1】物质的量浓度相同的下列溶液中,NH4+浓度最大的是()。
A.NH4Cl B.NH4HSO4C.NH3COONH4 D.NH4HCO3【答案】B【例2】物质的量浓度相同的下列溶液:① Na2CO3② NaHCO3 ③ H2CO3 ④ (NH4)2CO3 ⑤ NH4HCO3,按c(CO32-)由小到大排列的顺序是()A.⑤<④<③<②<① B.③<⑤<②<④<①C.③<②<⑤<④<① D.③<⑤<④<②<①【答案】B【解析】不管是弱电解质的电离,还是盐的水解,在水溶液中大多以原来的微粒存在于溶液中,则:Na2CO3是易溶于水的盐,在水中完全电离,电离出的碳酸根离子部分水解,但水解微弱,所以,碳酸根离子浓度降低,碳酸根浓度接近0.1mol/L;NaHCO3是易溶于水的盐,在水中完全电离,电离出的碳酸氢根离子水解建立水解平衡,因碳酸氢钠溶液显碱性,所以,部分碳酸氢根离子的电离小于其水解,所以碳酸根浓度远远小于碳酸氢根浓度,及远远小于0.1mol/L;(NH4)2CO3是易溶于水的盐,在水中完全电离,电离出的铵根离子和碳酸根离子分别和水电离出的氢氧根离子和氢离子结合,水解相互促进,所以,碳酸根离子浓度比Na2CO3中碳酸根离子离子浓度小一些,碳酸根离子略小于0.1mol/L;H2CO3溶液是二元弱酸,且酸性很弱,电离时分两步电离,电离出的碳酸根离子浓度较小,但它是酸,溶液显酸性,所以,碳酸根浓度小于0.1mol/L,NH4HCO3溶液中电离出碳酸根离子只需碳酸氢根离子一步电离,而H2CO3溶液是二元弱酸,需两步电离,且第二步极其微弱,其碳酸根离子的浓度比NH4HCO3溶液中碳酸根离子浓度小;NH4HCO3是易溶于水的盐,在水中完全电离在水中完全电离,电离出的铵根离子和碳酸氢根离子分别和水电离出的氢氧根离子和氢离子结合,水解相互促进,所以,碳酸氢根离子电离出来的碳酸根离子的浓度非常小,比NaHCO3溶液中碳酸根离子浓度小;综上碳酸根离子浓度为:Na2CO3>(NH4)2CO3>NaHCO3>NH4HCO3>H2CO3,故选B。

离子浓度大小比较专题训练考纲要求:它能掌握强弱电解质、电离平衡、水的电离、溶液的pH、离子反应、盐类水解等基本概念。
掌握程度及对这些知识的综合运用能力。
知识精讲:一、离子浓度关系一顺序:大小顺序:①给出量大的>给出量小的。
如Na2CO3溶液中c(Na+)>c(CO32-);②直接给出的>过程产生的。
电离和水解过程一般较微弱,产生的离子的浓度一般都较小。
如氯化铵溶液中c(Cl-)和c(NH4+)一定大于电离或水解产生的c(H+)和c(OH-)。
③主要过程产生的>次要过程产生的。
碳酸氢钠溶液中,碳酸氢根离子即能发生电离又能发生水解,但水解程度大于电离程度,故c(H+)<c(OH-)。
三守恒:理解三种守恒关系以0.1mol/LNa2CO3溶液为例,分析在存在的反应有(写离子方程式)1、大小顺序:。
2、电荷守恒:。
3、物料守恒:考虑水解前后C元素守恒,。
4、质子守恒:由水电离出的c(H+)水=c(OH―)水。
得质子守恒关系为:二、解题思路:确定溶质成分→书写发生的过程方程式→确定过程的主次→排出离子浓度大小顺序.三、典型题型:Ⅰ、单一溶液离子浓度比较:1、弱酸或弱碱溶液例1、在0.1mol/L的H2S溶液中,下列关系错误的是()A.c(H+)=c(HS-)+c(S2-)+c(OH-)B.c(H+)=c(HS-)+2c(S2-)+c(OH-)C.c(H+)>[c(HS-)+c(S2-)+c(OH-)]D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L例2、室温下,0.1mol/L 的氨水溶液中,下列关系式中不正确的是( )A. c(OH -)>c(H +)B.c(NH 3·H 2O)+c(NH 4+)=0.1mol/L C.c(NH 4+)>c(NH 3·H 2O)>c(OH -)>c(H +) D.c(OH -)=c(NH 4+)+c(H +)2、一元强酸弱碱盐或弱酸强碱盐溶液: 例3、 CH 3COONa 溶液中存在如下关系:大小顺序: 电荷守恒: 物料守恒: 质子守恒: 跟踪练习:在氯化铵溶液中,下列关系正确的是( )A.c(Cl -)>c(NH 4+)>c(H +)>c(OH -)B.c(NH 4+)>c(Cl -)>c(H +)>c(OH -)C.c(NH 4+)=c(Cl -)>c(H +)=c(OH -) D.c(Cl -)=c(NH 4+)>c(H +)>c(OH -)3、多元强酸弱碱盐或弱酸强碱盐溶液: 例4、Na 2S 溶液中存在如下关系:大小顺序: 电荷守恒: 物料守恒: 质子守恒: 4.多元弱酸酸式盐溶液:①以水解为主呈碱性的:NaHCO 3 、NaHS 、Na 2HPO 4等; ②以电离为主呈酸性的:NaHSO 4 、NaHSO 3、NaH 2PO 4等。

【常见陷阱及典型分析】溶液中离子浓度的大小比较是主流试题,考查的内容既与盐的水解有关,又与弱电解质的电离平衡有关。
题目不仅侧重考查粒子浓度大小顺序,还侧重溶液中的各种“守恒”关系的考查,从而使题目具有一定的综合性、灵活性和技巧性。
解答此类题目常出现的错误有:(1)对电解质溶液中的电荷守恒式的书写错误:如0.1 m o l ·L -1 N a H C O 3溶液中:c(Na+(2)不能通过电荷守恒和物料守恒联立推导出来新的等式:如0.1 mol/L Na 2CO 3溶液:c (OH -)=c (HCO 3-)+c (H +)+2c (H 2CO 3)如0.1 mol/LC 6H 5ONa 溶液中:c(Na +)>c(C 6H 5O -)>c(H +)>c(OH -)是否正确?再如物质的量浓度相等CH 3COOH 和CH 3COONa 溶液等体积混合后是否存在c (CH 3COO -) +2c (OH -) = 2c (H +) + c (CH 3COOH) ?(3)对酸式盐溶液中“电离”和“水解”相对强弱判断错误:如0.1mol ·L -1的NaHA 溶液,其pH=4:c (HA -)>c (H +)>c (H 2A)>c (A 2-)(4)漏掉电解质溶液中某些离子而造成错误:如0.1 mol·L -1 Na 2SO 3溶液中:c (Na +)+c (H +) = 2c (SO 32 -)+c (OH -)(5)对等体积、等浓度溶液混合后溶液的酸碱性判断错误:如在物质的量浓度都是0.01 mol/L CH 3COOH 和CH 3COONa 的混合溶液中,溶液显酸性,c(CH 3COO -)>c(Na +)>c(CH 3COOH)>c(H +)>c(OH -) 是否成立?又比如0.1 mol/L HCN 溶液和0.1 mol/L NaCN 溶液等体积混合,溶液显碱性,c(HCN)>c(Na +)>c(CN -)>c(OH -)>c(H +)是否成立?(6)对等体积、PH 之和等于14的弱酸与强碱(或强酸与弱碱)溶液混合后溶液的酸碱性判断错误:在25 ℃时,将pH = 11的NaOH 溶液与pH = 3的CH 3COOH 溶液等体积混合后,溶液中c (CH 3COO -)>c (Na +)>c (H +)>c (OH -)是否成立?【课堂练习】1、 .下列溶液中微粒的物质的量浓度关系正确的是( ) A .室温下,向0.01mol ·L -1NH 4HSO 4 溶液中滴加NaOH 溶液至中性:c(Na +)>c((SO 42-)>c(NH 4+)>c(OH -)=c(H +)B .0.1mol·L -1NaHCO 3溶液: c(Na +)>c(OH -)>c((HCO 3-)>c(H +)C .Na 2CO 3溶液:c(OH -)-c(H +)=c((HCO 3-)+2c(H 2CO 3)D .25℃时,pH =4.75、浓度均为0.1mol·L -1的CH 3COOH 、CH 3COONa 混合溶液:c(CH 3COO -)+c(OH -)<c(CH 3COOH)+c(H +)2、.向体积为V a的0.05mol·L-1CH3COOH溶液中加入体积为V b的0.05mol·L-1KOH溶液,下列关系错误..的是( )A.V a>V b时:c (CH3COOH) +c (CH3COO-)>c (K+)B.V a=V b时:c (CH3COOH) +c (H+)=c (OH-)C.V a<V b时:c (CH3COO-)>c (K+)> c (OH-)>c (H+)D.V a与V b任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)3、 .关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是 ( )A.c(NH+4):③>①B.水电离出的c(H+):②>①C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl-)>c(OH-)>c(H+)【课后强化】1.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol·L-1的 NaA 和 NaB混合溶液中,下列排序正确的是()A.c(OH-)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+)C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)2.盐酸、醋酸和碳酸氢钠是生活中常见的物质。
高中化学离子浓度大小比较练习题一、单选题1.25 °C 时,23H CO ,的-7al K =4. 210´,-11a2K =5. 610´。
室温下向10 mL0. 1-1mol L ×23Na CO 中逐滴加入0. 1 -1mol L ×HCl 。
图是溶液中含C 微粒物质的量分数随pH 降低而变化的图像(2CO 因有逸出未画出)。
下列说法错误的是( ) A.A 点溶液的pH<11 B.B 点溶液:()()()()-2-33+23c Na =c HCO +c +c H O CO C C.A→B 的过程中,离子反应方程式为:2-+33C H HCO O +===D.分步加入酚酞和甲基橙,用中和滴定法可测定23Na CO ,与3NaHCO ,混合物组成2.实验测得0.5mol·0.5mol·L L −1CH 3COONa 溶液、0.5mol·0.5mol·L L −1 CuSO 4溶液以及H 2O 的pH 随温度变化的曲线如图所示。
下列说法正确的是( ) A. 随温度升高,纯水中c(H +)>c(OH −) B. 随温度升高,CH 3COONa 溶液的c(OH −)减小C. 随温度升高,CuSO 4溶液的pH 变化是K w 改变与水解平衡移动共同作用的结果D. 随温度升高,CH 3COONa 溶液和CuSO 4溶液的pH 均降低,是因为CH 3COO −、Cu 2+水解平衡移动方向不同3.25 °C 时,改变0. 1 mol/L 弱酸RCOOH 溶液的pH ,溶液中RCOOH 分子的物质的量分数()δRCOOH 随之改变[已知-c ()δ()c RCOOH RCOOH =RCOOH RC )+c(OO ()],甲酸(HCOOH)与丙酸32CH CH C )OOH (溶液中()δRCOOH 与pH 的关系如图所示。
离子浓度大小比较专题1、在0.1mol/L 的NH 3·H 2O 溶液中,下列关系正确的是( A )A 、C(NH 3·H 2O)>C(OH -)>C(NH 4+)>C(H +)B 、C(NH 4+)>C(NH 3·H 2O)>C(OH -)>C(H +)C 、C(NH 3·H 2O)>C(NH 4+)= C(OH -)>C(H +)D 、C(NH 3·H 2O) >C(NH 4+)>C(H +)>C(OH -)2、在氯化铵溶液中,下列关系式正确的是【 A 】A .C (Cl -)>C(NH 4+)>C(H +)>C(OH -)B .C(NH 4+)>C (Cl -)>C(H +)>C(OH -)C .C (Cl -)=C(NH 4+)>C(H +)=C(OH -)D .C(NH 4+)=C (Cl -)>C(H +)>C(OH -)3、在Na 2S 溶液中存在多种微粒,下列关系正确的是【 B 】A .C(OH -) = C (HS -)+ C(H +) + C(H 2S) B. C(OH -) = C (HS -)+ C(H +)+2 C(H 2S)C .C(Na +) = C(S 2-)+ C (HS -) + C(H 2S)D .C(Na +) = C(S 2-)+ C (HS -)+2 C(H 2S)4、用物质的量都是0.1 mol 的CH 3COOH 和CH 3COONa 配制成1L 混合溶液,已知其中C(CH 3COO -)>C(Na +),对该混合溶液的下列判断正确的是【B 】A .C(H +)<C(OH -)B .C(CH 3COOH)+C(CH 3COO -)=0.2mol/LC .C(CH 3COOH)>C(CH 3COO -)D .C(CH 3COO -)+C(OH -)=0.2 mol/L5、某二元弱酸的酸式盐NaHA 溶液,若PH< 7, 则下列关系不正确的是【 B 】A .C(Na +)>C(HA -)> C(H +)>C(A 2-)> C(OH -) B. C(H +) + C(A 2-) = C(OH -)+ C(H 2A)C .C(Na +)+ C(H +) = C(HA -)+2 C(A 2-)+ C(OH -)D .C(Na +)= C(HA -) +C(H 2A) + C(A 2-)6、标准状况下,向3mol/L 的NaOH 溶液100 ml 中缓缓通入4.48LCO 2气体,充分反应后溶液中离子浓度大小排列顺序正确的是【 D 】A. C(Na +) > C(CO 32-) > C(HCO 3-) > C(OH -) > C(H +-)B. C(Na +) > C(CO 32-) = C(HCO 3-) > C(OH -) > C(H +-)C. C(Na +) > C(HCO 3-) > C(OH -) > C(CO 32-) > C(H +-)D. C(Na +) > C(HCO 3-) > C(CO 32-) > C(OH -) > C(H +-)7、某酸式盐NaHY 的水溶液显碱性,下列叙述正确的是【 C 】A .H 2Y 的电离方程式:H 22H + + Y 2-B .HY - 离子水解方程式:HY - + H 23O + + Y 2-C .该酸式盐溶液中离子浓度关系C(Na +) 〉C(HY -) 〉C(OH -) 〉C(H +)〉C(Y 2-)D .该酸式盐溶液中离子浓度关系C(Na +) 〉C(HY -) 〉C(OH -)〉C(Y 2-) 〉C(H +)8、用物质的量都是0.01mol 的HCN 和NaCN 配成1L 混合溶液,已知其中C(CN -)<C(Na +),对该溶液的下列判断不正确的是( A )A 、C(H +)>C(OH -)B 、C(OH -)>C(H +)C 、C(HCN)>C(CN -)D 、C(HCN)+ C(CN -)=0.02mol/L。
2020届高考化学二轮题型对题必练——单一溶液中离子浓度大小的比较(强化练)1.常温下,用盐酸滴定溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是A. a点:B. b点:C. c点:D. d点:2.常温下,用的NaOH溶液分别滴定同浓度、体积均为的盐酸和醋酸溶液用HA表示酸,得到2条滴定曲线,如图所示。
下列说法正确的是A. 滴定醋酸的曲线是图1B. 由图分析可得C. D点对应的溶液中:D. 根据E点可计算得3.时,取浓度均为的醋酸溶液和氨水溶液各,分别用溶液、盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。
下列说法正确的是A.曲线Ⅰ:滴加溶液到时:B. 曲线Ⅰ:滴加溶液到时:C. 曲线Ⅱ:滴加溶液到时:D. 曲线Ⅱ:滴加溶液在~之间存在:4.的溶液用的NaOH溶液进行滴定,其滴定曲线如图所示已知:滴定分数滴定液中溶质被滴定溶质下列说法正确的是A. 时,B. 时,C. 时,D. 时,5.常温下的电离常数为,该温度下用的醋酸溶液滴定等物质的量浓度的碱ROH,滴定过程中加入醋酸的体积与溶液中的关系如图所示。
下列说法中正确的是A. b点溶液显碱性B.C. ROH 的电离方程式为D. 时,的醋酸溶液中的浓度约为已知6.时,分别取浓度均为・的醋酸溶液和氨水溶液各20mL于两个锥形瓶中,分别用・溶液、・盐酸进行中和滴定。
滴定过程中pH随滴加溶液的体积变化关系如图所示。
下列说法正确的是A. 时,・的醋酸溶液中约有电离B. 绘制曲线Ⅱ的实验中通过控制滴定管玻璃活塞控制滴定速度C. 曲线I上a点溶液中:D. 曲线Ⅱ上b点溶液中:7.NaOH溶液滴定邻苯二甲酸氢钾邻苯二甲酸的,溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述不正确的是A. a点离子浓度:B. b点溶液中存在:C. c点溶液中存在:D. 从a到c的变化过程中,水的电离程度先增大后减小8.,向20mL 的溶液中滴加的NaOH溶液滴定过程中溶液温度保持不变,滴定曲线如图1,含磷物种浓度所占分数随pH变化关系如图2,则下列说法不正确的是A. 的电离方程式为:;电离常数B. B点溶液中存在关系:C. 图2中的a点对应为图1中的B点D. D点时,溶液中微粒浓度大小关系为:9.下,在NaHS溶液中,各离子的浓度随NaHS溶液浓度的变化关系如图所示,下列叙述正确的是已知:在科学记数法中,为了使公式简便,可以用带“E”的格式表示,例如:。
盐类水解应用练习题1. 25 ℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH = 7 时,下列关系正确的是2-2-+ + A. c(NH 4 )=c(SO 4 ) C. c(NH 4 )<c(SO 4 )2. 室温下,下列溶液等体积混合后,所得溶液的 B. c(NH 4 )>c(SO 4 )2--2-+ + + D. c(OH)+c(SO 4 )=c(H )+c(NH 4 )pH 一定大于 7 的是A. 0.1mol/L 的盐酸和B. 0.1mol/L 的盐酸和C. pH = 4 的醋酸溶液和 3.将 0.2mol/L 的 HCN 是-A. c(HCN) < c(CN )0.1mol/L 的氢氧化钠溶液 0.1mol/L 的氢氧化钡溶液 pH = 10 的氢氧化钠溶液D. pH = 4 的盐酸和 pH = l0 的氨水溶液和 的 溶液等体积混合后, 溶液显碱性, 下列关系式中正确的0.1mol/L NaOH + -B. c(Na )> c(CN )D. c(HCN) + c(CN )= 0.1mol/L盐酸等体积混合后,溶液中有关离子浓度的关系,正确的是 ---C. c(HCN) - c(CN )= c(OH )将 0.2mol/L 醋酸钾溶液与 4. 0.1mol/L --+3COO )> c(Cl )> c(H )> c(CH 3COOH) 3COO)> c(Cl )> c(CH 3 COOH) > c(H )A. c(CHB. c(CHC. c(CHD. c(CH --+--+3COO )>c(Cl )=c(H )> c(CH 3COOH) > c(H ) --+3COO )=c(Cl )>c(CH 3COOH) 若 pH = 3 的酸溶液与 pH = 11 的碱溶液等体积混合后溶液呈碱性,其原因可能是 B. 强酸溶液和弱碱溶液反应 D. 一元强酸溶液和一元强碱溶液反应5. A. 生成了一种强碱弱酸盐 C. 弱酸溶液和强碱溶液反应常温下在 10mL pH=10 的 KOH 溶液中,加入 pH=4 的一元酸 HA 溶液至 pH 刚好等于 7( 假设反应前6. 后体积不变 ),则对反应后溶液的叙述正确的是 --A. c(A )= c(K +) C. V( 总 ) ≥ 20mL 下列叙述正确的是B. c(H +)= c(OH ) D. V( 总 ) ≤ 20mL< c(K +)< c(A +) 7. - 1A. 0.1mol L · -+氨水中, c(OH )=c(NH 4 )- 1- 12 溶液充分混合 ,若混合后溶液的体积为 20L · HCl pH=12溶液与 L · Ba(OH) B. 10 mL 0.02mol mL ,则溶液的 10 mL 0.02mol - 1- +C. 在 0.1mol ·L CH 3 COONa 溶液中, c(OH )=c(CH 3COOH) + c(H ) -D. 0.1mol L · 1NaHA 溶液中, c(Na +2- -某二元弱酸强碱盐)=2c(A ) + c(HA )+ c(H 2 A)HN 3)与醋酸酸性相似,下列叙述中错误的是 叠氮酸( 8. +3 水溶液中微粒浓度大小顺序为: c(HN 3)>c(H )>c(N 3ˉ)>c(OH ˉ) A. HN B. HN 3 与 NH 3 作用生成的叠氮酸铵是共价化合物++C. NaN 3 水溶液中离子浓度大小顺序为: c(Na )>c(N 3ˉ) >c(OH ˉ)>c(H )CO 2 含电子数相等 D. N 3ˉ与 关于小苏打水溶液的表述正确的是A. c (Na )=c (HCO 3 ) + c (CO 3 ) + c (H 2CO 3)9. +-2-+ + - 2- -B. c (Na ) + c (H ) = c (HCO 3 ) + c (CO 3 ) +c (OH )-- 的水解程度C. HCO 的电离程度大于 HCO 3 3 +-, HCO - +2-3+ -D. 存在的电离有:NaHCO 3 =Na +HCO H+ CO L· KHC H 2O H +OH3 3-12O 4 溶液中,下列关系正确的是 10. 草酸是二元弱酸,草酸氧钾溶液呈酸性。
离子浓度大小比较精选(选择题30题)1.20 mL1 mol / L醋酸溶液跟40 mL0.5 mol / L氢氧化钠溶液相混合,所得溶液中离子浓度由大到小的顺序是(Ac-代表醋酸根离子)A. c(Na+)>c(Ac-)>c(OH-)>c(H+)B. c(Na+)=c(Ac-),c(Ac-)>c(OH-)>c(H+)C. c(Na+)>c(OH-)>c(Ac-)>c(H+)D. c(Na+)>c(OH-)>c(H+)>c(Ac-)2.将0.2 mol / L CH3COOK与0.1 mol / L盐酸等体积混合后,溶液中下列微粒的物质的量浓度的关系正确的是A. c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)B. c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)C. c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)D. c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)3.将20 mL 0.1 mol / L的醋酸与24 mL 0.1 mol / L的氢氧化钠混合后,溶液中各离子摩尔浓度由大到小的顺序是A. c(Na+)>c(CH3COO-)>c(H+)>c(OH-)B. c(Na+)>c(CH3COO-)>c(OH-)>c(H+)C. c(OH-)>c(Na+)>c(H+)>c(CH3COO-)D. c(Na+)>c(OH-)>c(H+)>c(CH3COO-)4.在氯化铵溶液中,下列关系式正确的是A. c(Cl-)>c(NH4+)>c(H+)>c(OH-)B. c(NH4+)>c(Cl-)>c(H+)>c(OH-)C. c(Cl-)=c(NH4+)>c(H+)=c(OH-)D. c(NH4+)=c(Cl-)>c(H+)>c(OH-)5.明矾溶液中各种离子的物质的量浓度大小关系能够确定的是A.c(K+)>c(Al3+)B.c(K+)=c(Al3+)C.c(H+)=c(OH-)D.c(Al3+)<c(H+) 6.100 mL 0.1 mol / L醋酸与50 mL 0.2 mol / L氢氧化钠溶液混合,在所得溶液中A. c(Na+)>c(CH3COO-)>c(OH-)>c(H+)B. c(Na+)>c(CH3COO-)>c(H+)>c(OH-)C. c(Na+)>c(CH3COO-)>c(H+)=c(OH-)D. c(Na+)=c(CH3COO-)>c(OH-)>c(H+)7.将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是A. c(NH4+)>c(Cl-)>c(H+)>c(OH-)B. c(NH4+)>c(Cl-)>c(OH-)>c(H+)C. c(Cl-)>c(NH4+)>c(H+)>c(OH-)D. c(Cl-)>c(NH4+)>c(OH-)>c(H+)8.物质的量浓度相同的下列溶液中,NH 4+最大的是A. NH 4ClB. NH 4HSO 4C. CH 3COONH 4D. NH 4HCO 39.在物质的浓度均为0.01 mol / L 的CH 3COOH 和CH 3COONa 的混合液中,测得c (CH 3COO -)>c (Na +),则下列关系式正确的是A. c (H +)>c (OH -}B. c (H +)<c (OH -)C. c (CH 3COOH )>c (CH 3COO -)D. c (CH 3COOH )+c (CH 3COO -)=0.02 mol / L10. 0.1 mol ·L -1 NaOH 和0.1 mol ·L -1 NH 4Cl 溶液等体积混合后,离子浓度大小正确的次序是A. c (Na +)>c (Cl -)>c (OH -)>c (H +)B. c (Na +)=c (Cl -)>c (OH -)>c (H +)C. c (Na +)=c (Cl -)>c (H +)>c (OH -)D. c (Cl -)>c (Na +)>c (OH -)>c (H +)11.将0.1 mol 下列物质置于1 L 水中充分搅拌后,溶液中阴离子数最多的是A. KClB. Mg(OH)2C. Na 2CO 3D. MgSO 412.将100 mL 0.1 mol / L 的BaCl 2溶液加入到100 mL 0.2 mol / L 的H 2SO 4溶液中,则溶液中存在的离子浓度关系是A . c (H +)>c (Cl -)>c (Ba 2+)>c (-24SO )B . c (Cl -)>c (H +)>c (-24SO )>c (Ba 2+) C . c (H +)>c (-24SO )>c (Ba 2+)>c (Cl -) D . c (Cl -)>c (H +)>c (Ba 2+)>c (-24SO ) 13.等体积、等浓度的MOH 强碱溶液和HA 弱酸溶液混合后,混合液中有关离子的浓度应满足的关系是A. c (M +)>c (OH -)>c (A -)>c (H +)B. c (M +)>c (A -)>c (H +)>c (OH -)C. c (M +)>c (A -)>c (OH -)>c (H +)D. c (M +)+c (H +)=c (A -)+c (OH -)14.有五瓶溶液分别是:① 10 mL 0.60 mol·L -1 NaOH 水溶液,② 20 mL 0.50 mol·L -1H 2SO 4水溶液,③ 30 mL 0.40 mol·L -1 HCl 水溶液,④ 40 mL 0.30 mol·L -1 HAc 水溶液,⑤ 50 mL 0.20 mol·L -1 蔗糖水溶液。
2020年03月09日高三化学溶液中离子浓度大小比较练习题正确填写在答题卡上第1卷一、单选题,原子序数依次增大。
W 是原子半径最小的元素,X 、Y 原子核外L 层的电子数之比为3∶4,X 与Z 同主族,W 、X 、Y 、Z 的最外层电子数之和为17。
下列说法正确的是( ) A.单质的沸点:X>ZB.X 与W 形成的化合物中一定只有极性键C.氢化物的热稳定性:Z>YD.W 、X 、Y 可形成离子化合物2.常温下,向20mL0.1mol·L -1NaHC 2O 4溶液中缓慢滴加pH=13的NaOH 溶液,混合溶液的温度与滴加NaOH 溶液体积的关系如图所示。
下列说法错误的是( )A.E 点存在:2c (Na +)=3c (H 2C 2O 4)+3c (24HC O -)+3c (224C O -)B.F 点存在:c (OH -)>c (H +)+c (24HC O -)+c (H 2C 2O 4)C.在E 、F 和G 点中,G 点对应的K W 最小D.G 点对应的溶液中,c (Na +)>c (OH -)>c (224C O -)>c (24HC O -)3.利用电解原理将SO 2、NO x 转化为(NH 4)2SO 4的装置如图所示。
下列说法错误的是( )NH+xH2OA.阴极的电极反应式:NO x+(2x+3)e-+(2x+4)H+=+4B.溶液C的酸性比硫酸铵稀溶液强C.电极A与电源的负极相连,发生氧化反应D.转移0.2mol电子时消耗0.1mol SO24.研究人员用H2S废气除去空气中的NO x,装置如图所示。
熔融态Ca(HSO4)2为电解质,H+可以在该物质中自由移动,a电极附着Li2S。
Li2S。
下列说法错误的是( )A.电池放电时,电子由电极a经过导线流向电极bB.电池放电时,H+由质子交换膜右侧向左侧迁移C.负极反应式为(7-x)H2S +Li2S-(14-2x)e-=Li2S8-x+(14-2x)H +D.若0.1 mol NO和0.1 mol NO2组成的混合物在b极参与反应,a极增重9.6 g5.海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。
资料收集于网络,如有侵权请联系网站删除.离子浓度大小比较专练1(07年山东理综·14)氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是?)(Hc A.在通入少量氯气,减小?c(ClO)B.通入少量SO,溶液的漂白性增强2+-+c(ClOC.加入少量固体NaOH,一定有c(Na)=c(Cl D.加入少量水,水的电离平衡向正反-) )应方向移动+HCl+HClOO解析:在氯水中存在如下平衡:Cl+H、H222-+H+ClO。
+-、OHOHA中在通入少量氯气,平衡右移,生成的次氯酸和盐酸增HClO多,氢离子浓度增大有两个方面原因,次氯酸浓度增大和盐酸完全电离,而次氯酸根的增大只受次氯酸浓度增大的影响,故该值增大,错误;B中通入二氧化硫,其与氯气反应生成无漂白性的盐酸和硫酸,漂白性减弱,错误;C中加入少量固体氢氧化钠反应后的溶液仍是电中性的,但酸碱性不为中性,应为弱酸性。
溶液中阴阳++---+)c(H,)+c(ClO离子所带正负电荷总数相等,故存在c(H)+c(Na但是)=c(OH))+c(Cl-),故此等式不成立,错误;c(OHD中加水,即稀释氯水溶液的酸性减弱,应该大于+)减小,所以水的电离平衡向正向移动,正确。
答案:D 即c(H2.(07年广东化学·15)下列各溶液中,微粒的物质的量浓度关系正确的是-1--+)COH)+2c(H)+Lc NaCO溶液:(OH)=c(HCOc(0.1mol·A.33223-1+-))=c(Cl.0.1mol·L 溶液:NHClc(NHB44C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:()OHHCOOcc(Na)>(CH)>c()>3 5的混合溶液:.向硝酸钠溶液中滴加稀盐酸+-+-c得到的DpH=-+)NOcNaC()=(3只供学习与交流.资料收集于网络,如有侵权请联系网站删除解析:溶液中离子浓度大小比较要综合运用电离平衡,盐类水解知识,要记住三个守恒:电+-的物质的量相等,OH根据质子守恒,水电离出的H和荷守恒、物料守恒、质子守恒。
A++-+(NH 水解,cB中由于NHH溶液中分别以HCO、H、HCO形式存在,故A对,NaCO4243323-+++--,因为)+ c(CHCOO)错,C中根据电荷守恒有:c(Na)+ c(H)==c(OH(Cl与c)不等,B3-+--++c(H)>c(OH),故c(CHCOO)>c(Na),C错。
D中Na、NO不水解加入稀盐酸后二33者的物质的量浓度比仍是1:1,故D对。
答案:AD3.(08年广东化学·17)盐酸、醋酸和碳酸氢钠是生活中常见的物质。
下列表述正确的是2--和,溶液中的阴离子只有COOHA.在NaHCO溶液中加入与其等物质的量的NaOH33+-)c(OHc(HCO.BNaHCO溶液中:c(H)=)+332-1CHCOOH溶液加入等物质的量的10 mL0.10 mol·LNaOH后,溶液中离子的浓度C.3+--+)c(H)(CHCOO>)>c(OH由大到小的顺序是:c(Na)>c3D.中和体积与pH都相同的HCl溶液和CHCOOH溶液所消耗的NaOH物质的量相同32--,所以ACO溶液,CO错;会发生水解,生成HCO解析:A中,生成Na33322++--电荷守恒:C(H)+C(Na332+-+-)+C(HC(COCO) 物料守恒:-) )=C(HCO)+2C(CO)+C(OHC(Na)=C(HCO) 33322+--所以B错误。
CO)=C(CO) )+C(OHH两式相减得:C()+C(H323-,因为HAc,相同体积的HCl和PHNaAc,Ac水解呈碱性,故C正确;相同C中,生成错。
答D 所消耗的NaOH的物质的量多,HAc为弱酸,所以HAc的物质的量浓度大,HAcC 案:)下列溶液中有关物质的量浓度关系正确的是·124.(08年江苏化学-+-+) ) + c) + c(M(A) ==c(OHMOHHAA.pH=2的溶液与pH=12的溶液任意比混合:c(H<COONa)c(NaOH)<(CH三种溶液:NaCOONapHB.相等的CH、NaOH和COc3332)COc(Na32溶液等体积混合:COONa和COOH.物质的量浓度相等CCHCH33只供学习与交流.资料收集于网络,如有侵权请联系网站删除--+) + c(CH) == 2cc(CHCOO(H) +2c(OHCOOH)33-1-+2-)c(Ac(HA))>c(H>D.0.1mol·L)的NaHA溶液,其pH=4:c(HA>2解析:选项A中根据电荷守恒,此关系式正确;选项B中pH相等,溶液中的c(OH-)相等,根据酸性越弱,水解越强,所以溶液中c(NaCO)<c(CHCOONa);选项C323++--)……①,由于c(CHCOOH)c(CHCOO)+c(Na)=c(OH)+中根据电荷守恒得:c(H33+-+)2c(Na)=c(CHCOO=c(CHCOONa),且它们等体积混合,由原子守恒得:33+--(CH②,COOH)……将①×2-②得:c;c(CH) == 2c(HCOOH)COO) + ) +2c(OHc(CH333-+,同时也可以判断c(H)>c(OH),溶液呈酸性,即选项D中NaHA溶液的pH =42+---答)>c(A。
)>c(H)>c(HA)HA以电离为主,所以离子浓度的大小顺序是:c(HA2C 、案:A)下列溶液中有关物质的量浓度关系正确的是·125.(08年江苏化学--++) cc(OH(AMOH溶液任意比混合:c(H) + ) + c(M) == .ApH=2的HA溶液与pH=12的<COONa)c(CH三种溶液:c(NaOH)<pH相等的CHCOONa、NaOH和NaCOB.3233)(NaCOc32 COONa溶液等体积混合:CHCOOH和CHC.物质的量浓度相等33+--COOH)cc(HCOO(CH) +2c(OH) + ) == 2c(CH332--+-1)(AA)>(Hc)>c.0.1mol·L(H的NaHA溶液,其pH=4:c(HA)>cD2c(OH相等,溶液中的B中pH解析:选项A中根据电荷守恒,此关系式正确;选项-C;选项<c(CHCOONa))相等,根据酸性越弱,水解越强,所以溶液中c(NaCO)323--++c(CH由于)……①,COOH))=c(OHCOO)+c(CH 中根据电荷守恒得:c(H)+c(Na33-++)COONa),且它们等体积混合,由原子守恒得:2c(Na)=c(CHCOO=c(CH33+--(CH-②得:cCOOH)……②,将①×2;) + c) +2c(CHc(OH(CH) == 2c(HCOOCOOH)333-+,同时也可以判断)=4,溶液呈酸性,即c(H)>c(OH选项D中NaHA溶液的pH2+---答。
所以离子浓度的大小顺序是:c(HA)>c(A)>c(H)>c(HA)HA以电离为主,2C 、案:A-1的V积为入COOH溶液中加体积13徽(609年安理综·)向体为0.05mol·LCH b3-1溶液,下列关系错误L0.05mol·的是KOH..+-(KCOO (CHCOOH) + (CH时:V>.AVcc)>c)3ba3只供学习与交流.资料收集于网络,如有侵权请联系网站删除+-)(OH )>cV时:c (CHCOOH) +c (H.BV=3ba-+-)> c (H)(K )> c (OHC.V<V时:c (CHCOO)>c3ab++--) COO+ c) =c (OH (CH.V与V任意比时:c (K))+ c (HD3baaCOO)=0.05Vn(CHCOOH)+ n(CH:若V>V,醋酸过量,根据物料守恒可知,3ba3+COO溶液,-,由于的CHb,反应后为CHCOOK)= 0.05VVb,则A选项正确;若Va=Vn(K33-,说明碱过量,当碱液ba<VV水解而显碱性,根据质子守恒可知,B选项正确;若-+选项符合电荷守恒,DC选项错误;c(CHCOO),加的量足够多,则可以存在c(K)>3C 、正确。
答案:A下列浓度关系正确的是9)7(09年广东化学·--)+C(HCl)} cc(ClO(Cl)+A.氯水中:c(Cl)=22---+) (ClO(OH)>)>c(Hc)>B.氯水中:c(Clc-+) COO)=c(CHC.等体积等浓度的氢氧化钠与醋酸混合:c(Na3+--+2-)(H)>)>c(OHc)>cD.NaCO溶液中:c(Na(HCO)>c(CO3332,+HO=HCl+HClOA错误;Cl解析:氯气在水中与水反应是可逆反应,物料守恒不成立,22++-+浓度一定大,所以Cl与H浓度相等,再加上HClO会电离出HCl中电离的HH-错误;等体积等浓度的氢氧化钠与醋酸混合恰好完全反应生成醋酸ClB浓度,于-+-D 错误。
答案:的浓度,NaC浓度大于CH钠,因CHCOOCOO水解,所以33)下列溶液中微粒的物质的量浓度关系正确的是·138(09年江苏化学2-+1-)(SO(Na)>cc溶液至中性:溶液中滴加L.室温下,向0.01mol·NaOHNHHSOA444+-+)(H=c>c(NH)>c(OH) 4 )>c(H(OHc(Na)>c)>c(HCO) NaHCO溶液:.B0.1mol·L33+-+-1--+--)(HCO2(Hc)=c(HCO)+(OHc)c COC.Na溶液:332321-混合溶液:COONaCHL℃时,D.25pH=4.75、浓度均为0.1mol·COOH、CH的33+-<(OH+COO(CHc)c)c+33只供学习与交流.-)(HcCOOH)(CH资料收集于网络,如有侵权请联系网站删除HCO B项,NaHCO溶液中,OH解析:33-由电--水解和水的电离所出成的,但是这些都是由荷项,大于故错;DOH浓度,-的浓度永是微弱的。
HCO 3-+-+由物料(Na) ,(H)=c)+c守恒有:c(CHCOO)+c(OH3-+,将两)+c(CHCOOH)守恒可得:2c(Na)= c(CHCOO33-+-(HCOO)+2c)=2c(OH) 式中的c(Na消去,可得c(CH3++---)c(H)。
所以)+ c(CHCOOH)c(CHCOO)+c(OH-33-+(H 故c,)-c(OH),因为pH=4.75(H(CHcCOOH)= c3-+,所以D项不等式应为”>”,故错。