高中学业水平化学离子浓度大小比较(基础)
- 格式:doc
- 大小:174.50 KB
- 文档页数:4


高二化学溶液中离子浓度大小比较专题相关知识点:1、电解质的电离电解质溶解于水或受热熔化时,离解成能自由移动的离子的过程叫做电离。
强电解质如NaCl、HCl、NaOH等在水溶液中是完全电离的,在溶液中不存在电解质分子。
弱电解质在水溶液中是少部分发生电离的。
25℃0.1mol/L的如CH3COOH溶液中,CH3COOH的电离度只有1.32%,溶液中存在较大量的H2O和CH3COOH分子,少量的H+、CH3COO-和极少量的OH-离子。
多元弱酸如H2CO3还要考虑分步电离:H2CO3H++HCO3-;HCO3-H++CO32-。
2、水的电离水是一种极弱的电解质,它能微弱地电离,生成H3O+和OH-,H2O H++OH-。
在25℃(常温)时,纯水中[H+]=[OH-]=1×10-7mol/L。
在一定温度下,[H+]与[OH-]的乘积是一个常数:水的离子积Kw=[H+]·[OH-],在25℃时,Kw=1×10-14。
在纯水中加入酸或碱,抑制了水的电离,使水的电离度变小,水电离出的[H+]水和[OH-]水均小于10-7mol/L。
在纯水中加入弱酸强碱盐、弱碱强酸盐,促进了水的电离,使水的电离度变大,水电离出的[H+]水或[OH-]均大于10-7mol/L。
3、盐类水解在溶液中盐的离子跟水所电离出的H+或OH-生成弱电解质的反应,叫做盐类的水解。
强酸弱碱盐如NH4Cl、Al2(SO4)3等水解后溶液呈酸性;强碱弱酸盐如CH3COONa、Na2CO3等水解后溶液呈碱性。
多元弱酸盐还要考虑分步水解,如CO32-+H2O HCO3-+OH-、HCO3-+H2O H2CO3+OH-。
4、电解质溶液中的守恒关系电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。
如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)推出:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]如Na2CO3溶液中:c(Na+) +c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。

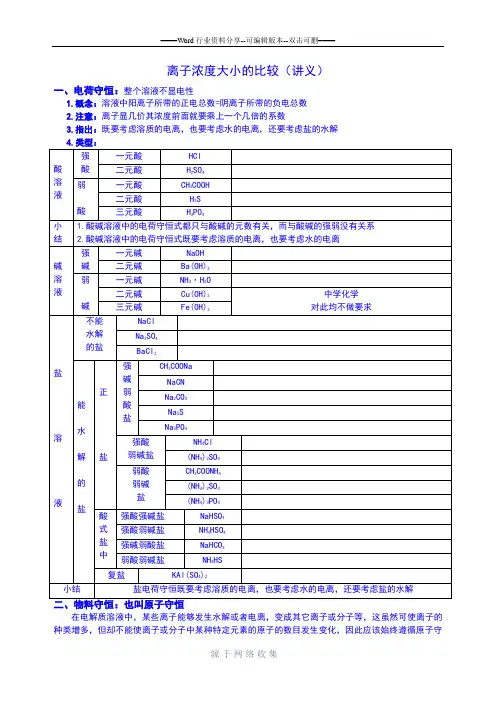
离子浓度大小的比较(讲义)一、电荷守恒:整个溶液不显电性1.概念:溶液中阳离子所带的正电总数=阴离子所带的负电总数2.注意:离子显几价其浓度前面就要乘上一个几倍的系数3.指出:既要考虑溶质的电离,也要考虑水的电离,还要考虑盐的水解在电解质溶液中,某些离子能够发生水解或者电离,变成其它离子或分子等,这虽然可使离子的种类增多,但却不能使离子或分子中某种特定元素的原子的数目发生变化,因此应该始终遵循原子守恒。
1.某一种原子(团)的数目守恒:若已知以下各电解质的浓度均为0.1mol/L则它电离或水解出的各种粒子的浓度之和就等于0.1mol/L此比例来自于化学式且与化学式一致(三)质子守恒:2.范围:只有可水解的盐溶液中才存在着质子守恒②酸式盐:以NH(1)当C(NH4Cl)≤C(NH3·H2O)、C(NaAC)≤C(HAC)时,电离大于水解,水解忽略不计。
(2)电离大于水解的NaHSO3(3)水解大于电离的NaHCO3四、分析思路:1、电荷守恒:溶液整体呈现电中性。
如NaHCO3溶液中存在的离子有:溶质NaHCO3提供的:Na+、HCO3-、以及由碳酸氢根电离出得CO32-、碳酸氢根水解生成的碳酸分子因为整体呈电中性,因此不用考虑溶剂H2O提供的:H+、OH-溶液整体呈现电中性,所以有:n(Na+)+n(H+)=n(HCO3—)+2n(CO32—)+n(OH—)推出:c(Na+)+c(H+)=c(HCO3—)+2 c(CO32—)+c(OH—)2、物料守恒(元素守恒)如NaHCO3溶液中n(Na+):n(c)=1:1,溶液只能提供H、O两种元素,不影响Na、C元素之间的比例关系。
并且C元素在溶液中有三种存在状态推出:c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3)这种元素间的恒定的比例关系就是元素守恒,或者叫物料守恒。
物料守恒注意:找到除H、O外的元素比值关系3、质子守恒如NaHCO3溶液中所以质子守恒可以表示为:C(H+)H2O==C(OH-)H2OC(H+)H2O== C(H+)aq+C(H2CO3)C(OH-)H2O== C(OH-)aq+C(CO32-)推出:C(H+)aq+C(H2CO3)== C(OH-)aq+C(CO32-)或者表示为:C(H+)+C(H2CO3)== C(OH-)+C(CO32-)典型例题类型:一、单一溶液离子浓度比较:例1:在0.1 mol/l的CH3COOH溶液中,下列关系正确的是()A.C(CH3COOH)>C(H+)>C(CH3COO-)>C(OH-)B.C(CH3COOH)>C(CH3COO-)>C(H+)>C(OH-)C.C(CH3COOH)>C(CH3COO-)=C(H+)>C(OH-)D.C(CH3COOH)>C(CH3COO-)>C(OH-)>C(H+)例2:在氯化铵溶液中,下列关系正确的是()A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)C.c(NH4+)=c(Cl-)>c(H+)=c(OH-) D.c(Cl-)=c(NH4+)>c(H+)>c(OH-)例3:在0.1 mol·L-1的NaHCO3溶液中,下列关系式正确的是()A.c(Na+)>c(HCO3-)>c(H+)>c(OH-) B.c(Na+)+c[H+]=c(HCO3-)+c(OH-)+2c(CO32-) C.c(Na+)=c(HCO3-)>c(OH-)>c(H+) D.c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)例4、在0.1mol/L的Na2CO3溶液中,pH=12,离子浓度从大到小的顺序是:水电离出的[OH-]= ,写出电荷守恒的式子:,写出物料守恒的式子:,写出体现水电离出氢离子和氢氧根离子浓度相等的式子:。


龙文教育一对一个性化辅导教案学生学校年级高三学科化学教师日期 4.27 时段次数课题离子浓度大小比较考点分析离子浓度大小比较在高考中常考教学步骤及教学内容重点、难点1. 使学生理解盐类水解的实质,能初步根据盐的组成判断盐溶液的酸碱性。
2. 学会并掌握盐类水解的离子方程式。
了解指示剂的变色范围,学会用pH试纸测定溶液的pH值。
3. 了解盐类水解在工农业生产和日常生活中的应用。
知识点分析:(一)盐类的水解实验:把少量的醋酸钠、氯化铵、氯化钠的晶体分别投入三个盛有蒸馏水的试管,溶解,然后用pH试纸加以检验。
现象:CH3COONa pH>7 )()(-+<OHcHcNH4Cl pH<7 )()(-+>OHcHcNaCl pH=7 )()(-+=OHcHc思考:醋酸钠、氯化铵都是盐,是强电解质,他们溶于水完全电离成离子,电离出的离子中既没有氢离子,也没有氢氧根离子,OH-与H+毫无疑问都来自于水的电离;也就是说,由水电离出来的H+和OH-的物质的量浓度总是相等的,为什么会出现不相等的情况呢?分析:醋酸钠电离出来的离子跟水发生了作用。
CH3COO-能与水溶液中的氢离子结合生成难电离的醋酸分子,从而使水的电离向正反应方向移动,这时,)(3-COOCHc下降,)(-OHc升高、)(+Hc下降,使得)()(-+<OHcHc,溶液呈碱性。
化学方程式为:CH3COONa + H2O CH3COOH +NaOH同样,NH4Cl溶液中:化学方程式为:NH4Cl + H2O NH3·H2O + HCl1. 盐类的水解:在溶液中由盐电离出的弱酸的阴离子或弱碱的阳离子跟水电离出的氢离子或氢氧根离子结合生成弱电解质弱酸或弱碱,破坏了水的电离平衡,使其平衡向右移动,引起氢离子或氢氧根离子浓度的变化。
醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离子和水电离出的氢离子结合生成弱电解质醋酸的过程。

高考总复习离子浓度的大小比较(基础)【高考展望】电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。
多年以来全国高考化学试卷年年涉及这种题型,受到高考命题者的青睐。
这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH值、离子反应、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力。
【方法点拨】解答此类题时必须有正确的思路,首先确定平衡溶液中的溶质,是单一溶质,还是含多个溶质;然后从宏观和微观上进行分析。
宏观上掌握解题的三个思维基点即抓住三大守恒:电荷守恒、物料守恒、质子守恒,并能做出相应的变形。
微观上抓住电离平衡、水解平衡,分清主次。
总的来说就是要先整体,后局部;先宏观,后微观;先定性,后定量。
【知识升华】一、电解质溶液中的守恒关系1.电荷守恒:⑴电荷守恒的含义:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等.⑵电荷守恒式的书写:如Na2CO3溶液中由于存在下列电离和水解关系:Na2CO3=2Na++CO32-,H2O H++OH-,CO32-+H2O HCO3-+OH-,H2O+HCO3-H2CO3+OH-,所以溶液中所有的阳离子有Na+、H+,阴离子有CO32-、HCO3-、OH-,根据电荷守恒有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)。
又如CH3COONa溶液中由于存在下列电离和水解关系:CH3COONa=CH3COO-+Na+,CH3COO-+H2O CH3COOH+OH-,H2O H++OH-,所以溶液中所有的阳离子为Na+、H+,所有的阴离子为CH3COO-、OH-,因此电荷守恒式为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)。
【注意】书写电荷守恒式必须做到:①准确的判断溶液中离子的种类;②弄清离子浓度和电荷浓度的关系。
2.物料守恒:⑴含义:指某微粒的原始浓度等于它在溶液中各种存在形式的微粒浓度之和。

高考总复习离子浓度的大小比较(基础)【高考展望】电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。
多年以来全国高考化学试卷年年涉及这种题型,受到高考命题者的青睐。
这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH值、离子反应、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力。
【方法点拨】解答此类题时必须有正确的思路,首先确定平衡溶液中的溶质,是单一溶质,还是含多个溶质;然后从宏观和微观上进行分析。
宏观上掌握解题的三个思维基点即抓住三大守恒:电荷守恒、物料守恒、质子守恒,并能做出相应的变形。
微观上抓住电离平衡、水解平衡,分清主次。
总的来说就是要先整体,后局部;先宏观,后微观;先定性,后定量。
【知识升华】一、电解质溶液中的守恒关系1.电荷守恒:⑴电荷守恒的含义:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等.⑵电荷守恒式的书写:如Na2CO3溶液中由于存在下列电离和水解关系:Na2CO3=2Na++CO32-,H2O H++OH-,CO32-+H2O HCO3-+OH-,H2O+HCO3-H2CO3+OH-,所以溶液中所有的阳离子有Na+、H+,阴离子有CO32-、HCO3-、OH-,根据电荷守恒有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)。
又如CH3COONa溶液中由于存在下列电离和水解关系:CH3COONa=CH3COO-+Na+,CH3COO-+H2O CH3COOH+OH-,H2O H++OH-,所以溶液中所有的阳离子为Na+、H+,所有的阴离子为CH3COO-、OH-,因此电荷守恒式为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)。
【注意】书写电荷守恒式必须做到:①准确的判断溶液中离子的种类;②弄清离子浓度和电荷浓度的关系。
2.物料守恒:⑴含义:指某微粒的原始浓度等于它在溶液中各种存在形式的微粒浓度之和。

离子浓度大小的比较一、基本方法与基础知识(1)紧抓两个“微弱”:比较离子或溶质微粒浓度大小,考查的内容通常既与盐的水解有关,又与弱电解质的电离平衡有关,而这两个平衡变化的共同特征是“微弱”。
①弱电解质微弱电离,如稀醋酸溶液中,各粒子浓度由大到小的顺序为>)COOH CH (c 3 )OH (c )COO CH (c )H (c 3--+>>。
多元弱酸分步电离,以第一步为主,如S H 2溶液中:)OH (c )HS (c )H (c )S H (c 2--+>>>;②弱酸(碱)根离子的水解是微弱的,如Cl NH 4溶液中:>>>++-)H (c )NH (c )Cl (c 4)OH (c -。
多元弱酸根分步水解,以第一步为主,如S Na 2溶液中:)OH (c )S (c )Na (c 2--+>> )H (c )HS (c +->>。
(2)牢记三个“守恒”:任何溶液中均存在电荷守恒和物料守恒,正盐溶液中还存在质子守恒,如0.1 mol/L 的S Na 2溶液中:①电荷守恒关系式为+=+-++)S (c 2)H (c )Na (c 2 )OH (c )HS (c --+;②物料守恒关系式为:)]S (c )HS (c )S H (c [2)Na (c 22--+++=;③质子守恒关系式为:)S H (c 2)HS (c )H (c )OH (c 2++=-+-[酸式盐中因酸根离子电离可提供+H ,故不存在此等式]。
二、典例分析例1 下列溶液中,各微粒的物质的量浓度关系正确的是( )。
A. 32CO Na L /mol 1.0溶液:)CO H (c 2)H (c )HCO (c )OH (c 323++=+--B. 0.1 mol/L Cl NH 4溶液:)Cl (c )NH (c 4-+=C. 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:)COO CH (c )Na (c 3-+> )OH (c )H (c -+>>D. 向硝酸钠溶液中滴加稀盐酸得到pH =5的混合溶液:)NO (c )Na (c 3-+=解析:本题涉及单一溶液和混合溶液问题,A 项符合质子守恒原理;B 项中+4NH 水解,有);NH (c )Cl (c 4+->C 项中应有)COO CH (c )Na (c 3-+<,题给关系式不符合电荷守恒原理;D 项中加入稀盐酸与硝酸钠不反应,且硝酸钠为强电解质,故有)NO (c )Na (c 3-+=。

适用精选文件资料分享2012 届高考化学第一轮基础知识归纳复习离子浓度大小比较离子浓度大小比较编号: 31 班级组别姓名 .【学习目标】1、能够正确地判断离子浓度的大小。
2 、小组合作研究守恒法判断离子浓度的方法。
3 、以极度的热忱倾尽全力投入课堂,体验学习的快乐。
【使用说明】利用一节课完成导教课方案,收齐后及时批阅。
下节课学生先自纠10 分钟,此后针对不会的问题讨论 10 分钟,学生展现教师点拨20 分钟,最后用 5 分钟搞好落实并进行当堂检测。
【基础自学】离子浓度大小比较 1 、单一溶质溶液:( 离子浓度按由大到小的序次摆列) Na2CO3 溶液_____________________________________________ NaHCO3溶液_____________________________________________ 、2混杂溶液:例 1.物质的量浓度同样的CH3COOH与 CH3COONa溶液等体积混杂后,溶液中离子浓度关系错误的选项是( ) A .c(Na+) + c(H+) =c(OH-) + c(CH3COO-) B.c(CH3COOH)+ c(CH3COO-) =2c(Na+) C.c(CH3COO -)>c(Na+) >c(CH3COOH)>c(H+) >c(OH-) D .c(CH3COO-) >c(Na+) >c(H+) >c(CH3COOH)>c(OH-) 练习 1.将溶液和的 NaOH溶液等体积混杂后,溶液中 c(Na+) >c(CN-) ,以下关系式正确的选项是( ) A.c(HCN)<c(CN-) B.c(H+)<c(OH -) C .c(HCN)-c(CN-) =c(OH-) D .c(HCN)+c(CN-) =0.2 mol/L 【小结】混杂溶液中离子浓度大小的比较方法:3、不同样溶液中同一离子浓度大小比较:例 2.等物质的量浓度的以下四种溶液中, NH4+浓度最大的是 ( ) A .NH4Cl B.NH4 HCO3C.NH4HSO4D.NH4NO3【小结】不同样溶液中同一离子浓度大小比较方法:4、溶液中的守恒关系:例3:在Na2CO3溶液中以下关系式错误的是( ) A .c(Na+) + c(H+) = c(OH-) + c(CO32 -) B .c(OH-)=c(H+) + c(HCO3-) + 2c(H2CO3) C.c(Na+) = 2c(CO32-) +2c(HCO3-) + 2c(H2CO3) D.c(Na+) + c(H+) = c(OH -) + 2c(CO32 -) + c(HCO3-) 【合作研究】★★ 1、某二元酸 ( 化学式 H2A 表示 )在水中的电离方程式为: H2A=H+ + HA-; HA- H+ + A2 -请回答以下问题:⑴ Na2A 溶液显 ( 填“酸性”“中性”或“碱性” ) ,理由是 ( 用离子方程式表示 ) __________⑵ 若溶液的PH=2,则溶液中 H+的物质的量浓度可能 0.11mol/L(填“>” “<”或“=” ) ,原由是⑶ 溶液中各种离子浓度由大到小的序次是______ 2、现有常温下的纯碱溶液:⑴ 你以为该溶液呈碱性的原由是( 用离子方程式表示 ) :________________________。

高中化学盐溶液中离子浓度大小的比较总结(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学盐溶液中离子浓度大小的比较总结(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学盐溶液中离子浓度大小的比较总结(word版可编辑修改)的全部内容。
盐溶液中离子浓度的大小比较既是一个重要知识点,也是高中化学一个难点,但只要掌握了有关知识、原理和规律,结合解题技巧,就能轻车熟路,达到举一反三的最佳效果。
一、基本知识在盐溶液中存在着水的电离平衡,可能还有盐的水解、电离平衡,所以就有下列关系:1.c(H+)与c(OH-)的关系:中性溶液:c(H+)=c(OH-)(如NaCl溶液)酸性溶液:c(H+)>c(OH-)(如NH4Cl溶液)碱性溶液:c(H+)<c(OH-)(如Na2CO3溶液)恒温时:c(H+)·c(OH-)=定值(常温时为10-14)2.电荷守恒:盐溶液中阴、阳离子所带的电荷总数相等。
如NH4Cl溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-)如Na2CO3溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3—)+c(OH-)3.物料守恒:某元素各种不同存在形态的微粒,物质的量总和不变。
如0.1mol/LNH4Cl溶液中:c(NH4+)+c(NH3·H2O)=0.1mol/L如0.1mol/LNa2CO3溶液中:c(CO32-)+c(HCO3-)+c(H2CO3)=0。
1mol/L二、解题方法和步骤1。
判断水解、电离哪个为主。
(1)盐离子不水解不电离:强酸强碱盐,如NaCl、Na2SO4等.(2)盐离子只水解不电离:强酸弱碱或弱酸强碱形成的正盐,如NH4Cl、Na2CO3等.(3)盐离子既水解又电离:多元弱酸形成的酸式盐,以水解为主的有NaHCO3、NaHS、Na2HPO4等;以电离为主的有NaHSO3和NaH2PO4等.(4)根据题意判断:如某温度下NaHB强电解质溶液中,当c(H+)>c(OH-)时,以HB-的电离为主;当c(H+)<c(OH-)时,以HB-的水解为主。
【巩固练习】一、选择题:(每题有1-2个选项符合题意)1.在0.1mol/L的NaHCO3溶液中,下列关系式正确的是()A.c(Na+)>c(HCO3-)>c(H+)>c(OH-)B.c(Na+)=c(HCO3-)>c(OH-)>c(H+)C.c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)D.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)2.对于0.1 mol·L―1 Na2SO3溶液,正确的是()A.升高温度,溶液的c (OH―)降低B.c (Na+)=2c (SO32―)+c (HSO3―)+c (H2SO3)C.c (Na+)+c (H+)=2c (SO32―)+2c (HSO3―)+c (OH―)D.加入少量NaOH固体,c (SO32―)与c (Na+)均增大3.25 ℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是()A.c(NH+4)= c(SO2-4)B.c(NH+4)>c(SO2-4)C.c(NH+4)<c(SO2-4)D.c(OH-)+c(SO2-4)= c(H+)=c(NH+4)4.常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是()A. pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)B. pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-)C. pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)D. pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)5.常温下,一定量的醋酸中逐滴滴加氢氧化钠溶液发生中和反应。
下列说法不正确的是()A.在任何情况下都存在c(CH3COO-) +c(OH-) = c(Na+)+c(H+)B.当溶液中c(CH3COO-)>c(Na+)时,溶液不可能显中性C.当溶液中pH<7时,一定是醋酸过量D.当溶液中pH>7时,醋酸不可能过量6.常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:实验编号c(HA)/mol·L-1c(NaOH)/mol·L-1反应后溶液pH 甲0.1 0.1 pH= 9乙c10.2 pH=7下列判断不正确...的是()A. c1一定大于0.2 mol·L-1B. HA的电离方程式是HA H+ + A-C. 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+)D. 乙反应后溶液中:c(Na+) < c(HA) + c(A-)7.关于浓度均为0.1 mol·L―1的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是()A.溶液的pH:①>③>②B.水电离出的c (H+):③>②>①C.①和②等体积混合后的溶液:c (H+)=c (OH-)+c (NH3·H2O)D.①和③等体积混合后的溶液呈碱性:c (NH4+)>c (Cl-)>c (OH-)>c (H+)8.将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是()A c(HCN)<c(CN-)B c(Na+)>c(CN-)C c(HCN)-c(CN-)=c(OH-)D c(HCN)+c(CN-)=0.1mol·L-19.室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的pH叙述错误的是()A.若pH>7,则一定是c1V1=c2V2B.在任何情况下都是c (Na+)+c (H+)=c (CH3COO―)+c (OH―)C.当pH=7时,若V1=V2,则一定是c1<c2D.若V1=V2,c1=c2,则c (CH3COO-)+c (CH3COOH)=c (Na+)10.下列溶液中,粒子的物质的量浓度关系正确的是()A.0.1 mol/L Na2CO3溶液:c(Na+)=2c(H2CO3)+2c(HCO3—)+2c(CO32-)B.0.1 mol/L NH4Cl溶液:c(NH4+)=c(Cl-)C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3—)二、填空题:1.常温下,将0.1000 mol∙L-1 NaOH溶液滴入20.00 mL 0.1000 mol∙L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示。
(1)HA与NaOH溶液反应的离子方程式是。
(2)图中②点所示溶液中,下列粒子的浓度关系正确的是(填序号)。
a.2c(Na+)= c(HA)+c(A-)b.c(Na+)+c(H+)=c(A-)+c(OH-)c.c(Na+)>c(A-)>c(H+)>c(OH-)(3)图中③点所示滴入的NaOH溶液的体积V 20.00 mL(填“>”、“<”或“=”)。
2.已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:①c(CH3COO-)>c(Na+)>c(H+)>c(OH-)②c(Na+)>c(OH-)>c(CH3COO-)>c(H+)③c(Na+)>c(CH3COO-)>c(OH-)>c(H+)④c(CH3COO-)>c(H+)>c(Na+)>c(OH-)填写下列空白:(1)若溶液中溶解了一种溶质,则该溶质是________(用化学式表示),上述四种离子浓度的大小顺序为________(填序号).(2)若上述关系①是正确的,则溶液中的溶质为________________(用化学式表示);若上述关系②是正确的,则溶液中的溶质为________________(用化学式表示).(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH)________c(CH3COOH)(填“大于”、“小于”或“等于”,下同),混合前碱中c(OH-)和酸c(H+)的关系c(OH-)________c(H+).【答案与解析】一、选择题1. CD【解析】由于溶液中存在下列电离和水解过程:NaHCO3=Na++HCO3—,H2O H++OH-,HCO3—H++CO32—,HCO3—+H2O H2CO3+OH—,所以溶液呈碱性,因此离子浓度大小关系为:c(Na+)>c(HCO3—)>c(OH—)>c(H+)。
电荷守恒关系为:c(Na+)+c(H+)=c(HCO3—)+c(OH—)+2c(CO32-),物料守恒关系为:c(Na+)=c(HCO3—)+c(CO32-)+c(H2CO3),故CD项正确。
2. D【解析】SO32―水解方程式为:SO32―+H2O HSO3―+OH―,HSO3―+H2O H2SO3+OH―,升温,平衡向正反应方向移动,c (OH―)增大,A错;根据物料守恒可知,c (Na+)=2c (SO32―)+2c (HSO3―)+2c (H2SO3),B错;根据电荷守恒可知,c (Na+)+c (H+)=2c (SO32―)+c (HSO3―)+c (OH―),C错;加入NaOH固体,水解平衡受到抑制,c (SO32―)增大,c (Na+)增大,D正确。
3.B【解析】当溶液pH=7,则溶液中c(H+)=c(OH-),由于溶液中的电荷守恒,即溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数:c(H+)+c(NH4+)=c(OH-)+2c(SO42-),则c(NH4+)=2c(SO42-)。
4.AD【解析】NaOH与CH3COOH混合,若pH>7,则二者可能恰好反应或碱过量,但不论哪种情况,都有c(Na +)>c(CH3COO-),,A不正确。
根据电荷守恒知c(Na+)+c(H+)=c(CH3COO-)+c(OH-),B正确;若pH<7,则酸过量,当CH3COOH过量较多时,可使C选项成立。
D违反电荷守恒,不成立,故本题答案为A、D。
5.D【解析】B.当溶液中c(CH3COO-)>c(Na+)时,由电荷守恒,必有c(H+)> c(OH-),溶液不可能显中性。
D.当溶液中pH>7时,溶质可能是CH3COONa和少量的醋酸。
6.C【解析】甲组反应后溶液pH= 9,说明HA为一元弱酸。
乙组反应后溶液pH= 7,说明HA稍过量,c1一定大于0.2 mol·L-1,由物料守恒知乙反应后溶液中:c(Na+) < c(HA) + c(A-)。
7.B【解析】A项,氨水呈碱性pH最大,盐酸是酸,pH最小,氯化铵虽水解呈酸性,但水解只有少部分,故pH居中,故正确;B项,氨水和盐酸均抑制水的电离,而氯化铵水解促进水的电离,即氯化铵中水电离出的c (H+)最大,氨水是弱碱,对于水电离的抑制作用小于强酸盐酸,故水电离出的c (H+)是③>①>②,故不正确;C项,①和②等体积混合后的溶液为NH4Cl溶液,根据质子守恒,故正确;D项;①和③等体积混合后的溶液呈碱性,故正确。
8.BD【解析】设溶液体积各为1L ,则二者反应后溶液中溶质为:0.05mol·L-1NaCN和0.05mol·L-1HCN,由题知混合后溶液显碱性,则NaCN水解程度大于HCN电离程度,即水解生成HCN大于HCN的电离,所以c(HCN)>c(CN-);电荷守恒关系为:c(Na+)+ (H+)=c(CN-)+ c(OH-) ,因为c(OH-)>c(H+),所以c(Na+)>c(CN-)。
9.A【解析】A选项错误,恰好完全反应时生成的CH3COONa,溶液固然显碱性,但显碱性时还有可能是NaOH 过量,也可能是醋酸略过量,即pH>7,可能是c1V1=c2V2(溶质CH3COONa),也可能是c1V1>c2V2(溶质为NaOH和CH3COONa),还可能是c1V1<c2V2(溶质为大量的CH3COONa和少量的CH3COOH)。
B选项正确,电荷守恒原理应用。
C选项正确,pH=7说明溶液显中性,且V1=V2,溶质只可能为CH3COONa 和稍过量的CH3COOH,即c1<c2。
D选项正确,c1V1=c2V2时,由物料守恒可知D正确。
10. AD【解析】A项属于物料守恒,正确;B项因NH4+水解而消耗,应为c(NH4+)<c(Cl-),错误;C项因混合溶液显酸性,故CH3COOH的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),错误;D项中因NaNO3属强酸强碱盐而不水解,所以c(Na+)=c(NO3—),正确.二、填空题1.【答案】(1)HA+OH—=A—+H2O (2)ab (3)<【解析】在原点,pH<7,说明HA为弱酸;图中②点所示溶液中溶质为等物质的量HA和NaA,由物料守恒有:2c(Na+)= c(HA)+c(A-);由电荷守恒有:c(Na+)+c(H+)=c(A-)+c(OH-)。