高中化学第三章烃的含氧衍生物本章重难点专题突破7
- 格式:doc
- 大小:141.00 KB
- 文档页数:5
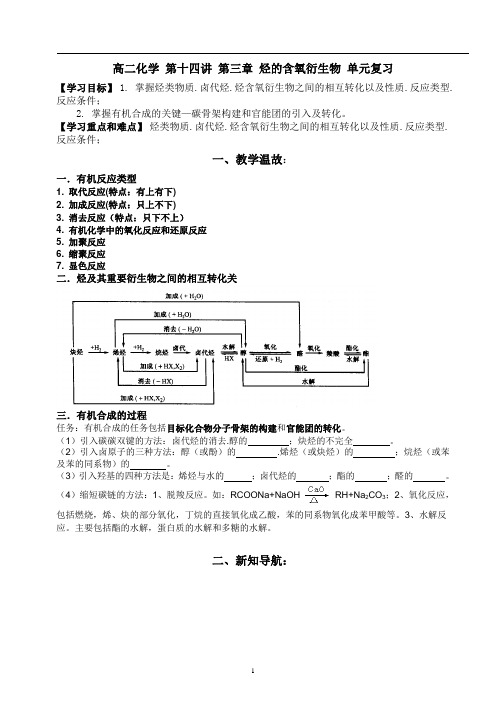
高二化学第十四讲第三章烃的含氧衍生物单元复习【学习目标】1. 掌握烃类物质.卤代烃.烃含氧衍生物之间的相互转化以及性质.反应类型.反应条件;2. 掌握有机合成的关键—碳骨架构建和官能团的引入及转化。
【学习重点和难点】烃类物质.卤代烃.烃含氧衍生物之间的相互转化以及性质.反应类型.反应条件;一、教学温故:一.有机反应类型1. 取代反应(特点:有上有下)2. 加成反应(特点:只上不下)3. 消去反应(特点:只下不上)4. 有机化学中的氧化反应和还原反应5. 加聚反应6. 缩聚反应7. 显色反应二.烃及其重要衍生物之间的相互转化关三.有机合成的过程任务:有机合成的任务包括目标化合物分子骨架的构建和官能团的转化。
(1)引入碳碳双键的方法:卤代烃的消去.醇的;炔烃的不完全。
(2)引入卤原子的三种方法:醇(或酚)的 .烯烃(或炔烃)的;烷烃(或苯及苯的同系物)的。
(3)引入羟基的四种方法是:烯烃与水的;卤代烃的;酯的;醛的。
(4)缩短碳链的方法:1、脱羧反应。
如:RCOONa+NaOH RH+Na2CO3;2、氧化反应,包括燃烧,烯、炔的部分氧化,丁烷的直接氧化成乙酸,苯的同系物氧化成苯甲酸等。
3、水解反应。
主要包括酯的水解,蛋白质的水解和多糖的水解。
二、新知导航:3. 关于“有机物相互转化”问题4. 重要有机物间的相互转化关系:以含2个C的烃及烃的衍生物为例.5.羟基氢酸性的强弱比较6. 有机物的化学性质规律(1)凡是含不饱和键( 、、,酯基除外)、的均可以与氢气在一定条件(催化剂、加热、加压)下发生反应。
(2)能发生取代反应的有:烷烃(Cl2光照)、烷烃基(Cl2光照)、苯环( 、)、卤代烃( )、醇( 、)、酚( )、羧酸( )、酯( )等。
(3)与一般试剂的反应①与溴水反应的有、(加成反应),酚类( 反应),—CHO( 反应)。
②能使酸性KMnO4溶液褪色的有、、苯的同系物、、—CHO等。
③凡是含有—OH(如水、醇、酚、羧酸等)的一般都与Na反应生成H2。

重难点十二有机物的结构和性质【要点解读】类别通式官能团代表物分子结构结点主要化学性质卤代烃一卤代烃:R-X多元饱和卤代烃:C n H2n+2-m X m卤原子-XC2H5Br(Mr:109)卤素原子直接与烃基结合β-碳上要有氢原子才能发生消去反应;且有几种H生成几种烯1.与NaOH水溶液共热发生取代反应生成醇2.与NaOH醇溶液共热发生消去反应生成烯醇一元醇:R-OH饱和多元醇:C n H2n+2O m醇羟基-OHCH3OH(Mr:32)C2H5OH(Mr:46)羟基直接与链烃基结合,O-H及C-O均有极性.β-碳上有氢原子才能发生消去反应;有几种H就生成几种烯.α-碳上有氢原子才能被催化氧化,伯醇氧化为醛,仲醇氧化为酮,叔醇不能被催化氧化.1.跟活泼金属反应产生H22.跟卤化氢或浓氢卤酸反应生成卤代烃3.脱水反应:乙醇140℃分子间脱水成醚170℃分子内脱水生成烯4.催化氧化为醛或酮5.一般断O-H键与羧酸及无机含氧酸反应生成酯醚R-O-R′醚键C2H5O C2H5C-O键有极性性质稳定,一般不与物易爆炸氨基酸RCH(NH2)COOH 氨基-NH2羧基-COOHH2NCH2COOH(Mr:75)-NH2能以配位键结合H+;-COOH能部分电离出H+两性化合物能形成肽键蛋白质结构复杂不可用通式表示肽键氨基-NH2羧基-COOH酶多肽链间有四级结构1.两性2.水解3.变性(记条件)4.颜色反应(鉴别)(生物催化剂)5.灼烧分解糖多数可用下列通式表示:C n(H2O)m羟基-OH醛基-CHO羰基葡萄糖CH2OH(CHOH)4CHO淀粉(C6H10O5) n纤维素C6H7O2(OH)3] n多羟基醛或多羟基酮或它们的缩合物1.氧化反应(鉴别)(还原性糖)2.加氢还原3.酯化反应4.多糖水解5.葡萄糖发酵分解生成乙醇油脂酯基可能有碳碳双键酯基中的碳氧单键易断裂烃基中碳碳双键能加成1.水解反应(碱中称皂化反应)2.硬化反应【重难点指数】★★★★【重难点考向一】有机物的结构与性质【例1】化合物X()是一种医药中间体,其结构简式如图所示.下列有关化合物X的说法正确的是( )A.该物质分子式为C10H9O4B.在酸性条件下水解,水解产物只有一种C.分子中所有原子处于同一平面D.1mol化合物X最多能与2molNaOH反应【答案】B【名师点睛】考查有机物的结构与性质,为高频考点,注意体会官能团与性质的关系,有机物含有酯基,可发生水解反应,含有羧基,具有酸性,可发生中和、酯化反应,结合有机物的结构特点解答该题。


第三章 烃的含氧衍生物 第一节 醇 酚一、进行乙醇的消去反应实验时应该注意哪些问题?1.配制体积比为1∶3的乙醇与浓硫酸混合液时,要注意在烧杯中先加入95%的乙醇,然后滴加浓硫酸,边滴加边搅拌,冷却备用(相当于浓硫酸的稀释);浓硫酸起催化剂和脱水剂的作用。
2.加热混合液时,温度要迅速上升到并稳定于170℃左右。
温度低,在140℃时主要产物是乙醚,反应的化学方程式为:2CH 3CH 2OH ――→浓H 2SO 4140℃CH 3CH 2OCH 2CH 3+H 2O 。
3.由于反应物都是液体而无固体,所以要向烧瓶中加入碎瓷片,以防液体受热时发生暴沸。
4.温度计要选择量程在200℃~300℃的为宜。
温度计的玻璃泡要置于反应液的中央位置,因为需要测量的是反应液的温度。
5.氢氧化钠溶液的作用是除去混在乙烯中的CO 2、SO 2等杂质,防止干扰乙烯与溴的四氯化碳溶液和高锰酸钾酸性溶液的反应。
二、醇的消去反应和氧化反应有哪些规律? 1.醇的消去反应规律 醇分子中,只有连有—OH 的碳原子的相邻的碳原子上连有氢原子时,才能发生消去反应而形成不饱和键。
若醇分子中只有一个碳原子或与—OH 相连碳原子的相邻碳原子上无氢原子[如CH 3OH 、(CH 3)3CCH 2OH 、],则不能发生消去反应。
2.醇的催化氧化规律(1)形如RCH 2OH 的醇,被催化氧化生成醛(或羧酸)。
R —CH 2OH ――→Cu 、O 2△R —CHO R —CH 2OH ――→KMnO 4、H+R —COOH(2)形如的醇,被催化氧化生成酮。
(3)形如的醇,一般不能被氧化。
三、苯酚又叫石炭酸,它是酸类物质吗?为什么显酸性?苯酚显酸性,是由于受苯环的影响,使酚羟基比醇羟基更活泼。
苯酚的羟基在水溶液中能够发生电离。
但是苯酚不属于酸类物质。
在应用苯酚的酸性时应注意以下几点:1.苯酚具有弱酸性,可以与活泼金属(如Na)发生反应。
2.苯酚的酸性极弱,不能使酸碱指示剂变色。

烃的含氧衍生物题组训练1.某有机物结构简式为,下列关于该有机物的说法中不正确的是( )A.遇FeCl3溶液显紫色B.与足量的氢氧化钠溶液在一定条件下反应,最多消耗NaOH 3 molC.能发生缩聚反应和加聚反应D.1 mol该有机物与溴发生加成反应,最多消耗1 mol Br2解析A项,有机物分子中存在酚羟基,所以遇FeCl3溶液显紫色;B项,有机物分子中含有一个酚羟基、一个羧基和一个连在苯环上的氯原子,所以1 mol有机物与足量的氢氧化钠反应,最多消耗氢氧化钠4 mol,题中没有明确给出有机物的物质的量;C项,有机物分子中含有碳碳双键,能发生加聚反应,含有羧基和羟基,能发生缩聚反应;D项,1 mol 该有机物中只含有1 mol碳碳双键,与溴发生加成反应时,最多消耗1 mol Br2。
答案 B2.(2018·重庆)有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
X(C24H40O5)H2NCH2CH2CH2NHCH2CH2CH2CH2NH2Y下列叙述错误的是( )A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2OB.1 mol Y发生类似酯化的反应,最多消耗2 mol XC.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强解析X分子中含有3个羟基,1 mol X发生消去反应最多能生成3 mol H2O,A项正确;—NH2、—NH—与—COOH 发生脱水反应,1 mol Y最多消耗3 mol X,B项错误;1 mol X最多能与3 mol HBr发生取代反应,得到有机物的分子式为C24H37O2Br3,C项正确;Y与癸烷都是链状结构,呈锯齿状,Y的极性较强,D项正确。
答案 B3.(双选)普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。
下列关于普伐他汀的性质描述正确的是( )A.能与FeCl3溶液发生显色反应B.能使酸性KMnO4溶液褪色C.能发生加成、取代、消去反应D.1 mol该物质最多可与1 mol NaOH反应解析A项,普伐他汀的结构中不存在酚羟基,故它不能与氯化铁溶液发生显色反应,A项错误;B项,普伐他汀的结构中含有碳碳双键,故它能使酸性高锰酸钾溶液褪色,B项正确;C项,有碳碳双键能发生加成反应,有羟基、羧基、酯基能发生取代反应,有醇羟基还可以发生消去反应,C项正确;D项,1 mol普伐他汀最多可与2 mol NaOH反应(羧基和酯基),D项错误。

高中化学第三章烃的含氧衍生物本章重难点专题突破7
有机合成题是中学化学常见题型,“乙烯辐射一大片,醇、醛、酸、酯一条线”是有机合成的基本思路。
但是这条思路并不是万能的,在有机合成的过程中,有时还需要合成另外的一些物质来“牵线搭桥”。
看起来是舍近求远,实质上是“以退为进”,是一种策略。
在中学阶段,进行有机合成常使用以下三种策略:
1.先消去后加成
使官能团转换位置或数目增多一般都采取先消去后加成的方法,可以由醇或卤代烃先发生消去反应,再与HX、X2或H2O发生加成。
这是有机合成中一种常用的策略。
典例
12在有机反应中,反应物相同而条件不同时,可以得到不同的产物。
下图中的R代表烃基,副产物均已略去。
请写出由CH3CH2CH2CH2Br 转变为CH3CH2CHBrCH3的化学方程式(注明反应条件)。
解析 本题是官能团不变而位置发生变化的情形,即—Br 从1号碳原子移到了2号碳原子上。
根据题给信息,产物CH 3CH 2CHBrCH 3可由CH 3CH 2CH===CH 2与HBr 加成得到;而CH 3CH 2CH===CH 2可由原料CH 3CH 2CH 2CH 2Br 经消去反应得到。
答案 ①CH 3CH 2CH 2CH 2Br +NaOH ――→醇△
CH 3CH 2CH===CH 2↑+NaBr +H 2O ②CH 3CH 2CH===CH 2+HBr ――→适当的溶剂CH 3CH 2CHBrCH 3
2.先保护后复原
在进行有机合成时经常会遇到这种情况:欲对某一官能团进行处理,其它官能团可能会受到“株连”而被破坏。
我们可以采用适当的措施将不需转变的官能团暂时先“保护”起来,当另一官能团已经转变后再将其“复原”。
这是有机合成中又一种常用的策略。
典例
13已知胺(R—NH2)具有下列性质:
Ⅰ.RNH2+CH3COCl―→RNHCOCH3+HCl
Ⅱ.RNHCOCH3在一定条件下可发生水解:
RNHCOCH3+H2O―→RNH2+CH3COOH
对硝基苯胺是重要的化工原料,其合成路线如下:
根据以上合成路线回答:
(1)步骤①的目的是:____________________________________________________。
(2)写出反应②的化学方程式______________________________________________。
解析信息Ⅰ将—NH2转变为—NHCOCH3,信息Ⅱ又将—NHCOCH3转变为—NH2,这很明显是对—NH2采取的一种保护措施。
三步反应分别是①—NH2的保护、②硝化反应、③—NH2的复原。
答案(1)保护氨基(—NH2)
3.先占位后移除
在芳香族化合物的苯环上,往往先引入一个基团,让它占据苯环上一定的位置,反应完毕后再将该基团除去。
这也是有机合成中常用的一种策略。
典例
14已知下列信息:
Ⅰ.在一定条件下甲苯可与Br2发生反应,生成邻溴甲苯与对溴甲苯;
Ⅱ.C6H5—SO3H可发生水解反应生成苯:
C6H5—SO3H+H2O―→C6H6+H2SO4
欲以甲苯为原料合成邻溴甲苯,设计的合成路线如下:
根据以上合成路线回答下列问题:
(1)设计步骤①的目的是____________________________________________________
________________________________________________________________________。
(2)写出反应②的化学方程式:_____________________________________________
________________________________________________________________________。
解析合成的最终结果为仅在甲基的邻位引入了一个溴原子。
根据信息Ⅰ,如果让甲苯与溴直接反应,将生成邻溴甲苯与对溴甲苯,而对溴甲苯并不是我们需要的产物。
为使之不生成对溴甲苯,利用题给信息,可让甲苯与浓硫酸先发生反应,在甲基对位引入一个—SO3H,从而把甲基的对位占据,下一步与溴反应时溴原子只能取代甲基邻位上的一个H原子,最后根据信息Ⅱ将—SO3H去掉即可。
答案(1)在—CH3的对位引入—SO3H,防止在这个位置上引入溴原子而生成副产物对溴甲苯。