宫颈癌-FIGO分期
- 格式:docx
- 大小:20.21 KB
- 文档页数:18


宫颈癌-FIGO分期宫颈癌分期及临床实践指南前言:国际妇产科协会(FIGO)和国际妇科肿瘤协会(IGCS)共同制定的《妇科恶性肿瘤分期及临床实践指南》以循征医学为依据,完整介绍了常见的妇科恶性肿瘤的分期,简明扼要介绍了各种妇科恶性肿瘤的处理原则和治疗方案,对广大妇科肿瘤医师的临床实践有很大的指导意义。
同时,FIGO和IGCS 依据临床诊治的进展对指南进行更新。
中山大学的林仲秋教授等人将目前FIGO和IGCS推广的指南第三版翻译成中文,现摘取宫颈癌分期及临床实践指南的主要内容刊登于中国医学论坛报,希望能更好地推广该指南,促进我国妇科肿瘤诊治水平并和国际相接轨。
最后,感谢FIGO、FIGO妇科肿瘤委员会、IGCS和FIGO妇科肿瘤委员会主席HYS Ngan(颜婉嫦)教授的支持。
曹泽毅中华医学会妇科肿瘤学分会主任委员宫颈癌分期临床-诊断分期宫颈癌的分期根据临床估计,因此必须对所有病人进行仔细的临床检查,最好由有经验的医生在麻醉下进行。
临床分期一定不能因为后来的发现而改变。
如果某一特定患者的分期存在疑问时,必须归于较早的分期。
可以进行以下检查:触诊、视诊、阴道镜、宫颈内膜诊刮、子宫镜、膀胱镜、直肠镜、静脉尿路造影以及肺和骨骼的X线检查。
可疑的膀胱或直肠受累应该通过活检和组织学证据证实。
宫颈锥切或部分切除也被认为是一项临床检查,经此确定的浸润癌也包括在报告中。
可选择的其他检查有:腹腔镜、超声、CT扫描、MRI及正电子发射断层扫描术(PET),这些检查对于确定治疗方案是有价值的,但这些检查一般不易做得,而且结果多变,因而这些检查结果不能作为改变临床分期的依据。
在CT扫描引导下对可疑淋巴结进行细针穿刺抽吸(FNA)有助于确定治疗计划。
术后病理分期经过手术治疗的病例,病理专家可以根据切除组织中的病理改变更精确地描述疾病范围。
这些结果不能改变临床分期,但可以以疾病的病理分期描述方式记录下来。
TNM的分期正适合此目的。

一文读懂宫颈癌的分期明明白白接受治疗分期在癌症诊断和治疗中的作用宫颈癌的分期描述的是疾病的程度:癌症是否仅存在于宫颈内,还是已经侵犯邻近组织和淋巴结,或者已经扩散到身体远处的其他部位。
肿瘤分期是一种标准化的语言和科学的评估体系,并随着肿瘤诊疗的进展和数据的更新而不断修订。
这种标准化的科学体系便于医生和医生之间,医患之间及患者和患者之间的沟通。
详细了解肿瘤的分期,请参阅。
肿瘤分期有助于医生了解癌症的进展情况,做出治疗决定,预测疾病的情况,包括恢复的机会。
分期最主要的两个作用如下:指导治疗以及判断预后。
1、分期指导治疗:不同的分期对应着不同的治疗方式或治疗方式的组合。
0期到IV期的宫颈癌对应的治疗方式(组合)各不相同。
只有明确了分期,才能在多种治疗方法中确定合适的治疗方式和策略。
当然,虽然医学界对不同期别的治疗方式有明确的规范,但医生是否遵守规范或在多大程度上遵守规范就是另一回事了。
2、分期有助于判断病人预后(治愈的机会和存活时间):总体上讲,处于同一分期的病人,其大致的自然生存期是比较一致的,当然也和患者的年龄、总体健康水平等其他因素有关。
宫颈癌最常用FIGO分期及TNM分期FIGO(国际妇产科联合会)分期系统最常用于女性生殖器官的癌症,包括宫颈癌。
除了FIGO分期系统外,宫颈癌也有TNM分期。
本文重点讲述FIGO分期系统,简单的介绍TNM分期系统。
文末还会简单介绍不同分期宫颈癌患者的治疗。
不管是FIGO分期系统,还是TNM分期系统,对于宫颈癌,临床分期是根据医生的体格检查、活检、影像学检查和一些其他检查的结果来进行的。
在一些情况下一些患者也会进行接受其他检查,如膀胱镜检查和直肠镜检查。
临床分期不是基于手术中的发现而制定的。
患者的治疗计划基于临床分期。
如果接受了手术,患者会获得病理分期,但这不会改变患者的临床分期。
术后病理分期如果比临床分期要晚,可能需要调整术后的治疗方案。
宫颈癌FIGO分期最新的版本是2023年发布的,而AJCC的TNM分期是2023年发布的。

宫颈癌的病理分期有哪些种类及其详细内容宫颈癌的病理分期是根据宫颈癌的病理组织学类型、癌细胞浸润深度、局部扩散范围以及淋巴结转移情况等多个因素来确定癌症的严重程度。
常见的宫颈癌病理分期包括以下几种:FIGO 分期:FIGO 分期法是宫颈癌临床治疗中最常用的分期方法。
其主要依据为肿瘤侵犯深度、侵犯范围以及淋巴结转移情况,将宫颈癌分为四个阶段:IA 期:肿瘤仅侵犯宫颈表面上的一层上皮细胞。
IB 期:肿瘤侵犯宫颈的深层组织,但仍未突破宫颈。
IIA 期:肿瘤已经突破宫颈,但未蔓延到盆腔壁或膀胱等周边组织。
IIB 期:肿瘤蔓延到盆腔壁或膀胱等周边组织。
IIIA 期:肿瘤已经侵犯到盆壁、下段阴道、膀胱等周边组织。
IIIB 期:肿瘤已经侵犯到盆腔壁、骨盆侧壁、直肠等周边组织。
IVA 期:癌瘤已经侵犯直肠或膀胱,或者蔓延到远处的组织和器官。
IVB 期:癌瘤蔓延到远处的组织和器官,如肺、肝等。
TNM 分期:TNM 分期是宫颈癌另一个常用的分期方法,将宫颈癌分为四个阶段:T1期:肿瘤仅限于宫颈,未侵犯子宫体。
T2期:肿瘤侵犯宫颈并扩散到子宫体。
T3期:肿瘤侵犯盆腔组织,如下段阴道壁或直肠壁。
T4期:肿瘤侵犯膀胱或直肠、盆壁或扩散到遥远的组织或器官。
N0:没有淋巴结转移。
N1:有淋巴结转移。
N1分期:分为N1、N2、N3三个亚分期。
N1:淋巴结转移在盆腔内,即盆腔淋巴结区域。
N2:淋巴结转移在髂内、髂外淋巴结区域。
N3:淋巴结转移在腹主动脉淋巴结区域或锁骨上淋巴结区域。
M0:没有远处转移。
M1:有远处转移。
综合T、N、M三个分期,可确定宫颈癌的临床分期。
例如,T2N1M0表示宫颈癌侵犯宫颈并扩散到子宫体,且存在盆腔淋巴结转移,没有远处转移。

宫颈癌是女性常见恶性肿瘤,在发展中国家宫颈癌仍是威胁女性健康的主要疾病[1],其原因较复杂,除了缺少宫颈癌筛查计划、缺乏卫生保健设施以及接种疫苗意识淡薄等外,医学诊断治疗也与其密切相关[2]。
临床上根据宫颈癌分期不同,其干预方式差异较大,分期正确与否直接影响到了宫颈癌的治愈率和死亡率,因此明确宫颈癌分期对其治疗和预后意义重大[3]。
目前临床上一般采用国际妇产科协会(FIGO )分期标准,其主要是根据患者临床检查结果进行分期,但受多种临床因素现象,仍然存在FIGO 分期不完整、模糊分期、术后分期修正等现象,有研究对2004~2016年我国宫颈癌住院患者的FIGO 临床分期情况进行调查,结果显示19.1%的宫颈癌病例存在分期不规范现象,60岁以上老年群体的不规范分期比例更高[4]。
近年影像学辅助检查手段在提高宫颈癌FIGO 分期准确性上的优势引起广泛关注,尤其是MRI ,有研究发现MRI 诊断宫颈癌分期的准确率The Diagnostic Value of MRI in Combination with clinical FIGO staging system in stages of cervical cancerLI Jian,XIAO Ke,LI Hongcheng,TU Bo,LIU Jia,XIAO Weiliang,HU XiangDepartment of Radiology,the Second Affiliated Hospital of Chengdu Medical Collegel,Nuclear Industry 416Hospital,Chengdu 610051,China摘要:目的分析MRI 联合临床国际妇产科协会(FIGO )分期标准在宫颈癌不同分期中的诊断价值。
方法选取2014年1月~2020年12月于我院就诊的85例宫颈癌患者,回顾性分析患者临床资料和影像学资料等,与病理结果进行对照,分别使用临床FIGO 分期标准和MRI 联合临床FIGO 分期标准对患者进行诊断分析,并对FIGO 分期和MRI 联合临床FIGO 分期结果进行敏感度、特异性及一致性检验分析,比较MRI 联合临床FIGO 分期与临床FIGO 分期在诊断宫颈癌不同分期上的准确性和一致性。




FIGOGUIDELINESFIGO staging for carcinoma of the vulva,cervix,and corpus uteriFIGO Committee on Gynecologic Oncology 1International Journal of Gynecology and Obstetrics 125(2014)97–98Table 1Cancer of the vulva.FIGO StageDescription ITumor con fined to the vulva IALesions ≤2cm in size,con fined to the vulva or perineum and with stromal invasion ≤1.0mm a ,no nodal metastasis IBLesions N 2cm in size or with stromal invasion N 1.0mm a ,con fined to the vulva or perineum,with negative nodes IITumor of any size with extension to adjacent perineal structures (lower third of urethra,lower third of vagina,anus)with negative nodes IIITumor of any size with or without extension to adjacent perineal structures (lower third of urethra,lower third of vagina,anus)with positive inguinofemoral nodes IIIA(i)With 1lymph node metastasis (≥5mm),or (ii)With 1–2lymph node metastasis(es)(b 5mm)IIIB(i)With 2or more lymph node metastases (≥5m),or (ii)With 3or more lymph node metastases (b 5mm)IIICWith positive nodes with extracapsular spread.IVTumor invades other regional (upper 2/3urethra,upper 2/3vagina),or distant structures IVA Tumor invades any of the following:(i)upper urethral and/or vaginal mucosa,bladder mucosa,rectal mucosa,or fixed to pelvic bone,or(ii)fixed or ulcerated inguinofemoral lymph nodesIVBAny distant metastasis including pelvic lymph nodes a The depth of invasion is de fined as the measurement of the tumor from the epithelial –stromal junction of the adjacent most super ficial dermal papilla to the deepest point of invasion.Table 2Cancer of the cervix uteri.StageDescription IThe carcinoma is strictly con fined to the cervix (extension to the uterine corpus should be disregarded).IA Invasive cancer identi fied only microscopically.(All gross lesions even with super ficial invasion are Stage IB cancers.)Invasion is limited to measured stromal invasionwith a maximum depth of 5mm a and no wider than 7mm.IA1Measured invasion of stroma ≤3mm in depth and ≤7mm width.IA2Measured invasion of stroma N 3mm and b 5mm in depth and ≤7mm width.IB Clinical lesions con fined to the cervix,or preclinical lesions greater than stage IA.IB1Clinical lesions no greater than 4cm in size.IB2Clinical lesions N 4cm in size.II The carcinoma extends beyond the uterus,but has not extended onto the pelvic wall or to the lower third of vagina.IIA Involvement of up to the upper 2/3of the vagina.No obvious parametrial involvement.IIA1Clinically visible lesion ≤4cmIIA2Clinically visible lesion N 4cmIIB Obvious parametrial involvement but not onto the pelvic sidewall.III The carcinoma has extended onto the pelvic sidewall.On rectal examination,there is no cancer free space between the tumor and pelvic sidewall.The tumor involvesthe lower third of the vagina.All cases of hydronephrosis or non-functioning kidney should be included unless they are known to be due to other causes.IIIA Involvement of the lower vagina but no extension onto pelvic sidewall.IIIB Extension onto the pelvic sidewall,or hydronephrosis/non-functioning kidney.IV The carcinoma has extended beyond the true pelvis or has clinically involved the mucosa of the bladder and/or rectum.IVA Spread to adjacent pelvic organs.IVB Spread to distant organs.aThe depth of invasion should not be more than 5mm taken from the base of the epithelium,either surface of glandular,from which it originates.Vascular space invasion should not alter the staging.1Committee members:H.Belhadj (Switzerland),J.Berek (USA),A.Bermudez (Argentina),N.Bhatla (India),J.Cain (USA),L.Denny (Chair;South Africa),K.Fujiwara (Japan),N.Hacker (Australia),E.Åvall-Lundqvist (Sweden),D.Mutch (USA),F.Odicino (Italy),S.Pecorelli (Italy),J.Prat (Spain),M.Quinn (Co-chair;Australia),M.A-F.Seoud (Lebanon),S.K.Shrivastava (India)./10.1016/j.ijgo.2014.02.0030020-7292/©2014Published by Elsevier Ireland Ltd.on behalf of International Federation of Gynecology andObstetrics.Contents lists available at ScienceDirectInternational Journal of Gynecology and Obstetricsj o u r n a l h o m e p a g e :w w w.e l s e vi e r.c o m/l o c a t e /i j g o98International Journal of Gynecology and Obstetrics125(2014)97–98Table3Cancer of the corpus uteri.FIGO StageI a Tumor confined to the corpus uteriIA a No or less than half myometrial invasionIB a Invasion equal to or more than half of the myometriumII a Tumor invades cervical stroma,but does not extend beyond the uterus bIII a Local and/or regional spread of the tumorIIIA a Tumor invades the serosa of the corpus uteri and/or adnexae cIIIB a Vaginal involvement and/or parametrial involvement cIIIC a Metastases to pelvic and/or para-aortic lymph nodes cIIIC1a Positive pelvic nodesIIIC2a Positive para-aortic nodes with or without positive pelvic lymph nodesIV a Tumor invades bladder and/or bowel mucosa,and/or distant metastasesIVA a Tumor invasion of bladder and/or bowel mucosaIVB a Distant metastasis,including intra-abdominal metastases and/or inguinal nodes)a Either G1,G2,or G3.b Endocervical glandular involvement only should be considered as Stage I and no longer as Stage II.c Positive cytology has to be reported separately without changing the stage.。
宫颈癌质量控制指标(2023年版)指标一、宫颈癌患者首次治疗前临床F1GO分期诊断率(CA-CC-O1)敬:首次治疗前完成临床FIGO分期诊断的宫颈癌患者数占接受首次治疗的宫颈癌患者总数的比例。
计算公式:宫颈嬴患者首雌疗前I麻FIGO分期诊断率首次治IT前完成hW1G0分期缅的宫颈®患翻(= ----------------------------------------------------------- ×100%酗凝首冽舒的宫颈虢者总数意义:治疗前全面评价病情是肿瘤规范化治疗的基础。
说明:1首次治疗指针对肿瘤开展的手术、放疗、化疗、靶向治疗、免疫治疗等治疗,不包括为明确诊断或病情而采取的穿刺、活检、检查等诊疗措施。
下同。
2分期方法参见国家卫生健康委发布的《宫颈癌诊疗指南(2023年版)》。
下同。
指标二、宫颈癌患者首次治疗前临床FIGO分期检查评估策略符合率(CA∙CC∙02)敬:首次治疗前临床FIGO分期检查评估符合策略的宫颈癌患者数占接受首次治疗的宫颈癌患者总数的比例。
计算公式:宫颈⅛≡⅛首解疗蒯麻F1Go分跚球评f⅛第饰⅛率首端疗蒯琳FIGo≡m评f⅛符谢解J宫颈S患四= ---------------------------------------------------------------------- ×100%询胺受首次治疗的宫颈®患者总数意义:反映评估病情的规范性。
说月:临床FIGO分期检查评估符合策略是指符合基策略1或基策略2o基策略1:器腔MR1+颈胸腹器腔增强CT+妇科检查;基策略2:岔腔MRI+全身PET-CT+妇科检查。
指标三、宫颈癌患者首次治疗前病理学诊断率(CA-CC-03)定义:首次治疗前完成病理学诊断的宫颈癌患者数占接受首次治疗的宫颈癌患者总数的比例。
计算公式:麓嫄患^首端疗施加畛断率里学诊断的宫颈癌患者数= --------------------------------------------------- ×100%雕螃首冽新的宫颈^患#总数意义:反映宫颈癌治疗的规范性。
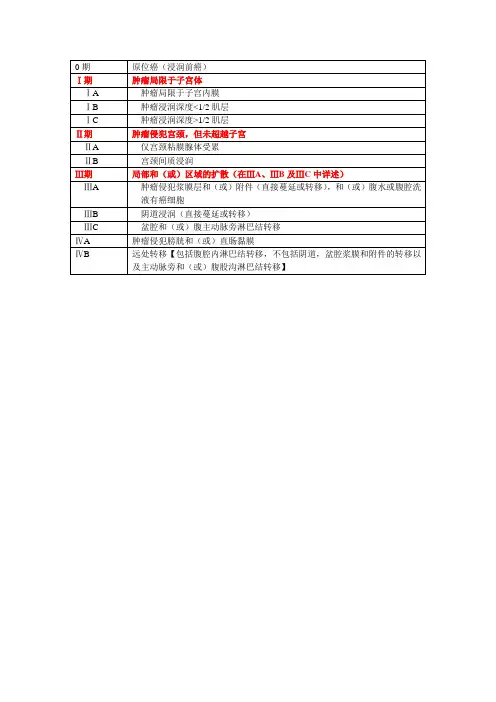
宫颈癌FIGO分期及治疗原则宫颈癌FIGO分期及治疗原则(原创)发表者:王翠红宫颈癌FIGO分期Ⅰ???肿瘤严格局限于宫颈(扩展⾄宫体可以被忽略)ⅠA???镜下浸润癌,间质浸润深度≤5.0mm,⽔平浸润范围≤7.0mmⅠA1??间质浸润深度≤3.0mm,⽔平浸润范围≤7.0mmⅠA2??间质浸润深度>3.0mm,但不超过5.0mm,⽔平浸润范围≤7.0mmⅠB???临床⾁眼可见病灶局限于宫颈,或是临床前病灶⼤于ⅠA期ⅠB1??临床⾁眼可见病灶最⼤直径≤100px(4cm)ⅠB2??临床⾁眼可见病灶最⼤直径>100px(4cm)?Ⅱ?肿瘤已经超出宫颈,但未达盆壁,或未达阴道下1/3ⅡA???⽆宫旁组织浸润ⅡA1??临床⾁眼可见病灶最⼤直径≤100px(4cm)ⅡA2??临床⾁眼可见病灶最⼤直径>100px(4cm)ⅡB???有明显宫旁组织浸润???Ⅲ?肿瘤侵及盆壁和/或侵及阴道下1/3和/或导致肾盂积⽔或⽆功能肾ⅢA???肿瘤侵及阴道下1/3,未侵及盆壁ⅢB???肿瘤侵及盆壁和/或导致肾盂积⽔或⽆功能肾?Ⅳ?肿瘤超出真⾻盆或(活检证实)侵及膀胱或直肠粘膜。
泡状⽔肿不能分为Ⅳ期ⅣA???肿瘤侵及临近器官ⅣB???肿瘤侵及远处器官所有⾁眼可见病灶,即使是浅表浸润也都定义为ⅠB期。
浸润癌局限于测量到的间质浸润范围。
最⼤深度为5mm,⽔平范围不超过7mm。
⽆论从腺上⽪或者表⾯上⽪起源的病变,从上⽪的基底膜量起浸润深度不超过5mm。
浸润深度总是⽤mm来报告,即使那些早期(微⼩)间质浸润(~1mm)。
⽆论脉管间隙受侵,均不改变分期。
直肠检查时,肿瘤与盆腔壁间没有⽆肿瘤间隙。
任何不能找到原因的肾盂积⽔及⽆功能肾病都应包括在内。
宫颈癌分期治疗原则??1.宫颈早期间质浸润癌由于活检标本不能包含全部病变,⽆法进⾏病变范围的测量,宫颈早期间质浸润癌即IA期的准确诊断需⾏锥切活检,并对切缘阴性的锥切标本进⾏细致的病理检查。
子宫颈癌MRI的FIGO分期北京大学第一医院医学影像科朱颖一、前言(一)子宫颈正常解剖及影像表现如PPT2图示为一矢状位T2图,子宫颈所有的结构都是子宫体相应结构的延续。
中间最亮的一条高信号是黏液层,外面一圈是由上皮结构构成,即黏膜层,表现为稍高信号,也是子宫内膜的延续。
箭头所指条状低信号的地方是纤维基质层,它包绕着宫颈,呈环状结构。
最外面一层相对疏松的纤维肌肉层呈均匀一致的中等信号,并且肌束向下越来越稀薄。
正常宫颈 T2 加权像( T2 weighted imaging,T2WI )表现为三层同心圆样结构:内带为高信号黏膜层,中间带又称连接带,为子宫结合带的延续,组织学上为子宫肌内层,为致密的宫颈纤维基质层,呈明显低信号;外带为相对疏松的纤维肌肉层,呈均匀一致的中等信号。
(二)子宫颈癌临床背景宫颈癌(cervical cancer )是全球妇女中仅次于乳腺癌的第二个最常见的恶性肿瘤。
在发展中国家其发病率仍居首位。
根据国际癌症研究中心 1996 年的统计,估计其 5 年患病为 156 万人,其中 120 万在发展中国家, 30 余万在发达国家。
Parkin 等人报告 2002 年全世界每年发生宫颈癌人数为 49.3 万(占妇女新发癌症病例的 15% ),死亡 27.4 万,83% 在发展中国家,我国每年新发病例约 13.15 万,约占病例总数的 1/3。
子宫颈癌的发病与性行为明显相关,被认为是一种性传播疾病。
初次性交过早、多个性伴侣等是主要的危险因素。
近年来由于人乳头瘤病毒( HPV )的感染增多,宫颈癌的发病率在某些地区有明显上升的趋势,且患者趋于年轻化。
病因尚未完全明了,相关因素:早婚、多产、过早性生活、性生活紊乱、高危性伴侣、经济状况不良、种族和地理环境等因素有关。
(三)宫颈癌组织发生宫颈癌好发鳞-柱交界区,宫颈上皮是鳞状上皮和柱状上皮共同组成的,交接部位在宫颈外口,呈鳞 - 柱交界区(如 PPT4 图中箭头所指部位)。
宫颈癌-FIGO分期宫颈癌分期及临床实践指南前言:国际妇产科协会(FIGO )和国际妇科肿瘤协会(IGCS)共同制定的《妇科恶性肿瘤分期及临床实践指南》以循征医学为依据,完整介绍了常见的妇科恶性肿瘤的分期,简明扼要介绍了各种妇科恶性肿瘤的处理原则和治疗方案,对广大妇科肿瘤医师的临床实践有很大的指导意义。
同时,FIGO和IGCS 依据临床诊治的进展对指南进行更新。
中山大学的林仲秋教授等人将目前FIGO和IGCS推广的指南第三版翻译成中文,现摘取宫颈癌分期及临床实践指南的主要内容刊登于中国医学论坛报,希望能更好地推广该指南,促进我国妇科肿瘤诊治水平并和国际相接轨。
最后,感谢FIGO、FIGO妇科肿瘤委员会、IGCS和FIGO妇科肿瘤委员会主席HYS Ngan (颜婉嫦)教授的支持。
曹泽毅中华医学会妇科肿瘤学分会主任委员宫颈癌分期临床一诊断分期宫颈癌的分期根据临床估计,因此必须对所有病人进行仔细的临床检查,最好由有经验的医生在麻醉下进行。
临床分期一定不能因为后来的发现而改变。
如果某一特定患者的分期存在疑问时,必须归于较早的分期。
可以进行以下检查:触诊、视诊、阴道镜、宫颈内膜诊刮、子宫镜、膀胱镜、直肠镜、静脉尿路造影以及肺和骨骼的X线检查。
可疑的膀胱或直肠受累应该通过活检和组织学证据证实。
宫颈锥切或部分切除也被认为是一项临床检查,经此确定的浸润癌也包括在报告中。
可选择的其他检查有:腹腔镜、超声、CT扫描、MRI及正电子发射断层扫描术(PET),这些检查对于确定治疗方案是有价值的,但这些检查一般不易做得,而且结果多变,因而这些检查结果不能作为改变临床分期的依据。
在CT扫描引导下对可疑淋巴结进行细针穿刺抽吸(FNA )有助于确定治疗计划。
术后病理分期经过手术治疗的病例,病理专家可以根据切除组织中的病理改变更精确地描述疾病范围。
这些结果不能改变临床分期,但可以以疾病的病理分期描述方式记录下来。
TNM的分期正适合此目的。
在极少数情况下,术前没有诊断为浸润性宫颈癌而仅做了子宫切除术,这些病例不能进行临床分期,也不能包含在治疗统计中,但可分开报告。
在首次诊断时就应确定临床分期并且不能再更改,既使复发也不例外。
只有严格按照临床分期的原则进行分期,才有可能比较临床资料和不同治疗方法的效果。
分期说明0期指不典型增生细胞累及上皮全层但无间质浸润I A1和I A2期的诊断基于取出组织的显微镜检查,最好是宫颈锥切活检,切除的组织必须包含全部病变。
无论原发病灶是表面上皮还是腺上皮,浸润的深度都不能超过上皮基底膜下5mm,水平扩散不超过7 mm。
静脉和淋巴管等脉管区域受累不能改变分期,但必须特别注明,因为会影响治疗决策。
较大的病变分为I B。
临床上常常无法估计宫颈癌是否扩展到宫体,因此,宫体的扩散将被忽略。
短而硬、但非结节状的宫旁组织向盆壁发展固定的病变分为H B。
因临床检查难以确定平滑、质硬的宫旁组织是癌浸润或者是炎症,因此,只有当宫旁组织为结节状固定于盆壁,或肿物本身扩展到盆壁时,才分为皿期。
按照其他检查分为I期或H期的病例,若由于癌的浸润导致输尿管狭窄而出现肾盂积水或肾无功能,均应分为皿期。
出现泡状水肿者,不宜分为W期。
通过直肠阴道检查发现膀胱壁有突起或凹陷,而且肿块固定,是膀胱粘膜下受累的征象。
若在膀胱冲洗液中发现恶性细胞,需做进一步的组织学检查确诊,才能考虑分为W A期。
表1宫颈癌分期FIGO具体描述TM 分期N分类原发肿瘤无法评估TX没有原发肿瘤的证据TO0期原位癌(浸润前癌)TisT1I期宫颈癌局限在子宫(扩展至宫体将被忽略)I A镜下浸润癌。
所有肉眼可见的病T1a 灶,包括表浅浸润,均为I BI间质浸润深度<3 mm,水平扩散T1 A i< 7 mm a iI间质浸润深度3〜5 mm,水平扩T1 A2散w 7 mm a a2I B肉眼可见癌灶局限于宫颈,或者镜T1b 下病灶>I A2I肉眼可见癌灶最大径线w 4 cm T1 B i b1I肉眼可见癌灶最大径线>4 cm T1 B2 b2u期肿瘤超越子宫,但未达骨盆壁或T2未达阴道下1/3n A无宫旁浸润T2an B 有宫旁浸润T2b川期肿瘤扩展到骨盆壁和/或累及阴道T3 下1/3和/或引起肾盂积水或肾无功能皿A 肿瘤累及阴道下1/3,没有扩展到T3a 骨盆壁皿B 肿瘤扩展到骨盆壁和/或引起肾盂T3b 积水或肾无功能IV A 肿瘤侵犯膀胱粘膜或直肠粘膜和/ T4或超出真骨盆bV B 远处转移M i注a.无论从腺上皮或者表面上皮起源的病变,从上皮的基底膜量起浸润深度不超过5mm。
肿瘤浸润深度的测量要从上皮一间质联接处最表层的乳突量起到浸润的最深处来确定。
无论是静脉或淋巴等脉管区域的浸润,均不影响分期。
注b.泡状水肿不能分为T4期。
宫颈癌治疗指南微小浸润癌只有在宫颈锥切活检边缘阴性,或子宫颈切除或全宫切除后才能作出宫颈癌I A i或I A2期的诊断。
如果是宫颈上皮瘤样病变(CIN )皿级宫颈锥切边缘阳性或浸润癌,需要再做一次宫颈锥切或者按I B i期处理。
在确定治疗前应该做阴道镜检查排除相关的阴道上皮内瘤变(VAIN )。
IA i期推荐经腹或经阴道全子宫切除术。
如果同时存在阴道上皮内瘤变,应该切除相应的阴道段。
如果病人有生育要求,可行宫颈锥切,术后 4 个月、10个月随访追踪宫颈细胞学抹片。
如果这两次宫颈细胞学抹片均阴性,以后每年进行一次宫颈抹片检查。
B级证据。
IA2期IA2期宫颈癌有潜在的淋巴结转移机率,治疗方案应该包括盆腔淋巴结切除术。
推荐的治疗是改良广泛子宫切除术(U型子宫切除术)加盆腔淋巴结切除术。
如果没有淋巴血管区域浸润,可以考虑行筋膜外子宫切除术和盆腔淋巴结切除术。
C级证据。
要求保留生育功能者,可选择:i大范围的宫颈锥切活检,加腹膜外或腹腔镜下淋巴结切除术。
ii广泛宫颈切除术,加腹膜外或腹腔镜下淋巴结切除术。
随访主要应用细胞学抹片检查(Pap smear)随访,术后4个月和10个月两次抹片均正常后,每年一次抹片检查。
浸润癌初始评估肉眼可见的病灶应该活检确诊。
初始评估包括临床检查(必要时在麻醉下进行),阴道镜检查排除阴道上皮内瘤变。
了解相关的临床症状,出现与膀胱和直肠有关的症状,可行膀胱镜或结肠镜评估膀胱或直肠情况。
X线胸片检查和肾脏评估(可包括肾脏B超,IVP,CT或MRI )是必须的。
CT和/或MRI和/或PET检查可以了解淋巴结和全身扩散情况。
I B i和H A期(肿瘤直径<4 cm)早期宫颈癌(I B l, n A<4 cm)采用手术或放疗的预后均良好。
A级证据。
治疗的选择取决于病人能够获得什么医疗资源、肿瘤学家的参与、病人的年龄和一般身体健康状态。
最好进行多学科会诊;应该向病人解释所有的治疗选择,包括它们的毒性和预期结果。
合用手术和放疗并发症将增加。
为了减少并发症的发生,初始治疗方案时应该避免合用广泛手术和放射治疗。
A级证据。
手术治疗I B i和n A期(肿瘤直径<4 cm)宫颈癌的标准手术治疗方法是改良广泛子宫切除术或广泛子宫切除术(Piver Rutledge分类n型或皿型子宫切除术)和盆腔淋巴结切除术。
年轻患者可以保留卵巢,如果术后需要放疗,应将卵巢悬吊于盆腔之外。
在特殊病例,可以行经阴道广泛子宫切除术和腹腔镜下盆腔淋巴结切除术。
C级证据。
放射治疗I B i和n A期(肿瘤直径<4 cm)宫颈癌的标准放射治疗方案是盆腔外照射加腔内近距离放疗,推荐剂量[包括盆腔外照射和低剂量比率(LDR )腔内近距离放疗]为:A点80〜85 Gy, B点50〜55 Gy。
盆腔外照射总量应该是45〜55 Gy,每次180〜200 cGy。
应用高剂量比率(HDR )的腔内近距离放疗,剂量应该按照相等的生物学剂量设置。
手术后辅助治疗根治术后有以下情况者复发的危险性增加:淋巴结阳性、宫旁阳性、手术切缘阳性。
这些病人术后采用同期放化疗(5FU +顺铂或单用顺铂)比单用放疗者,可以改善生存率。
A级证据。
复发的危险性增加也见于那些没有淋巴结受累,但肿瘤为巨块型、有脉管区域(CLS )受累和扩展到宫颈间质外1/3。
术后辅助性全盆腔外照射比单用手术治疗者可减少局部复发率并改善无瘤生存率(PFS),对腺癌或腺鳞癌尤有好处。
A级证据。
有两组报道应用小范围的盆腔放疗可以达到相似的肿瘤控制并且减少并发症;他们设计的放疗范围可以覆盖阴道穹隆和宫旁组织,上界位于S i-2,而不是L5—S i。
C级证据。
I B2和H A期(肿瘤直径>4 cm)初始治疗措施包括:1)放化疗。
2)广泛子宫切除术和双侧盆腔淋巴结切除术,术后通常需要加辅助放疗。
3)新辅助化疗(3个疗程的以铂类为基础的快速输注化疗),随后进行广泛子宫切除术和盆腔淋巴结切除术加或不加术后辅助放疗或放化疗。
同期放化疗最常用的治疗是盆腔外照射加腔内近距离放疗,并每周用铂类药物化疗1次。
放疗的推荐剂量是A点85〜90 Gy, B点55〜60 Gy。
在盆腔外照射期间每周应用顺铂40 mg/m2化疗。
髂总或主动脉旁淋巴结阳性者,应该考虑扩大放疗范围。
目前很少有同期化疗和扩大放疗范围的毒性资料。
A级证据。
手术加辅助放疗初始治疗选择广泛子宫切除术的好处是可以得到正确的手术分期,同时切除原发肿瘤,避免腔内近距离放疗。
手术也可以切除不容易通过放疗杀灭的肿大淋巴结因为肿瘤巨大,更可能需要辅助放疗。
广泛的脉管区域(CLS)受累和癌症浸润至宫颈间质外1/3是局部复发的高危因素。
淋巴结阴性的高危患者可以采用全盆腔放疗或小范围盆腔放疗。
髂总、主动脉旁淋巴结阳性的患者可以扩大放疗范围,加用或不用化疗。
C级证据。
新辅助化疗后广泛子宫切除术加盆腔淋巴结切除术随机试验数据提示在手术前采用以铂类为基础的新辅助化疗比初始放疗的效果好。
目前没有得到比较同期放化疗与手术前新辅助化疗的疗效差别的数据。
B级证据。
Buenos Aires的研究采用如下化疗方案:顺铂50 mg/m2IV 15分钟,第1天长春新碱 1 mg/m2IV 第1天博来霉素25 mg/m2连续静滴>6小时,第1-3天间隔10天,总3个疗程。
晚期宫颈癌(包括H B,川,IV A 期)初始治疗标准的初始治疗是放疗,包括盆腔外照射和腔内近距离放疗联合同期化疗。
A级证据。
IVA期病人癌症没有浸润到盆壁,特别是合并有膀胱阴道痿或直肠阴道痿者,初始治疗可选盆腔脏器清除术。
C级证据。
放疗剂量和技术放疗剂量和技术见表2。
放疗应该给予合适的能量以在第一和第二照射区产生均匀的剂量分布(土5%)。
如果可能,照射区肿瘤容量可根据临床检查和CT扫描的结果而定。
范围应该至少包括4个区域。
腔内近距离放疗可以给予高或低剂量比率。
标准的治疗方案是盆腔外照射加腔内近距离照射,同时应用以铂类为基础的化疗。