溶出度对比研究四种溶出介质的比较样本
- 格式:doc
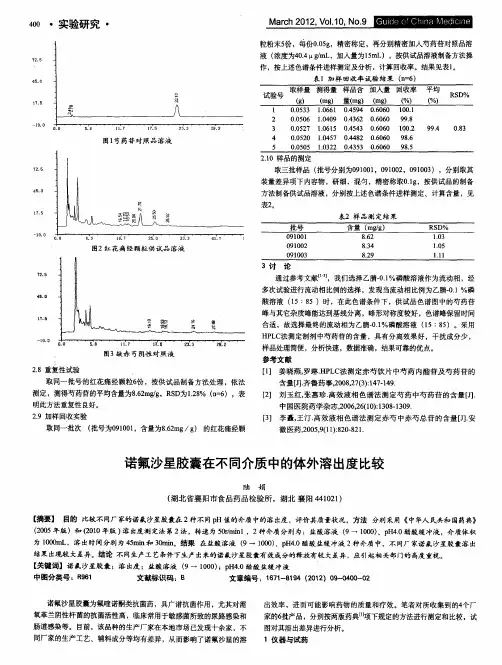
- 大小:30.50 KB
- 文档页数:3

头孢氨苄胶囊在不同溶出介质中的溶出度比较《中国药典》2005 版收载头孢氨苄胶囊溶出度, 采用转蓝法, 溶出介质为脱气水900 ml, 转速100 r/min, 溶出时间45 min 。
为了考察头孢氨苄胶囊在不同pH 环境中的溶出情况,用3 个厂家3 批样品分别以脱气水、盐酸溶液(9~1000)和磷酸盐缓冲液(pH 6 .8)为介质,检查溶出情况,比较累积溶出量。
1 实验部分1.1 仪器与试药D800-L 型智能药物溶出仪(天津大学无线电厂);UV2550 紫外分光光度计(日本岛津公司);AL-204 电子天平(瑞士Mettler 公司)。
头抱氨苄胶囊A B、C厂家三批;头孢氨苄对照品(中国药品生物制品检定所);磷酸盐缓冲液(pH6.8);盐酸溶液(9~1000);其余试剂均为分析纯。
1.2 标准曲线的制备精密称取头抱氨苄对照品于50 ml 的量瓶中, 分别用介质溶解后定容作贮备液。
精密量取各贮备液0.5、0.8、1.0、1.2、1.5 ml 于10 ml 量瓶中,用3 种介质定容,制成15. 283、24. 453、30. 566、36. 679、45. 849 卩g/ml 的系列溶液。
分别用各自的介质为空白,在262nm的波长处分别测定吸光度, 标准曲线方程分别为:?A水=3. 0X 10-3C+1. 28X 10-2 (r=0 . 999 9); ?A磷酸盐=3. 0X 10-3C+1. 25 X 10-2 (r=0 . 999 9); ?A盐酸=3. 0X 10-3C+1 . 46 X 10-2 (r=0 . 999 9)。
?在15. 283〜45. 849卩g/ml范围内,线性关系良好。
1.3 回收率实验精密称取3 个样品各5 份, 分别加入“1. 2”项下的贮备液5 ml, 分别用3 种溶出介质定容于250 ml 量瓶,用0. 8卩m微孔滤膜过滤,取滤过液按“ 1. 2”项下的方法测定, 平均回收率分别为99. 96%(RSD=.0 81%,n=5);100.03%(RSD=.1 08%,n=5);100. 21%(RSD=.1 13%,n=5)。

缬沙坦胶囊在多种溶出介质中溶出曲线的比较研究文章对缬沙坦胶囊溶出度测定方法进行验证,分别依照2010年版中国药典第二部缬沙坦胶囊”溶出度”检查项下的规定,考察市售品在不同溶出介质中的溶出度。
以pH6.8磷酸盐缓冲液、水、0.1mol/L盐酸溶液、pH4.5醋酸盐缓冲液、pH6.2磷酸盐缓冲液为溶出介质,转速为100转每分钟,参照溶出度测定法第一法,依法操作,测定市售品(诺华公司)在不同溶出介质中的溶出度,同时采用f2相似因子法考察相似性,以评价自制缬沙坦胶囊的质量。
标签:缬沙坦胶囊;溶出曲线;f2相似因子缬沙坦是一种口服有效的特异性血管紧张素Ⅱ受体拮抗剂,它选择性地作用于AT1受体亚型,阻断AngⅡ与AT1受体的结合(其特异性拮抗AT1受体的作用大于AT2受体约20000倍)。
本品不作用于血管紧张素转换酶(ACE)、肾素和其它受体,不抑制与血压和钠平衡有关的离子通道;由于本品对血管紧张素转换酶没有抑制作用,不影响体内缓激肽水平,因而导致咳嗽的副作用少于血管紧张素转换酶抑制剂(ACEI)。
缬沙坦是血管紧张素(Ang)Ⅱ受体拮抗剂类的新一代降压药,由瑞士诺华公司开发成功后,首先在德国上市。
这里以诺华公司生产的Diovan(规格为80mg)为参比制剂,对比研究我们企业自制的缬沙坦胶囊。
1 材料ZRS-8G型智能溶出仪(天津大学无线电厂);ZRS-8G智能溶出仪;PHS-3C 酸度计(上海雷磁仪器厂);Adventurer电子分析天平AR1140(上海奥豪斯国际贸易有限公司);缬沙坦胶囊(规格:80mg)批号20131001自制;Diovan(规格:80mg,批号X0862),缬沙坦对照品(中国药品生物制品检定所),试剂均为分析纯。
2 方法2.1 标准曲线的绘制分别精密移取1.0mg/ml的储备液1.2ml、2.5ml、5.0ml、10.0ml、20.0ml置于200ml 容量瓶中,溶出介质定容,得到浓度分别是6μg/ml、12.5μg/ml、25μg/ml、50μg/ml、100μg/ml的系列标准溶液,分别测定吸光度。

辛伐他汀片在4种溶出介质中溶出度的比较卢福强;周红梅【期刊名称】《黑龙江医药》【年(卷),期】2014(0)1【摘要】目的:检测辛伐他汀片在4种溶出介质中的不同时间的溶出度,绘制溶出曲线,确定溶出介质,建立溶出度检测方法。
方法:在不同的溶出介质中,分别在5、10、15、20、30、40分钟取样,测定溶出度,绘制出溶出曲线,比较在不同介质中的溶出结果。
结果:最终选择含0.5%十二烷基硫酸钠的0.01mol/L磷酸二氢钠缓冲液为溶出介质。
结论:辛伐他汀片在不同溶出介质中的溶出度与其自身理化性质有直接关系。
%Objective:Detecting Simvastatin Tablets dissolution of the different times in the four kinds of dissolution medium, draw-ing the dissolution curve, to determine the dissolution medium, the establishment of the detection method of the dissolution.Methods:Different dissolution media, 5,10,15,20,30,40 minute sampling measured dissolution dissolution curve plotted comparative dissolution re-sults in different media.Results:Eventually containing 0.5%sodium dodecylsulfate 0.01mol/L sodium dihydrogen phosphate buffer dis-solution medium. Conclusion:Dissolution of simvastatin tablets in different dissolution media have a direct relationship to its physico-chemical properties.【总页数】3页(P1100-1101,1102)【作者】卢福强;周红梅【作者单位】黑龙江天宏药业股份有限公司,哈尔滨市,150025;黑龙江天龙药业有限公司,哈尔滨市,150060【正文语种】中文【中图分类】R735.3+5【相关文献】1.枸橼酸他莫昔芬片在不同溶出介质中的溶出行为比较 [J], 查道仁;柏光俊;阚家义2.头孢氨苄胶囊在不同溶出介质中的溶出度比较 [J], 丁伟姣;金春花;王宝庆3.不同厂家利巴韦林片在不同溶出介质中溶出曲线比较 [J], 黄励坚; 李湘4.多潘立酮片在不同溶出介质中的溶出曲线比较 [J], 刘雪峰;王荣;妙苗;王荪璇;王嫦鹤5.盐酸乙胺丁醇片在4种溶出介质中溶出曲线的比较研究 [J], 张耀文;刘慧颖;王铁军;孙苓苓因版权原因,仅展示原文概要,查看原文内容请购买。



法莫替丁片在不同介质中的溶出曲线比较詹长娟;王翼;徐伟;王华;缪丽【期刊名称】《食品与药品》【年(卷),期】2016(018)003【摘要】目的比较4个不同厂家法莫替丁片的体外溶出情况,为质量控制提供参考.方法采用紫外分光光度法,参考2010年版《中华人民共和国药典》二部和日本《医疗用药品品质情报集》对溶出度实验的要求,分别以介质Ⅰ(pH 4.5磷酸盐缓冲液)、Ⅱ(水)、Ⅲ(pH 1.2盐酸溶液)、Ⅳ(pH 4.0醋酸盐缓冲液)、Ⅴ(pH 6.8磷酸盐缓冲液)900mL为溶出介质,测定法莫替丁片的溶出度.并采用相似性因子f2法与参比制剂(安斯泰来制药)进行溶出曲线的相似性比较.结果 B厂家生产的产品与参比制剂在介质Ⅱ、Ⅴ中溶出曲线相似,其余均不相似.结论国产4个厂家生产的产品与参比制剂溶出曲线存在差异,质量有待提高.【总页数】4页(P179-182)【作者】詹长娟;王翼;徐伟;王华;缪丽【作者单位】南京理工大学泰州科技学院化工学院,江苏泰州225300;南京理工大学泰州科技学院化工学院,江苏泰州225300;南京理工大学泰州科技学院化工学院,江苏泰州225300;南京理工大学泰州科技学院化工学院,江苏泰州225300;南京理工大学泰州科技学院化工学院,江苏泰州225300【正文语种】中文【中图分类】R943【相关文献】1.柳氮磺吡啶肠溶片在不同溶出介质中的溶出曲线比较研究 [J], 林楠;范松华;金慧;施海斌2.不同厂家非那雄胺片在4种溶出介质中的溶出曲线比较研究 [J], 曾俊;孟霞;李倩雯;谢细妹;徐雄波3.不同厂家氯硝西泮片在4种溶出介质中溶出曲线的比较 [J], 范菲;李静静;刘鹏鸣;单敏4.不同厂家利巴韦林片在不同溶出介质中溶出曲线比较 [J], 黄励坚; 李湘5.多潘立酮片在不同溶出介质中的溶出曲线比较 [J], 刘雪峰;王荣;妙苗;王荪璇;王嫦鹤因版权原因,仅展示原文概要,查看原文内容请购买。


001【求助】溶出度对比研究-四种溶出介质的比较作者: wangjianglin332(站内联系TA)发布: 2010-10-21Sample Text溶出度作为工艺筛选和质量研究的重要评价指标,按目前的审评要求必须做详尽的研究,现今一上市品种的仿制,溶出度研究碰到比较棘手的问题,望园中的前辈不吝赐教。
1.主药易溶于水,溶解度为0.1g/ml,一剂量(240mg)的主药在250ml四种溶出介质(酸(0.1mol/L盐酸溶液)、pH=4.5(醋酸-醋酸钠缓冲液)、pH=6.8(磷酸盐缓冲液)、水)能完全溶解。
胶囊剂崩解时限为3分钟,胶囊崩解药物即可溶出,实验结果也表明在水中,10分钟药物的溶出量即可达到90%以上,此种情况还是否需要通过溶出曲线的相似性来判定自制样品和市售品溶出行为的一致性?园中有帖子谈到用ICH指导原则的三步法进行考察,那么最后一步证明崩解和溶出具有相关性如何考察?2.溶出度的比较研究通常需考察自制品和市售品在四种溶出介质(酸(0.1mol/L盐酸溶液)、pH=4.5(醋酸-醋酸钠缓冲液)、pH=6.8(磷酸盐缓冲液)、水)中的溶出行为,溶出量的测定方法也一般采用UV法进行测定。
本品取样后,需进行衍生化反应后才有紫外吸收(通常情况紫外最大吸收波长为195nm,衍生化后为525nm),但在实验研究过程中我们发现,介质酸中样品1小时后吸光值在0.1至0.2的范围,不符合紫外吸收值的误差范围;介质pH=4.5(醋酸-醋酸钠缓冲液)中1小时后样品吸光值为0,推断无衍生化反应发生;介质pH=6.8(磷酸盐缓冲液)中1小时后样品吸光值也在0.1至0.2的范围内,不符合紫外吸收值的误差范围。
综合推断,除水以外,另外三种介质对衍生化反应均有不同程度影响,溶出量无法准确测定,此种情况下能否以水一种介质进行溶出度的对比研究?举报删除此信息caoyuan521(站内联系TA)问题一:在国内一般有溶出检测项目的制剂都不再检测崩解项目了。


1 1 病例本组 64例均为本科住院中晚期大肠癌患者 , 其中男 42例 , 女 22例 ; 年龄 36~78岁 , 中位年龄 56岁 ; 结肠癌 20例 , 直肠癌44例 , 均经病理组织学或细胞学确诊。
病理类型 :低分化鳞癌 12例 , 中分化鳞癌10例 , 低分化腺癌 4例 , 中分化腺癌 21例 , 黏液腺癌 15例 , 印戒细胞癌 2例 ; 转移部位肝脏 6例 , 腹膜或肠系膜转移 32例 , 肺脏 4例 , 局部肿瘤浸润 6例 , 淋巴结转移 35例 , 均至少有一处可测量的肿瘤病灶 , K a rno fsky 评分 60以上。
能者无急性感染和急性肠梗阻表现 ; 预计生存时间 >3个月以上 , 心、肝肾功能正常 , 无化疗禁忌证。
1 2 方法全部病例冶疗前均做全面检查 , 包抱体检和血常规 , 肝肾功 , 心电图 , 胸部 X 线或 CT, 放免 CEA 检测 , 化疗期间每周检查血常规 1次 , 肝肾功能 1次 , 将 64例患者按入院顺序随机分为两组 , 对照组 33例 (单化疗试验组 32例 (化疗联合岩舒 , 两组患者在年龄、性别、病理类型、分期及 KPS 评分方面无显著差异。
试验组 :奥沙利铂 130m g /m2+5%葡萄糖注射液 250m l 静脉滴注 , 第 1天 ; 亚叶酸钙 (CF 100m g +5%葡萄糖注射液 250m l 静脉滴注 , 第 1~5天 ; 氟 0 5g(5 FU +5%葡萄糖注射液 250m l 静脉滴注 , 第 1~5天。
化疗当天给予岩舒注射液(山西振东制药有限公司生产 40m l+5%葡萄糖注射液 250m l 静脉滴注 , 第 1~20天 , 常规给予 5 HT 3受体抑制剂止吐 , 21d 为 1周期。
2个周期进行疗效评价 , 对照组化疗方法同治疗组。
1 3 评价标准疗效评价按 WHO 实体瘤进期瘤近期疗效标准 [3], 为分完全缓解 (CR 、部分缓解 (PR 、无变化 (NC 和进展 (PD 。
四种药物溶出度测定方法的比较研究溶出度(dissolution rate)系指活性药物从片剂、胶囊剂或颗粒剂等制剂在规定条件下溶出的速度和程度。
溶出度测定是区分固体制剂体外溶出速率的一种有效的手段。
2010年版《中国药典》二部收载的溶出度测定法有3种,包括第一法(篮法)、第二法(桨法)和第三法(小杯法)。
作为一些小剂量固体制剂溶出度测定法的第三法(小杯法)的选择,主要源于紫外-可见分光光度法本身检测灵敏度的限制,人为将第二法(桨法)的溶出介质体积由900mL(或1000mL)缩减为100~250mL,同时相应缩小搅拌桨(浆叶直径由74mm→45mm)而实现溶出度测定。
方法转换本身缺乏严谨的科学依据,也属无奈之举。
随着现代分析技术的发展,特别是高效液相色谱仪的普及,采用第二法(桨法)替代第三法(小杯法)不仅必要,而且可行。
光纤药物溶出度过程分析仪(FODT, Fiber-Optic Dissolutiom Test System)集溶出度试验与检测于一体,通过光纤将光源信号直接导入溶出杯中,根据药物的光谱学特性选择合适的探头,药物溶出过程中浓度的变化引起光学信号的实时改变,经软件系统处理后实现对药物溶出度的测定。
具有实时、在线、快速、准确和过程监测等特点,是药物溶出度测定法的发展方向和目标。
本课题采用高效液相色谱法替代紫外-可见分光光度法,对盐酸赛庚啶片、富马酸酮替芬片和马来酸氯苯那敏片的溶出度测定方法进行研究,探索了第三法(小杯法)转换为第二法(桨法)的可行性,客观评价3种市售药品的内在质量。
采用光纤药物溶出度过程分析仪,通过改变光程和检测波长等方法研究替硝唑片的溶出度实时、在线测定方法,并与药典方法的结果进行比较。
盐酸赛庚啶片溶出度测定采用第二法(桨法),以900mL0.1mol·L-1盐酸溶液为溶出介质,50r·min-1,限度为标示量的80%(30min);色谱条件:ZORBAX SB-C18(4.6mm×150mm,0.5μm),流动相为甲醇-0.1%磷酸溶液(每100mL加0.1g十二烷基磺酸钠)(75:25),流速1.0mL·min-1,柱温30℃,检测波长230nm。
四种介质中国产和进口阿托伐他汀钙片溶出度对比研究
郭润芳;李建伟
【期刊名称】《山西职工医学院学报》
【年(卷),期】2013(023)001
【摘要】目的:比较国产与进口阿托伐他汀钙片制剂在不同介质中的溶出行为.方法:测定进口和国产阿托伐他汀钙片在4种不同介质(水、pH 1.2、pH 4.0、pH 6.8缓冲液)中的累积溶出度.采用桨法(转速为50 转/min)、紫外分光光度法测定(检测波长240 nm).结果:在pH1.2介质中,进口片剂在不同时间点的累积溶出度高于国产片剂;在水、pH 4.0和pH 6.8介质中,国产片剂与进口片剂溶出行为和累积溶出度基本一致.结论:国产中与进口片剂在pH1.2介质中溶出度存在差异,在其他介质中溶出行为一致.
【总页数】3页(P1-3)
【作者】郭润芳;李建伟
【作者单位】长治市郊区人口和计划生育服务中心,山西,长治,046000;长治医学院,山西,长治,046000
【正文语种】中文
【中图分类】R917
【相关文献】
1.五种不同介质中瑞格列奈片溶出度对比研究 [J], 杨雪;李建伟;闫晓霞;宁俊波
2.国产与进口渗透泵控释片在不同介质中释放度比较 [J], 杨硕;王立
3.国产与进口阿托伐他汀钙片的含量和溶出度测定 [J], 陈旭;高燕灵;郑彩云
4.国产乐普药物涂层支架与进口裸支架在急性心肌梗死介入治疗中的对比研究 [J], 汪雨静
5.进口和国产氨氯地平片在4种介质中的溶出度研究 [J], 张梦琪;顾洪安;陆川;刘罡一;余琛
因版权原因,仅展示原文概要,查看原文内容请购买。
不同介质中头孢地尼干混悬剂溶出曲线相似性比较的研究赵洪霞;姜起栋;梁丽娟;芮庆云【摘要】目的:评价自制头孢地尼干混悬剂与市售原研品头孢地尼胶囊体外溶出行为的相似性,同时为难溶性药物制剂质量判断提供参考.方法:分别考查自制试验制剂头孢地尼干混悬和参比制剂头孢地尼胶囊在纯水、pH 1.2人工胃液、pH 4.0与pH 6.8磷酸盐缓冲液4种溶出介质中的体外溶出行为,以紫外-可见分光光度法进行测定,并采用f2相似因子法评价受试制剂和市售参比制剂溶出曲线的相似性.结果:在4种介质中,自制样品与参比制剂相似因子f2均大于50.结论:在这4种介质中,自制试验制剂与参比制剂溶出行为相似,说明受试制剂的处方工艺合理.【期刊名称】《天津药学》【年(卷),期】2014(026)004【总页数】3页(P16-18)【关键词】头孢地尼;干混悬剂;溶出曲线;相似因子【作者】赵洪霞;姜起栋;梁丽娟;芮庆云【作者单位】天津医药集团津康制药有限公司,天津300270;天津医药集团津康制药有限公司,天津300270;天津医药集团津康制药有限公司,天津300270;天津医药集团津康制药有限公司,天津300270【正文语种】中文【中图分类】R927.11头孢地尼为广谱第三代口服头孢类抗菌素,由日本藤泽药品工业株式会社1991年首先在日本上市,原研剂型是胶囊剂,商品为Cefzon。
此后1997年12月获美国FDA 批准上市,1999年在韩国上市,我国首次注册时间为 1995年,进口产品商品名为“全泽复”,为难溶性药物。
溶出度试验是评价难溶性药物制剂的生物利用度和生物等效性的重要指标,也是新药和仿制药的科学评价手段。
在多种pH溶出介质中溶出曲线的测定已成为评价口服固体制剂内在质量的常用手段,该试验可用于评估自制制剂与原研制剂“全泽复”内在质量差异。
基于此,参照日本药品品质再评价资料集(橙皮书)和《中国药典》2010年版[1]的方法进行了4种溶出介质的溶出曲线的考查。
001【求助】溶出度对比研究-四种溶出介质的比较
作者: wangjianglin332(站内联系TA)发布: -10-21 Sample Text
溶出度作为工艺筛选和质量研究的重要评价指标, 按当前的审评要求必须做详尽的研究, 现今一上市品种的仿制, 溶出度研究碰到比较棘手的问题, 望园中的前辈不吝赐教。
1.主药易溶于水, 溶解度为0.1g/ml, 一剂量( 240mg) 的主药在250ml四种溶出介质( 酸(0.1mol/L盐酸溶液)、 pH=4.5(醋酸-醋酸钠缓冲液)、 pH=6.8(磷酸盐缓冲液)、水) 能完全溶解。
胶囊剂崩解时限为3分钟, 胶囊崩解药物即可溶出, 实验结果也表明在水中, 10分钟药物的溶出量即可达到90%以上, 此种情况还是否需要经过溶出曲线的相似性来判定自制样品和市售品溶出行为的一致性? 园中有帖子谈到用ICH指导原则的三步法进行考察, 那么最后一步证明崩解和溶出具有相关性如何考察?
2.溶出度的比较研究一般需考察自制品和市售品在四种溶出介质( 酸(0.1mol/L 盐酸溶液)、 pH=4.5(醋酸-醋酸钠缓冲液)、 pH=6.8(磷酸盐缓冲液)、水) 中的溶出行为, 溶出量的测定方法也一般采用UV法进行测定。
本品取样后, 需进行衍生化反应后才有紫外吸收(一般情况紫外最大吸收波长为195nm, 衍生化后为525nm), 但在实验研究过程中我们发现, 介质酸中样品1小时后吸光值在0. 1至0.2的范围, 不符合紫外吸收值的误差范围; 介质pH=4.5(醋酸-醋酸钠缓冲液)中1小时后样品吸光值为0, 推断无衍生化反应发生; 介质pH=6.8(磷酸盐缓冲液)中1小时后样品吸光值也在0.1至0.2的范围内, 不符合紫外吸收值的误差范围。
综合推断, 除水以外, 另外三种介质对衍生化反应均有不同程度影响, 溶出量无法准确测定, 此种情况下能否以水一种介质进行溶出度的对比研究?
举报删除此信息caoyuan521(站内联系TA)
问题一: 在国内一般有溶出检测项目的制剂都不再检测崩解项目了。
我个人认为在质量标注中指定了溶出的指标就不要研究与崩解的关系了。
问题二: 只用水一种介质来代表是肯定不能够的。
建议楼主先找出影响紫外吸收的原因, 一般衍生化反应都要加入衍生化试剂, 是否是衍生化试剂和你使用的酸性介质有反应或者是其它原因。
建议把原因弄明白, 否则审评专家会怀疑你的产品在酸性条件下溶出效果差。
如果是你的酸性介质影响衍生化反应, 是否考虑在衍生化反应前先将溶液调至中性。
zh6656(站内联系TA)
1、崩解和溶出没有必然的联系, 二者的关系请好好再看看药剂学的相关书籍;
2、紫外既然有困难, 那就采用HPLC法不就解决了。
现在溶出度, 含量的测定CDE对HPLC法还是很肯定的。
UV法正在面临被淘汰的命运。
做新药开发最好尽量不要考虑繁琐, 当产品能不能顺利的获得批准就知道前期的工作投入非常值得。
liu-shuyu(站内联系TA)
:secret::like:
kkbyb(站内联系TA)
既然已经有了市售制剂,能够经过它的方法与其进行比较.溶出溶酶不是需要大规模比较,选择满足溶出要求的一种溶酶就能够
lilysino(站内联系TA)
溶出介质要比较几种常见的不同的, 且要做每种的方法学
小关(站内联系TA)
在酸里都衍生不出来, 那么你的样品人吃了还有效果吗?
double_fish(站内联系TA)
1.溶出很快的话, 能够根据药物的BCS分类进行比较啊, 我推测一下, 这个药物应该是高溶药物, 国内没有这方面的指导原则, 能够参考FDA溶出度指导原则, 高溶药物15min溶出度达到85%单点比较就能够了
2.药物的衍生化会不会受到pH的影响? 不同介质最大吸收波长会不会改变? 如果找不到紫外的问题, 能够进行HPLC测定啊, 你做的应该是抗生素吧
yhy786011(站内联系TA)。