No.4 —— 溶出介质的选用与配制
- 格式:pdf
- 大小:408.03 KB
- 文档页数:6

溶出度总结一、溶出度方法得确立1、溶出方法得选择(1)篮法(B)/浆法(P),不提首选浆法或蓝法非崩解型药物(B)崩解型药物制剂中含有难以溶解、扩散得成分(P)主药或辅料为一定胶性物质(P)悬浮得制剂(B),如辅料易堵塞网孔(P,使用沉降篮)(2)小杯法:≥500ml浓度过低,较灵敏得方法仍难以进行定量测定(不能使用沉降篮,测定不能再稀释测定)。
2、溶出介质得选择(1)水:不提以水为主(pH 值无法控制,在试验过程中易发生改变,适合非pH 依赖释药)(2)人工胃液(0、01~0、1mol/L盐酸溶液, 必要时可加胃蛋白酶)(3)人工肠液(必要时可加胰蛋白酶)(4)其她缓冲液(pH值一般不超过7、6)三羟甲基氨基甲烷(Tris):缓冲范围pH7、0~9、5,低离子强度(二氟尼柳胶囊)(5)其她: 低浓度表面活性剂; 醇溶液(一般<5%)人体生理pH值在胃内为1~3、5,小肠内约为7,结肠内约为7、5(6)表面活性剂----尽量避免使用,种类与浓度需通过多个试验来验证。
•FDA 溶出度指导原则:对于难溶性药物不提倡使用有机溶剂,推荐SDS,但必须证明表面活性剂得选择与用量得合理性。
即应考察表面活性剂对药物得增溶量,以确定最少且最佳得使用浓度。
采用阳离子表面活性剂/非离子表面活性剂。
十二烷基硫酸钠(Sodium laurylsulfate SLS或SDS) —纯度;pH≮2、5聚山梨酯(吐温)20-80 (Tween20-80 ) —茴三硫片/吉非替尼片/盐酸雷洛昔芬片等溴化十六烷基三甲胺—粘度大月桂基二甲基氧化铵—替代SDS 用于胶囊剂(可以与酶配伍)3、溶出介质体积得选择使药物符合漏槽条件小规格品种一般不提倡将2粒/片投入1个溶出杯中来满足测定得灵敏度需要。
常用:大杯法:500 ~1000ml ,900ml为最普遍小杯法:100~250ml。
漏槽条件:即所用介质得体积应达到被测物质在37℃时在此介质中达到饱与溶液浓度得体积得3~10倍。

上海市药品检验所谢沐风撰写【No.4 ——溶出介质的选用与配制】—— 上海市药品检验所 谢沐风 撰写1. 溶出介质的选用 建议采用多条溶出曲线对产品的内在品质进行评价。
选取原则建议如下: 【普通制剂】 (1)酸性药物制剂 pH 值分别为 1.0 或 1.2、5.5~6.5、6.8~7.5 和水; pH 值分别为 1.0 或 1.2、3.0~5.0、6.8 和水;(2)中性或碱性药物/包衣制剂 (3)难溶性药物制剂 (4)肠溶制剂 【调释制剂】pH 值分别为 1.0 或 1.2、4.0~4.5、6.8 和水;pH 值分别为 1.0 或 1.2、6.0、6.8 和水;pH 值分别为 1.0 或 1.2、3.0~5.0、6.8~7.5 和水。
2. 其他事项 (1) 以上含有 pH 值范围的,可分别按 0.5 或 1.0 间隔测试,如差异较大,应分别予以关注; 如无明显差异,酌情选择即可。
pH 值 1.0 或 1.2,系因各国要求不同。
(2) 在了解了该药物 pKa 值之后,如 pKa±1.0 值未能涵盖于以上各 pH 值中,建议测定 pKa±1.0 值溶出曲线,以更好地把握该药物的溶出特性。
(3) 如能测定更多 pH 值曲线,自然可得到更多关于该制剂内在品质信息;当然工作量亦会 增加。
(4) 无论何种制剂都不建议采用 pH8.0 以上的介质进行表达。
如确有必要,应提供充足的理 由。
(5) 某些品种还可根据临床使用情况, 考虑在“含有胃蛋白酶的模拟胃液”和“含有胰酶的模拟 肠液”中的体外溶出情况。
含有胃蛋白酶的模拟胃液,英文全称为 Simulated Gastric Fluid,简写为 SGF。
有时 亦可附有下标“sp” ,缩写为 SGF[sp]。
其配制方法—— 【中国药典】 取稀盐酸 16.4ml(相当于盐酸 3.84ml) ,加水约 800ml 与胃蛋白酶 10g,上海市药品检验所 谢沐风 撰写1上海市药品检验所谢沐风撰写摇匀后,加水稀释成 1000ml,即得。


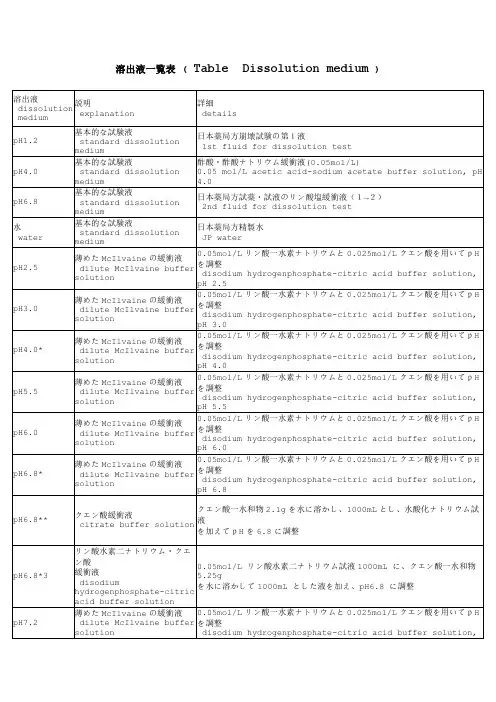
1.1 溶出介质的配制2.2.1 欧洲药典配制法(1) pH值1.0~2.2 盐酸溶液pH值1.0:精密量取盐酸溶液9.0ml,加水稀释至1000ml,摇匀,即得。
其他pH值溶液:量取一定体积的0.2mol/L盐酸液(量取盐酸18.0ml,加水稀释至1000ml,摇匀,即得),加水稀释至200ml,摇匀,即得。
pH值 1.2 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0 2.1 2.20.2mol/L盐酸液(ml) 85.0 67.2 53.2 41.4 32.4 26.0 20.4 16.2 13.0 10.2 7.8 (2) pH值3.8~5.8 醋酸盐缓冲液2mol/L醋酸溶液:取120.0g冰醋酸(经查,冰醋酸密度为1.049g/ml,故体积约为114ml),加水稀释至1000ml,摇匀,即得。
取下表中规定物质各量,加水溶解并稀释至1000ml,摇匀,即得。
pH值 3.8 4.1 4.3 4.5 4.7 4.9 5.1 5.2 5.3 5.4 5.5 5.8 三水醋酸钠(g) 0.67 1.5 1.99 2.99 3.59 4.34 5.08 5.23 5.61 5.76 5.98 6.23 2mol/L醋酸液(ml) 22.6 19.5 17.7 14.0 11.8 9.1 6.3 5.8 4.4 3.8 3.0 2.1 (3) pH值4.5~8.0 磷酸盐缓冲液取6.80g磷酸二氢钾,加一定体积0.2mol/L氢氧化钠液(取8.0g氢氧化钠,加水溶解并稀释至1000ml,即得)和适量水溶解后,再加水稀释至1000ml,摇匀,即得。
pH值 4.5 5.5 5.8 6.0 6.2 6.4 6.60.2mol/L氢氧化钠液(ml)0 9.0 18.0 28.0 40.5 58.0 82.0pH值 6.8 7.0 7.2 7.4 7.6 7.8 8.00.2mol/L氢氧化钠液(ml)112.0 145.5 173.5 195.5 212.0 222.5 230.52.2.2 美国药典配制法(1) pH值1.0~2.2 盐酸/氯化钾溶液同欧洲药典配制法,但其中要溶解入0.75g氯化钾。

美国药典溶出介质缓冲液的配制
美国药典配制法
1、在标准溶液配制标准指导下配制:0.2mol/L 盐酸溶液;0.2mol/L 氢氧化钠溶液
2、0.2mol/L邻苯二甲酸氢钾溶液:在水中溶解40.85g邻苯二甲酸氢钾,稀释制1000ml
3 、0.2mol/L磷酸二氢钾溶液:在水中溶解27.22g磷酸二氢钾,稀释制1000ml
4 、0.2mol/L硼酸氯化钾溶液:在水中溶解12.37g硼酸和14.91g氯化钾,稀释至1000ml
5、0.2mol/L氯化钾溶液:在水中溶解14.91g氯化钾,稀释至1000ml
6 、2N(当量浓度)的乙酸:在标准溶液配制标准指导下配制
标准缓冲液
盐酸缓冲液:将50ml氯化钾溶液置于200ml容量瓶中,加入一定量的盐酸溶液,用水定容至刻度。
酸性邻苯二甲酸缓冲液:将50ml邻苯二甲酸氢钾溶液置于200ml容量瓶中,加入一定量的盐酸溶液,用水定容至刻度。
中性邻苯二甲酸缓冲液:将50ml邻苯二甲酸氢钾溶液置于200ml容量瓶中,加入一定量的氢氧化钠溶液,用水定容至刻度。
磷酸二氢钾缓冲液:将50ml磷酸二氢钾溶液置于200ml容量瓶中,加入一定量的氢氧化钠溶液,用水定容至刻度。
碱性硼酸缓冲液:将50ml硼酸氯化钾溶液置于200ml容量瓶中,加入一定量的氢氧化钠溶液,用水定容至刻度。
醋酸缓冲液:将规定量的三水乙酸纳置于1000ml容量瓶中,加入规定量的乙酸溶液,用水定容至刻度,混匀。


附件1普通口服固体制剂溶出度试验技术指导原则一、前言本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。
本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。
附录对溶出度试验的方法学、仪器和操作条件进行了概述。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。
由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用:1.评价药品批间质量的一致性;2.指导新制剂的研发;3.在药品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。
对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。
对于仿制药申请,应在溶出曲线研究的基础上制定溶出度标准。
无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。
三、生物药剂学分类系统根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995):1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原则可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性(IVIVC)。

附录溶出度试验条件一、仪器篮法和桨法是目前最常用的溶出度测定方法,具有装置简单、耐用及标准化的特点,适用于大部分口服固体制剂。
中国药典收载的小杯法可视为桨法,适用于低剂量规格固体制剂的溶出试验。
通常应选用中国药典收载的方法,如篮法和桨法,必要时可采用往复筒法或流通池法进行体外溶出度试验。
对于某些药品或剂型,必须采用专门的溶出装置时,应进行详细的论证,充分评价其必要性和可行性。
首先应考虑对法定方法进行适当的改装,确定是否能满足质量控制的要求。
随着对生命科学及药剂学的深入研究,可能需要对溶出度方法及试验条件进行改进,以保证获得更好的体内外相关性。
二、溶出介质(一)溶出介质的选择溶出度试验应尽可能在生理条件下进行,这样可以从药品体内行为的角度,更好地理解体外溶出数据。
但常规的溶出度试验条件不需要与胃肠环境严格一致,应根据药物的理化性质和口服给药后可能的暴露条件确定适当的介质。
溶出介质的体积一般为500、900或1000 mL,溶出介质的体积最好能满足漏槽条件,一般应采用pH值1.2∼6.8的水性介质。
可采用不含酶的pH 1.2、6.8的溶出介质作为人工胃液和人工肠液。
特殊情况下,可采用高pH的溶出介质,但一般不应超过pH 8.0。
有研究表明,胶囊制剂在贮存过程中,由于明胶的交联作用可能会形成膜壳,因此可能需要在介质中加入胃蛋白酶或胰酶,以促使药物的溶出。
但应根据具体情况考虑是否在人工胃液或人工肠液中加入酶,并充分证明其合理性。
另外,尽量不采用水作为溶出介质,因为其pH值和表面张力可能随水的来源不同而不同,且在试验过程中也可能由于药物、辅料的影响而有所改变。
对于不溶于水或难溶于水的药物,可考虑在溶出介质中加入十二烷基硫酸钠或其他适当的表面活性剂,但需充分论证加入的必要性和加入量的合理性。
另外,由于表面活性剂的质量可能存在明显差异,应注意不同质量的表面活性剂对试验结果带来的显著影响。
使用标准化的或高纯度的表面活性剂可避免上述影响。

溶出指导原则范文以下是溶出指导原则的几个重要方面:1.溶出介质的选择:溶出介质是影响药物溶出速率的主要因素之一、选择适合的溶出介质是十分重要的,通常需要考虑药物的理化性质、制剂特性、目标给药部位等方面的因素。
常用的溶出介质包括生理盐水、pH 缓冲液等。
2.溶出速度的确定:药物溶出速度直接影响其生物利用度和疗效。
因此,确定合适的溶出速度是非常重要的。
一般来说,溶出速度应能保证药物在特定时间内达到可治疗剂量的释放。
3.溶出试验条件的选择:溶出试验条件包括温度、转速、采样时间等因素。
这些条件需根据药物的特性和制剂的具体要求来确定。
温度和转速的选择需考虑药物和制剂的稳定性、药物溶出机制等因素。
4.校准方法和设备:溶出试验的准确性与可重复性对于药物研发和制造至关重要。
因此,在进行溶出试验前,需要校准仪器并验证试验方法的准确性和可重复性。
5.溶出曲线的分析与解释:药物的溶出曲线可提供关于药物溶出动力学和特性的重要信息。
通过对溶出曲线的分析和解释,可以确定药物的溶出速率、溶出量以及溶出的主要机制。
6.溶出规范的制定与更新:溶出测试是一个深入细致的过程,需要根据具体的药物和制剂情况来制定相应的规范。
随着科学技术的不断进步,需要定期更新溶出规范,以确保测试结果的准确性和可靠性。
此外,溶出测试的结果还需要与实际使用效果进行比对和验证。
总结起来,溶出指导原则是确保药物溶出性能的一致性和可预测性的重要步骤。
通过选择合适的溶出介质、确定适当的溶出速率、选择合适的试验条件、校准设备和制定规范,可以获得准确、可重复的溶出测试结果,并提供有关药物溶出动力学和特性的重要信息,为药物研发和生产提供指导。

溶出度方法的选择及验证优秀文档溶出度(solubility)是指单位时间内物质在给定溶液中溶解的量。
溶出度方法的选择及验证对于药物研发、药物质量控制和相关领域的研究具有重要意义。
本文将介绍溶出度方法的选择及验证,并推荐一些相关的优秀文档。
一、溶出度方法的选择在选择溶出度方法时,需要考虑以下几个因素:1.溶出介质的选择:根据待测物质的特性和溶解度特点,选择合适的溶出介质。
一般来说,溶出介质应与产品的使用环境接近,以确保得到符合实际应用的溶出数据。
2. 溶出方法的选择:常见的溶出方法包括瓶法(basket method)、袋法(paddle method)和流动池法(flow-through cell method)。
不同的方法适用于不同的药物剂型和需要解决的问题。
比如,瓶法适用于固体制剂的溶出,袋法适用于片剂和软胶囊的溶出,流动池法适用于外用制剂或控释制剂的溶出。
3.实验条件的选择:实验条件的选择包括搅拌速度、温度、样品量等。
这些条件会影响到溶出度结果的准确性和可重复性,需要根据具体情况进行优化。
二、溶出度方法的验证为了保证溶出度方法的准确性和可靠性,需要进行验证实验。
常见的验证参数包括溶出度曲线、溶出度度曲线相关度、线性范围、准确度、精密度和选择性等。
1.溶出度曲线:绘制药物浓度与时间的曲线,观察其形状和趋势,确保曲线的合理性和稳定性。
2.相关度:通过计算相关系数来评估溶出度曲线与目标曲线的拟合程度。
一般要求相关系数大于0.993.线性范围:验证溶出度方法的线性范围,通常是通过在不同浓度范围内制备系列样品进行实验,并分析结果。
4.准确度和精密度:通过重复测定同一溶出度样品来评估方法的准确度和精密度。
一般要求准确度小于5%,相对标准偏差小于2%。
5.选择性:通过与其他可能存在的干扰物质进行交叉测定,验证方法的选择性。
三、优秀文档推荐1. USP Pharmacopeial Forum (PF):美国药典对于溶出度方法的选择和验证有详细的规定和指导,可以在PF中找到相关章节。
xxxxxxxx有限公司GMP文件1 范围:本标准规定了溶出度测定的方法和操作要求,适用于本公司检品采用溶出度测定的检查。
2 引用标准:《中华人民共和国药典》2015年版四部通则09313 试剂:盐酸4仪器与用具:溶出仪、量杯(1000ml)、移液管、量瓶5 标准内容:溶出度系指活性药物从片剂、胶囊剂或颗粒剂等普通制剂在规定条件下溶出的速率和程度。
5.1第一法(篮法)5.1.1 仪器装置(1)转篮分篮体与篮轴两部分,均为不锈钢或其他惰性材料制成。
篮体由方孔筛网(丝径为0.28mm±0.03mm,网孔为0.40mm±0.04mm)制成,呈圆柱形,转篮内径为20.2mm±1.0mm,上下两端都有封边。
篮轴的直径为9.75mm±0.35mm,轴的末端连一圆盘,作为转篮的盖;盖上有一通气孔(孔径为2.0mm±0.5mm);盖边系两层,上层直径与转篮外径相同,下层直径与转篮内径相同;盖上的三个弹簧片与中心呈120o角。
(2)溶出杯一般由由硬质玻璃或其他隋性材料制成的底部为半球形的1000ml杯状容器,内径为102mm±4mm(圆柱部分内径最大值和内径最小值之差不得大于0.5mm),高为185 mm±25mm;溶出杯配有适宜的盖子,盖上有适当的孔,中心孔为篮轴的位置,其他孔供取样或测量温度用。
溶出杯置恒温水浴或其他适当的加热装置中。
(3)篮轴与电动机相连,由速度调节装置控制电动机的转速,使篮轴的转速在各品种项下规定转速的±4%范围之内。
运转时整套装置应保持平稳,均不能产生明显的晃动或振动(包括装置所处的环境)。
转篮旋转时,篮轴与溶出杯的垂直轴在任一点的偏离均不得大于2mm,转篮下缘的摆动幅度不得偏离轴心1.0mm。
(4)仪器一般配有6套以上测定装置。
5.2第二法(桨法)除将转篮换成搅拌桨外,其他装置和要求与第一法相同。
搅拌桨的下端及桨叶部分可涂适当的惰性材料(如聚四氟乙烯),其形状尺寸如图所示。
附件1普通口服固体制剂溶出度试验技术指导原则一、前言本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。
本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。
附录对溶出度试验的方法学、仪器和操作条件进行了概述。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。
由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用:1.评价药品批间质量的一致性;2.指导新制剂的研发;3.在药品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。
对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。
对于仿制药申请,应在溶出曲线研究的基础上制定溶出度标准。
无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。
三、生物药剂学分类系统根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995):1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原则可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性(IVIVC)。
影响因素试验的溶出度测定测定方法参照美国药典盐酸二甲双胍缓释片质量标准。
照释放度测定法(中国药典2010年版二部附录X D第一法),采用溶出度测定法(中国药典2010年版二部附录XC第一法蓝法)的装置,以pH6.8磷酸二氢钾缓冲液(1000ml水中加入6.8g磷酸二氢钾,用0.2N的氢氧化钠溶液调pH为6.8 ± 0.1)1000ml为溶剂,转速为每分钟100转,按溶出度测定法依法操作。
分别于预定时间取溶液5ml滤过(并及时向溶出杯中补充同温度的溶剂5ml),取续滤液用释放介质稀释至适当浓度,照紫外分光光度法(中国药典2010版二部附录IV A),在232nm处测定吸光度。
另精密称取盐酸二甲双胍对照品适量,用释放介质配制成约5μg/ml浓度的溶液作为对照品溶液,计算出每片的释放度。
一、溶出介质的配制用电子天平称量磷酸二氢钾(固体)xxxg,氢氧化钠(固体)xxxg,置1000ml 烧杯中,用800ml蒸馏水溶解后,倒入10L广口瓶中,再用蒸馏水稀释至10L,配得缓冲介质。
二、对照品溶液的配制各置于100ml容量瓶中,用溶出介质溶解并定溶至刻度;用1ml移液管各精密量取1ml至50ml容量瓶中,用溶出介质定溶至刻度。
.各样品称量值自己列出。
三、试验过程向溶出仪6个溶出杯中各加入1000ml已配好的溶出介质,加热,待溶出杯中溶液温度达到37℃后,将6片药片同时放到6个溶出杯中后,立即开始搅拌并计时。
在1h、3h、5h、7h、10h时,用10ml的注射器各取样5ml,同时向溶出杯中补加同温度溶出介质5ml。
1h、3h样品取出后,过0.45um微孔滤膜,弃去2ml初滤液,取3ml续滤液;1h样品稀释25倍后测其吸光度;3h样品稀释50倍后测其吸光度。
四、实验结果见下表计算公式:(1)校正因子ff=(f1+f2+f3)/3f1=C1/A1; f2=C2/A2; f3=C3/A3C1、C2、C3:三份对照品的浓度A1、A2、A3:三份对照品的吸光度(2)累积释放度result=(f*A*n*v+C1h*5+ C3h*5+…..)*v*100/mm=500*831.64/833 A:相应样品的吸光度n:相应样品的稀释倍数v:溶出介质体积1000mlm:主药量(mg)C1h、C3h:对应1h、3h时溶出介质中药品的浓度。
药物固有溶出测定法、影响因素、溶出介质的选择总结:圆盘法、颗粒法药物的固有溶出(apparent intrinsic dissolution)是指一定量的药物(一般指原料药)在一定介质中,单位面积和单位时间内药物溶出的质量。
通常表示为固有溶出速率(intrinsic dissolution rate,IDR),其值以mg·cm-2·min-1表示。
药物的固有溶出不同于溶出度。
固有溶出是药物理化性质的重要参数之一,是药物固有的特性;而溶出度是指药物在规定介质中从药物制剂溶出的速度和程度,受到制剂辅料、制剂类型、工艺、纯度、介质等因素的影响,不能反映药物自身的特性。
同时,固有溶出也不同于溶解度。
固有溶出反映的是药物溶解的速度和程度,与体内溶出动力学密切相关;而溶解度只能反映化合物的溶解程度。
固有溶出可以在一定程度上反映药物的纯度,也可以用于评价原料药不同来源、批次间、不同结晶条件或不同晶型的一致性,还可用于考察药物不同盐基、晶型、粒度、表面活性剂、pH值等因素对溶出的影响,在一定程度上预测药物制剂的溶出行为,从而预测药物的生物利用度和疗效。
因此,药物的固有溶出速率可以为原料药质量评价、生产工艺的筛选提供数据支撑,为药物剂型的选择和处方的设计提供指导意见。
药物固有溶出的测定方法主要有2种:圆盘法和颗粒法。
圆盘法是将一定量的药物压制成薄片,放入溶出介质中,测定单位面积和单位时间内药物溶出的质量。
根据圆盘放置位置又可以分为转盘法和定盘法。
由于圆盘法测定结果比较稳定,使用范围比较广,所以被多国药典所收载。
颗粒法是将一定粒径的药物原料颗粒放置在溶出介质中,测定单位时间内药物溶出的质量。
根据溶出介质是否含有助悬稳定剂,颗粒法又分为粗颗粒法和悬浮粒子法。
本文将重点对转盘法、定盘法、粗颗粒法及悬浮颗粒法的试验方法、影响因素及应用情况进行介绍。
4种固有溶出测定装置示意图如图1所示。
圆盘法圆盘法是采用适宜的装置将药物压成直径固定的非崩解薄片,将药物薄片及载药模具一起放入一定量的溶出介质中,调整模具及搅拌桨的位置,在一定的转速下、特定的时间点取样分析。
溶出条件的选择
溶出条件的选择取决于药物的化学性质、制剂的种类、溶出介质的选择、药品的目标控制剂量以及稳定性等因素。
一般来说,以下考虑因素需要考虑:
1. 药物性质:药物的溶解度、极性、pH值等影响药物释放的因素,这些性质应该在选择溶出条件时考虑。
2. 制剂类型:缓释、控释或者速释等制剂类型需要根据释放次数和药物生物利用度等因素选择不同的溶出条件。
3. 溶出介质的选择:医药行业中通常使用不同类型的溶出介质,主要包括模拟胃液、模拟肠液、模拟生物液等。
4. 目标控制剂量:药物剂量需要在溶出条件的选择中考虑,因为药物剂量可以影响溶出速率。
5. 药品稳定性:药品稳定性需在选择溶出条件中考虑,因为可能某个特定的溶出介质可能对药物有负面影响。
总的来说,溶出条件的选择需要根据药物的化学性质,制剂种类,目标控制剂量以及溶出介质的选择等多个方面的考虑。