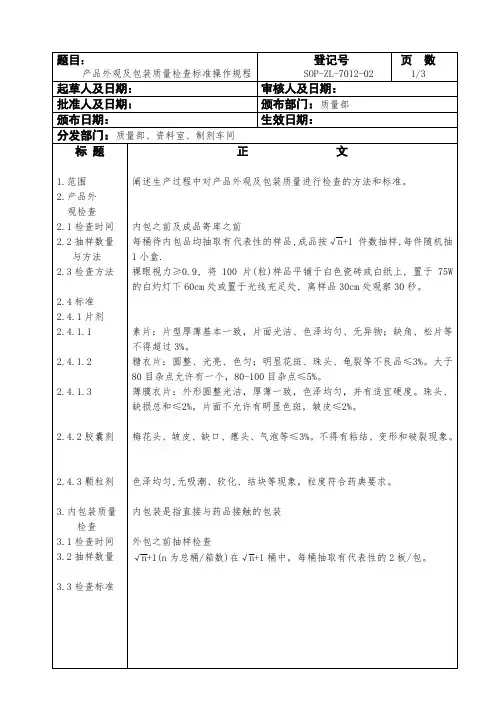
SPK 部品检查基准
- 格式:xls
- 大小:1.76 MB
- 文档页数:26

每一个大标题代表的是一篇技术文章溶剂清洗之极性、KB值以及SP值首先,在分子结构中原子排列不对称,正负电荷的重心没有重合,这种分子就叫极性分子,由极性分子构成的污染物就叫极性污染物,反之亦然。
常见的极性污染物如:有机酸、无机酸、盐类、碱类、污水、手汗、电镀残液、焊接活化剂等。
常见的非极性污染物如:润滑油、防锈油、机油、淬火油、蜡、脂等。
常见的极性溶剂如:水、甲醇、乙醇、异丙醇、丙酮、环己酮、乙二胺、乙二醇等。
常见的非极性溶剂如:CFC-113、四氯化碳、己烷、庚烷、辛烷、苯、汽油、煤油等。
极性溶剂比较容易溶解极性污染物,反之亦然。
KB值:贝松脂丁醇值,也叫考里丁醇值用来度量有机溶剂溶解非极性污染物的相对能力,值越大,溶解能力越强。
SP值:溶解度参数表示溶剂与溶质(污染物)之间相互作用的一个参数,两者的SP值越接近表示越容易溶解。
SMT 清洗工艺---实验选用SMT清洗溶剂一.前置作业1.将锡膏送入烤箱,以240℃的温度烘烤,使锡铅粉与助焊膏分离。
2.自然泠却四天(模拟PCB经Reflow后没有立刻清洗,松香已部分硬化),共取得50g助焊膏待用。
二.后段操作步骤及观察取250ml的烧杯,将0.5ml的助焊膏各放入两个烧杯内,将200ml清洗溶剂加入烧杯。
静置5分钟,看溶剂是否有混浊,助焊膏是否有溶解。
接着搅拌1分钟后来观察烧杯内的变化.搅拌完后再静置10分钟,并观察烧杯内的变化溶剂与助焊膏有部分不相溶会出现上面的情况。
右侧的溶剂效果很好。
溶剂溶解这种助焊膏的溶解能力差,会出现上面的情况,可以看一左侧的杯子有少许残留部分没有被溶解,右侧的溶剂效果很好水基清洗剂替代碳氢清洗剂、三氯乙烯工艺(图)***五金制品加工后序原表面处理工艺是采用了碳氢清洗剂除油清洗工艺,我司于2010年4月21日针对该工艺改良为水基除油工艺的可行性进行现场试验。
原工艺设备:老式三氯乙烯清洗机原工艺清洗剂:溶剂型碳氢清洗剂(经现场检验非真正碳氢清洗剂,碳氢清洗剂密度为0.73-0.85,而实测1.2以上)原工艺流程:将工件浸泡在溶剂中,稍加热,超声波振动清洗,仅为一槽。
![BB-26-37_PL保证体系运营规则(Rev[1][1].0__2004.03.11)](https://uimg.taocdn.com/f7c1c0efe009581b6bd9eb89.webp)

JIS检查标准C5017-1994 4.尺寸4.1 格子尺寸4.1.1 基本格子FPC的格子以米系格子为标准, 英寸系格子只使用在有必要与以前产品整合的产品上.基本格子尺寸如下:米系格子 2.50MM英寸系格子2.54MM4.1.2 辅助格子如有必要做比4.1.1 基本格子小的格子时,按以下标准执行.米系格子0.5MM 单位(但是如要求更细时为0.05MM单位)英寸系格子0.635MM 单位备注:使用比0.05MM及0.635MM更小的格子.4.2 外形尺寸外形尺寸按供需双方协商的标准执行, 对于公差:外形尺寸未满100MM 时,为±0.3MM.100MM以上时为±0.3%.4.3 孔4.3.1 孔径及公差(1) 部品孔插件孔的最小孔径为0.50MM. 公差为±0.08MM.(2). 通孔作为双面FPC 通孔使用的镀通孔为圆孔, 通孔电镀后的最小孔径为0.50MM, 公差为±0.08MM.(3)安装配件孔(a)圆孔圆孔的最小孔径为0.50MM, 公差为±0.08MM.(b) 方孔方孔一边最小尺寸为0.50MM. 公差为±0.08MM.4.3.2 安装配件孔端部到板端部的最小距离为2.0MM 以上4.3.3 孔位的偏移加工完后孔位置的偏移与设计孔位置相比偏0.3MM 以下.但不包括镀通孔.4.3.4 孔中心距离100MM以下的孔中心距离公差为±0.3 MM, 100MM 以上为±0.3%.4.4导体4.4.1 加工完后的导体公差如下表2所示:表2 加工完后导体的公差单位:MM4.4.2线路公差如表3所示表3 线路公差单位 MM4.4.3 板端部及线路间的最小距离为0.5MM 以上.4.5 焊盘4.5.1 最小焊盘宽度如图1所示焊锡位有效加工焊盘的宽度0.05MM以上.4.6 镀铜通孔的厚度镀铜通孔内壁的厚度平均0.015MM 以上,最小镀层厚度 0.008MM 以上.5.外观5.1 线路外观5.1.1 断线不能有断线5.1.2 缺损针孔如图2所由于缺损、针孔导致的线路缺损宽度(W1)为完成品FPC线路宽度(W)的1/3以下;长度(L)为完成品FPC线路宽度(W)以下图2 缺损针孔5.1.3 线路间的铜残留如图3所铜残留及突起的宽度(W1),为完成品FPC的线路间距离1/3 以下.5.1.4 线路表面的蚀刻如图4 蚀刻过度出现的表面凹塌,不能完全横跨整个线路.5.1.5 线路的剥离如图5 线路的剥离宽度(a)及长度(b), 与FPC完成品的线路宽度比较可接受范围如下图所示,但是对于需要反复弯曲部分,不能影响到弯曲的特性.(1)有覆盖层部分B≦W 可弯曲部分 a/w≦1/3一般部分 a/w≦1/2(2)没有覆盖层部分a/w≦1/4 b/w≦1/45.1.6 线路的裂纹线路上不能有裂纹.5.1.7 线路的架桥线路上不能有架桥.5.1.8 线路的研磨擦伤由研磨刷引起的擦伤的深度不能超过线路厚度的20% 但是对于反复弯曲部分,不能影响到弯曲特性.5.1.9 打痕/压痕如图6 打痕/压痕从表面开始的深度0.1MM 以内,测量深度困难时,背面的底层膜的突起高度(C)可视为打痕的高度.5.2 FILM 面的外观没有线路的FILM 面外观缺损公差如表4 不能有其他影响到实际使用的凹凸、弯折、起皱、剥离。


《我国药典》是我国药品及相关产业的权威标准,对药品包装材料的要求也十分严格。
在药品包装用金属方面,共有13个配套的检测方法,这些方法对于确保药品包装的安全性和质量至关重要。
本文将针对此主题进行详细介绍。
一、外观和尺寸1. 外观检验:对药品包装金属材料的外观进行检查,确保表面光洁、无划伤、无明显凹陷和氧化等情况。
2. 尺寸测量:测量金属材料的厚度、宽度和长度等尺寸,确保符合国家标准和药品包装要求。
二、成分和化学性质3. 成分分析:采用化学分析方法,对金属材料的成分进行分析,检测其是否符合药品包装的要求。
4. 化学性质测试:测试金属材料的化学性质,包括耐腐蚀性、酸碱性等,确保其在药品包装过程中不会对药物产生影响。
三、力学性能5. 强度测试:对金属材料进行拉伸、压缩等测试,检测其强度和韧性,以确保在包装过程中不易变形或破损。
6. 硬度测试:测试金属材料的硬度,确保其能够承受包装过程中的压力和外力。
四、表面性能7. 表面粗糙度测试:对金属材料的表面粗糙度进行测试,确保其表面光滑度符合药品包装的要求。
8. 清洁度测试:测试金属材料的清洁度,确保不含有对药品有害的杂质和污染物。
五、热学性能9. 热稳定性测试:测试金属材料在高温下的稳定性,确保在包装过程中不会出现变形或者释放有害物质。
10. 密封性能测试:对金属材料的密封性能进行测试,确保包装过程中不会出现渗漏或氧化等问题。
六、防腐性能11. 耐腐蚀性测试:测试金属材料的耐腐蚀性能,确保在长期储存过程中不易生锈或腐蚀。
12. 包装完整性测试:测试金属包装的完整性,包括焊接、接头等部分,确保在运输和储存过程中不会出现破损或松动。
七、其他13. 紫外线测试:测试金属材料的紫外线防护性能,确保在阳光下不会造成金属包装的材料变质或者药品受到影响。
《我国药典》对药品包装用金属的13个配套检测方法,涵盖了外观和尺寸、成分和化学性质、力学性能、表面性能、热学性能、防腐性能等多个方面,确保了金属材料符合药品包装的要求,保障了药品的质量和安全。

「輸液幫浦」臨床前檢測基準(草案)Guidance for Pre-clinical Testing of Infusion Pump (Draft)【說明】1.本檢測基準係提供醫療器材廠商辦理產品查驗登記時,臨床前測試應檢附相關資料及進行項目之建議,未包含臨床試驗等其他資料之要求,當業者辦理醫療器材查驗登記申請時,仍應符合相關法規。
廠商亦應依個案產品結構、材質及宣稱效能提出完整驗證評估(含臨床前測試及/或臨床試驗等)之資料。
2.本檢測基準依據現行之參考資料制定,惟科技發展日新月異,法規更新未逮之處,為確保國人健康安全,審查人員將視產品宣稱效能、結構與設計之安全性及功能性,要求廠商提供本檢測基準所列項目外之驗證評估(含臨床前測試及/或臨床試驗)資料;另本檢測基準將不定期更新。
3.臨床前測試資料應包括檢驗規格(應含各測試項目之合格範圍及其制定依據)、方法、原始檢驗紀錄及檢驗成績書等。
4.如製造廠未進行表列測試項目,應檢附相關文獻或科學性評估報告,以證實產品仍具有相等之安全及功能。
5.各項測試如本檢測基準或表列參考方法未訂有規格者,得由各製造廠自行制定規格;如本檢測基準或表列之參考方法已訂有規格,惟製造廠另訂不同規格者,應檢附相關文獻或科學性評估報告以說明訂定規格之依據。
6.製造廠所使用之測試方法如與本檢測基準所列參考方法不同,但(1)具等同性者,應檢附製造廠測試方法供審核;(2)如不具等同性,應檢附製造廠測試方法及相關文獻,或科學性評估報告,以說明該測試方法制定之依據。
7.如表列參考資料有修訂、廢止或被其它標準取代,製造廠得參照新版標準進行測試。
一、本基準適用之醫療器材範圍(Scope):本檢測基準適用於利用電動式或機械式動力將輸液推進細管內且可控制輸液流速之設備。
其動力機構可由推進式幫浦、圓筒式幫浦或蠕動式幫浦組成。
二、本基準適用醫療器材之衛生署公告分類分級品項(regulation number)及其鑑別(Identification):公告品項:J.5725 輸液幫浦(Infusion pump)鑑別:輸液幫浦是使用在醫療場所,將輸液以控制方式輸入患者体內。

1目的建立微生物限度检查的标准操作规程,确保检验结果的准确性。
2 范围适用于本厂质监科化验室对本厂生产的固体制剂及物料进行微生物限度的检查。
3 责任化验员有责任按照本操作规程进行检验、判定,并对检验结果负责。
4 定义微生物限度检查法系指非规定灭菌制剂及其原、辅料受到微生物污染程度的一种检查方法,包括染菌量及控制菌的检查。
5 内容5.1 总则:5.1.1供试品应随机抽样。
一般抽样量为检验用量(2个以上最小包装单位)的3倍量。
5.1.2 供试品在检查前不得开启,检查全过程均应严格遵守无菌操作规程,严防再污染。
5.1.3 控制菌的污染检查应做相应的已知菌对照试验,对照菌株为大肠杆菌[CMCC(B)44102],每批试验已知菌加入量为50-100个。
5.1.4 染菌量的检查或控制菌的检查均应做空白对照试验。
5.1.5 供试品稀释成稀释液后应在均匀状态下取样,凡有抑菌成份或防腐剂的供试品应做特殊处理后进行检验。
5.1.6 供试品稀释后应在1小时内操作完毕。
5.1.7 除另有规定外,细菌培养温度为30-35℃,霉菌、酵母菌培养温度为25-28℃,控制菌培养温度为36℃±1℃。
5.1.8细菌、霉菌检验结果的报告以1g、1ml或10cm2为单位;控制菌检验报告以每1g、每1ml或每10cm2为单位报告“检出”或“未检出”。
5.2仪器、用具恒温培养箱、隔水式生化培养箱、电子天平,移液管(1ml、10ml)、试管、离心管、双碟、镊子、剪刀、不锈钢吸管筒、酒精灯、取样勺、称量纸、研钵一个、不锈钢双碟筒。
5.2.1用具的包扎移液管:用纱布包住移液管,然后放入不锈钢灭菌筒内。
试管、双碟:试管在管口塞上纱布棉塞、双碟放入不锈钢双碟筒内。
无菌衣、裤、帽、口罩:用布口袋将洗净的衣裤、帽子、口罩配套后装入,扎紧袋口,再用牛皮纸包好。
5.2.2用具的灭菌将包扎好的用具,在121±0.5 ℃蒸汽灭菌柜中灭菌30 分钟,物品取出时切勿立即置冷处,以免急速冷却灭菌物品内蒸汽凝造成负压,易致染菌,应置烘箱烘干。
第一章扬声器材料的认识第一节各部品材料的认识一、扬声器材料的构成喇叭厂属材料组装型企业,故开发的关键就是原材料的选择。
原材料的好坏很大程度上决定的产品品质,同时直接决定了产品的成本。
因此产品开发设计是决定产品品和企业经济效益的关键做认识。
(一)、支架(FRAME)亦称BASKET,是安装振动部分零件,磁气回路和其它零件的母体。
小型SPK的支架都是钢板,材质为SPCC(S:STEEL钢铁P:板钢C:COLD冷锻C:硬度区分)。
钢板的材质厚度为0.5~1.2MM冲压成型,表面通常处理有五彩电镀,烤黑、电黑,加以防锈。
大口径的磁气回路特别强劲笨重,钢板材质会使用1.0MM甚至更厚。
但高级HI-FI SPK也有用铝铸的支架,此外用塑料成型的支架亦很多, 防水喇叭及头机最常用。
塑料框的材质多为ABS或ABS加纤以增高耐热及强度。
有些游艇上使用的塑料框的材质为ASA料,可以延长塑料框受紫外线照射而变颜色的时间。
铁框材质的厚度除对SPK承受压力有影响外,同时对SPK的安装后能否承受一定的振动不致变形亦有影响。
此外,SPK工作频繁振动时,支架可能会在某些频率产生共振而影响音质。
中高音SPK的支架多为密闭的,故也有音箱的性能。
如有为中音时,通常要求有必要的内在容积及在振动的背面不产生定在波的形状,通常为了防止定在波的发生和调整FO与Qo值之需,要在支架内部填入吸音的材料。
开发设计选用支架时,应注意三点:1.平面度:鼓纸EDGE,弹波EDGE与框接着处需平坦,充分严密才安全。
对于鼓纸EDGE为凹边时,还需考虑SPK工作振动时EDGE是否碰着框面。
2.高度设配:结合弹波、鼓纸有效高来设计或选用合适之铁框,三点接着处鼓纸与弹波间需有少许空隙,一般为0.3~0.8MM为宜,过紧穿鼓纸后使颈部胶外分,与音圈不能很好接着,严重者使压鼓纸困难造成CI、B声、胴体翘高度不一、弹波下陷、A声不良机率增加等诸多不良。
另外弹波面到底部的高度及内部空间,对于功率大,振幅大的SPK,若此高度不够,振动时弹波颈部会碰着铁片或铆接浮凸点,而造成一种类似AB不良的致命缺点。
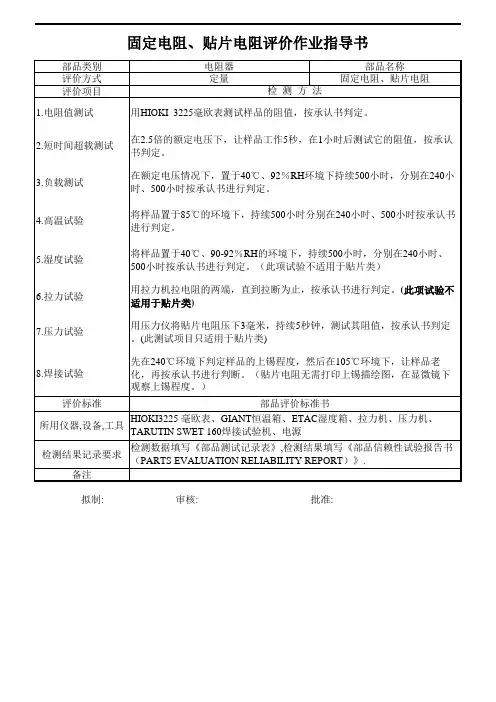
NO检验周期破坏性试验使用剪刀剪断音圈骨架,把音圈铜线撕下检验音圈引线的粘接性粘贴牢固视为良品,粘贴不牢铜线撕下光滑为粘到纸为NGn=2c=0D.C.R检验使用电阻测试仪测量依据工程部提供的音圈部品图面D.C.R规格要求检验n=10c=0配套性检验取相应的音规进行配套后目视检验与音规配套时不可太松动或太紧凑n=2c=0外观检验比对样品,进行目视检验(重点检查音圈线接线胶点是否完全覆盖音圈线)依据《来料检验细则》进行检验判定MIL-STD-105E AQL G-II 致命缺陷:0严重缺陷:0.4轻微缺陷:1.0尺寸检验使用带表卡尺、千分尺依据Voice Coil部品图面要求,对以下尺寸进行重点测量,测量的数据必须满足部品图面的规格要求依据工程部提供的音圈部品图面尺寸规格要求检验判定n=5c=0每LOT每LOT每LOT每LOT每LOT12345 不可有污染,变形等其它外观不良,接导线的音圈需重点检查确认接线胶点是否完全覆盖音圈引线。
3.样品的抽取方法样品的抽取代表LOT的质量,所以抽取时必须随机抽取.随机抽取的原则:最大限度的保证高开箱率, 样品抽取的分散性越大越好。
4.外观检验基准适用于浙江祥晖数码科技有限公司生产及委外加工生产的SPEAKER所用的VOICE COIL部品的来料检验。
2.检验项目、检验方法、检验基准和判定水准检验项目检验方法检验基准判定水准1.适用范围:点胶OK点胶NGNO检验项目检验周期3焊接性试验每LOT1.股数与样品是否一致;2.不可有氧化,生锈、抽丝;3.绕线方式与样品对比是否一 致.MIL-STD-105E AQL G-II 致命缺陷:0严重缺陷:0.4轻微缺陷:1.0n=5用带表卡尺依据部品图面要求,对标注尺寸进行测量,测量的数据必须满足部品图面的规格要求.比对样品进行目视检验每LOT每LOT外观尺寸12 外观检验时导线不能有断丝,刮伤等其它有害不良;确认端子板PIN表面的光滑度,使用电烙铁进行焊锡作业目视检验确认锦丝线浸锡处表面焊接上锡是否良好n=23.抽取方法样品代表LOT的质量,所以必须随机抽取4.外观判定水准1.适用范围适用于浙江祥晖数码科技有限公司及其委外加工所使用LEAD部品的来料检验2.检验项目,检验方法、检验基准及判定水准检验方法检验基准判定水准。
LGEHZ(品)A4003(960424)LGEHZ(品)A4003(960424)社外秘社外秘社外秘社外秘社外秘LGEHZ(品)A4003(960424)社外秘LGEHZ(品)A4003(960424)社外秘社外秘社外秘LGEHZ(品)A4003(960424)社外秘社外秘LG 电子音箱检查基准制定日期:97.10.28改正编号: 3 LGEHZ-B-5301-3A 8.附表及关联标准和格式PAGE : 17/24附表1LGEHZ(品)A4003(960424)LG 电子音箱检查基准制定日期:97.10.28改正编号: 3 LGEHZ-B-5301-3A 8.附表及关联标准和格式PAGE : 18/24附表2LGEHZ(品)A4003(960424)LG 电子音箱检查基准制定日期:97.10.28改正编号: 3 LGEHZ-B-5301-3A 8.附表及关联标准和格式PAGE : 19/24格式1LGEHZ(品)A4003(960424)社外秘LG 电子音箱检查基准制定日期:97.10.28改正编号: 3 LGEHZ-B-5301-3A 8.附表及关联标准和格式PAGE : 20/24格式2LGEHZ(品)A4003(960424)社外秘LG 电子音箱检查基准制定日期:97.10.28改正编号: 3 LGEHZ-B-5301-3A 6.检查项目PAGE : 21/24格式3LGEHZ(品)A4003(960424)社外秘LG 电子音箱检查基准制定日期:97.10.28改正编号: 3 LGEHZ-B-5301-3A 6.检查项目PAGE : 22/24格式4LGEHZ(品)A4003(960424)社外秘LG 电子音箱检查基准制定日期:97.10.28改正编号: 3 LGEHZ-B-5301-3A 6.检查项目PAGE : 23/24格式4LGEHZ(品)A4003(960424)社外秘LG 电子音箱检查基准制定日期:97.10.28改正编号: 3 LGEHZ-B-5301-3A 6.检查项目PAGE : 24/24格式4LGEHZ(品)A4003(960424)。
药辅产品质量管理测定方法及产品质量控制分析一、引言药辅产品在医药产业中担当着至关重要的角色,它们不仅可以提高药品的稳定性和安全性,还可以改善其口感和服用体验。
由于药辅产品种类繁多、用途广泛,其质量管理和控制一直是医药生产中的难点问题。
为了确保药辅产品的质量,需要建立科学的测定方法和质量控制体系。
本文将从药辅产品的质量管理测定方法以及产品质量控制分析两个方面进行探讨。
二、药辅产品质量管理测定方法(一)理化指标测定1. 外观和形态:首先需要对药辅产品的外观和形态进行测定,包括颜色、形状、大小、表面光滑度等指标。
这些指标可以通过肉眼观察和显微镜检查来进行测定。
2. 密度和比重:密度和比重是衡量药辅产品质量的重要指标,可以通过密度计和比重计进行测定。
3. 溶解度:溶解度是衡量药辅产品溶解性能的重要指标,可以通过离子色谱法或者红外光谱法进行测定。
4. 粒度和颗粒度分布:粒度和颗粒度分布对药辅产品的质量有着重要影响,可以通过粒度分析仪进行测定。
(二)成分含量测定1. 主要成分含量:药辅产品中的主要成分含量直接关系到其质量,可以采用高效液相色谱法(HPLC)、气相色谱法(GC)或者质谱联用法(LC-MS/MS)进行测定。
2. 杂质含量:杂质是影响药辅产品质量的重要因素,可以通过分光光度计、紫外-可见分光光度计等仪器进行测定。
3. 残留溶剂含量:残留溶剂是一种严重影响药辅产品安全性的因素,可以通过气相色谱法(GC)或者液相色谱法(LC)进行测定。
1. 细菌总数:细菌总数是反映药辅产品微生物污染程度的重要指标,可以通过菌落计数法或者膜过滤法进行测定。
除了上述指标外,根据药辅产品的具体特性,还可以进行部分特殊指标的测定,例如pH值、氧化还原电位等。
三、产品质量控制分析(一)质量控制标准的制定在确定药辅产品的质量控制标准时,要充分考虑药辅产品的性能特点和使用要求,结合国家规定的相关标准,制定出科学合理的质量控制标准。
药辅产品质量管理测定方法及产品质量控制分析药辅产品质量管理是药品生产过程中非常重要的环节,其目的是保证药品的质量、安全和有效性。
药辅产品质量管理的核心是对药辅产品进行质量控制和质量监测,确保药辅产品的质量符合相关的标准和规定。
药辅产品的质量控制需要通过一系列的检测方法和技术手段进行,以确保药辅产品的质量符合标准要求。
下面介绍几种常见的药辅产品质量管理测定方法及产品质量控制分析。
1. 一般检验方法对于常用的药辅产品如溶剂、溶剂剂量瓶、滤纸、移液器等,需要进行一般检验方法的检测。
一般检验方法包括外观检查、净度检查、酸度和碱度、比重、沸点等参数的测定。
这些参数可以通过简单的实验或测量得到,以确定药辅产品的质量和适用范围。
2. 质量控制标准的制定药辅产品的质量控制标准是药品生产和质量监测的重要依据。
药品生产企业应根据国家的标准和规定,结合自身的生产条件、质量控制要求和市场需求制定药辅产品的质量控制标准。
质量控制标准包括产品的物理化学性质、理化指标、微生物指标等。
药辅产品检验方法的准确性和可靠性对于药品生产过程的质量管理和质量监测至关重要。
因此,药品生产企业需要对检验方法进行验证,证明检验方法的准确性和可靠性。
检验方法的验证包括检测灵敏度、特异性、准确度、精密度和稳定性等参数的评估。
4. 质量监测药辅产品的质量控制不仅需要在生产过程中实施,还需要在药品存储、运输和使用过程中进行监测,以确保药辅产品的质量不受污染或变质。
质量监测包括药辅产品的外观检测、微生物检测、理化指标检测等。
5. 原材料的检验6. 生产过程中的质量控制在药品生产过程中,药辅产品的质量控制需要贯穿始终。
生产过程中需要制定有效的质量控制措施,确保生产过程中药辅产品的质量得到充分保障。
生产过程中的质量控制措施包括原材料入库检验、生产过程监控、生产过程中检验和监测、产成品检验等。