第一向等电聚焦系统
- 格式:doc
- 大小:244.50 KB
- 文档页数:6





第一部分介绍1.0手册的介绍这本手册分五大部分。
第一部分对手册进行了介绍。
第二部分介绍了样品预处理的方法。
第三部分细叙了进行双向电泳第一向电泳的过程。
第四部分介绍了利用IPG胶条进行第二向电泳的一般方法。
第五部分讨论了双向电泳的显影和结果分析。
在这里,使用Amersham pharmacia Bioteeh公司的产品进行双向电泳介绍,设备的选择我们在1、2节中介绍。
1.1 双向电泳的介绍双向电泳是分析从细胞、组织或其它生物样品中提取出来的蛋白混合物最有力和广泛运用的方法。
这项技术利用蛋白质在两次独立的分离步骤中的特性将蛋白质分开:第一向步骤——等电聚焦(IEF)根据蛋白质的等电点(PI)将蛋白质分离。
在第二向步骤中SDS—聚丙烯酰胺凝胶电泳(SDS—PAGE)利用蛋白质的分子量(MW)大小将它们分离。
二向电泳所得结果的斑点序列都对应着样品中的单一蛋白。
因此,上千种蛋白质均能被分离开来,并且各种蛋白质的等电点,分子量和含量的信息都能得到。
双向电泳在1975年由P.H.OFarrel[1]和J.Klose[2]提出,在早先的技术中,第一向分离在含有载体两性电解质的聚丙烯酰胺凝胶载体中进行,这种胶在狭窄的试管中灌注而成。
样品放入管胶的某一端,并且在很高的电压下将它们分开。
在完成等电聚焦(IEF)以后,凝胶棒从管子中取出来,在SDS样品缓冲液中平衡。
随后,放在垂直SDS—聚丙烯酰胺凝胶上,进行第二向分离。
自从双向电泳被被提出以来,双向电泳作为生化分离技术的重要性事实上早已被承认。
但是,它是在最近几年被广泛应用的,由于在各方面的改进。
■2—D技术被改进而产生了2—D的图象,这在分辨率和重复性上有很大提高。
这项新技术是由A.Gorg和他的同事发明的。
在2—D技术中,使第一向电泳得到了改进,利用固定的pH梯度代替了载体两性电解质产生的pH梯度,并且用塑料胶片支撑的凝胶条代替了柱状凝胶。
在章节3.1“Background to IEF”中阐述了这种技术的优越性。

蛋白质纯化实验实验技术简介:双向电泳(two-dimensional electrophoresis)是等电聚焦电泳和SDS-PAGE的组合,即先进行等电聚焦电泳(按照pI分离),然后再进行SDS-PAGE(按照分子大小),经染色得到的电泳图是个二维分布的蛋白质图。
【晶莱生物】实验操作流程:1、样本制备2、固相预制胶条水化3、第一向等电聚焦(IEF)4、胶条平衡5、第二向SDS-PAGE电泳6、凝胶染色检测7、图片扫描实验注意事项:客户提供:1、原样(组织、细胞、菌体等)湿重不少于200mg。
2、蛋白提取物,浓度不少于4ug/ul,总量不少于5mg。
3、寄样须知:样品需低温保存,用干冰保存快递。
交付标准:1、双向电泳电子图片及定量分析结果,包括差异点号码、差异倍数。
2、差异点的一级质谱或二级质谱峰图,质谱鉴定结果,包括pI和MW等。
3、双向电泳完整的实验步骤、使用仪器、软件检索参数等。
一、仪器设备色析管柱(Pharmacia C column, 1.6×100 cm)、铁架、铁夹及水平仪;部分收集器(fraction collector, 需准备干净试管约100 支);浓缩用离心机(低速5,000 rpm);浓缩用离心管Centriprep-30 (Amicon 4322)请注意其使用方法。
二、药品试剂胶体Sephacryl S-300 (Pharmacia):a. 预先以缓冲液buffer A-150 平衡好,并且使完全沈降后的胶体体积,占全部体积的七至八成;要先预估好胶体的使用量。
b. 胶体温度要与操作场所的温度一致,否则温度变化会产生气泡。
c. Sephacryl 系列胶体有相当大的吸附力,因此要在缓冲液加入0.15 M 以上的NaCl 以除去非专一性吸附。
Buffer A-150:注意使用时的温度要与管柱胶体的温度一致标准分子量组合(Bio-Rad 151-1901):溶于1 mL 后每组取0.4 mL.含有thyroglobulin (670 kD), bovine gamma globulin (158 kD), chicken ovalbumin (44 kD), equine myoglobin (17 kD), vitamin B12 (1 350)三、管柱装填1. 以纯水冲洗玻璃管柱(以纯水上下冲洗即可,严禁使用试管刷);并请了解管柱的构造与拆装方法,垂直架好管柱,以软管连接部分收集器,并以bufferA-150 试看管路是否通畅;可以用止血钳或长尾文书夹夹住出口软管,则可控制溶离的进行。



双向电泳资料蛋⽩质双相电泳系统⼀. 样品制备1、型号:MicroRotorfor Cell⽣产⼚家:Bio-Rad (美国伯乐公司)除传统的层析⽅法,等电点分离⽅法等样品提取⽅法外,Bio-Rad提供了独特的样品序列抽提⽅案,提⾼了样品处理的灵敏度和分辨率。
⽤途:根据等电聚焦原理对蛋⽩质进⾏纯化,达到样品的去污染、粗分和浓缩。
技术指标分离组分10聚焦槽内径r 13mm样品体积 2.3-2.5ml组分体积200-250ul上样量微克⾄毫克冷却内置式半导体冷却系统2. 电源主要技术参数型号:PowerPac Hv1. 电压:20-5,000V2. 电流:0.01-500mA3. 功率:1-400W4. 输出: 4对电源输出,可同时运⾏4个电泳槽5. 输出⽅式:恒压,恒流⽅式或恒功率,可编程6. 定时:1min-99hr,59min7. 暂停功能:有8. 操作条件:0-40度,湿度0-95%,⽆冷凝⽔9. 安全标准:EN61010,EC10. 安全性能:经空载检测,突变负载检测,超载/短路保护,输⼊线保护,断电保护测试.11. 可编程⽅法:储存9个⽅法,每个最多9个步骤.⼆.第⼀向电泳⼀维等电聚焦系统及⼲胶条型号:Protean IEF Cell⽣产⼚家:Bio-Rad (美国伯乐公司)Protean IEF系统是⼀体化的⼀维等电聚焦系统,它提供了10000V的⾼电压,以及10-25度的精确温控。
同时,IEF可同时容纳12根11,17,18,24cm的胶条,保证了实验的⾼通量。
对于实验室经常进⾏的7cm的预实验(摸索条件等),它可提供每次跑24根胶的⾼通量。
我们提供了不同尺⼨不同的pH值梯度的IPG(immobilized pH gradient)⼲胶条。
从尺⼨分有7,11,17,18cm⼲胶条,并即将推出24cm⼲胶条;从pH值梯度分,有宽梯度:3-10线性,3-10⾮线性;有窄梯度:3-6,4-7,5-8,7-10;有微梯度:3.9-5.1,4.7-5.9,5.5-6.7,6.3-8.3。

Bio-rad 双向电泳系统标准操作规程1、目的:正确使用Bio-rad 双向电泳系统,确保Bio-rad 双向电泳系统正常运行。
2、适用范围:Bio-rad 7cm/11cm/17cm双向电泳系统。
3、责任人:双向电泳系统操作人员。
4、程序:4.1、第一向等电聚焦4.1.1、准备工作及注意事项用标配的刷子小心将聚焦盘清洗干净,注意聚焦盘两端的两根电极丝,晾干后备用;根据样品使用合适的水化上样液,对于不同的聚焦盘的上样体积可参考下表:4.1.2、上样4.1.2.1、从冰箱中取-20℃冷冻保存的水化上样缓冲液(不含DTT,不含Bio-Lyte)一小管,置室温溶解,加入合适的DTT与Bio-Lyte,充分混匀。
4.1.2.2、从小管中取出适量水化上样缓冲液与样品充分混匀。
4.1.2.3、取出-20℃冷冻保存的IPG预制胶条,室温中放置10分钟。
4.1.2.4、沿着聚焦盘或水化盘中槽的边缘至左而右线性加入样品。
在槽两端各1cm左右不要加样,中间的样品液一定要连贯。
注意:不要产生气泡。
否则影响到胶条中蛋白质的分布。
4.1.2.5、当所有的蛋白质样品都已经加入到聚焦盘或水化盘中后,用镊子轻轻的去除预制IPG胶条上的保护层。
4.1.2.6、分清胶条的正负极,轻轻地将IPG胶条胶面朝下置于聚焦盘或水化盘中样品溶液上,使得胶条的正极(标有+)对应于聚焦盘的正极。
确保胶条与电极紧密接触。
不要使样品溶液弄到胶条背面的塑料支撑膜上,因为这些溶液不会被胶条吸收。
同样还要注意不使胶条下面的溶液产生气泡。
如果已经产生气泡,用镊子轻轻地提起胶条的一端,上下移动胶条,直到气泡被赶到胶条以外。
4.1.2.7、在每根胶条上覆盖1-3ml矿物油,防止胶条水化过程中液体的蒸发。
需缓慢的加入矿物油,沿着胶条,使矿物油一滴一滴慢慢加在塑料支撑膜上。
4.1.2.8、对好正、负极,盖上盖子。
设置等电聚焦程序。
4.1.3、设置程序4.1.3.1、打开电源;4.1.3.2、根据情况选择水化(REHYDRATION),预设的程序(PRESET METHOD),储存的程序(STORED METHOD),新的程序(NEW METHOD);4.1.3.3、如果只需要水化,选择水化(REHYDRATION)选项,在接下来的界面选择主动水化或者被动水化、水化温度、水化时间;4.1.3.4、如果需要跑完整的程序,选择新的程序(NEW METHOD), 在接下来的界面选择是否水化,并设置相应的等电聚焦程序,设置完成后,在最后的界面选择总的胶条数、限电流和聚焦温度,然后开始运行程序。
模块五蛋白质双向电泳1. 实验目的掌握双向电泳能根据等电点和分子量分离蛋白质的原理,第一向等电聚焦电泳(IEF)和第二向聚丙烯酰胺凝胶电泳(SDS-PAGE)操作步骤,掌握凝胶染色方法,掌握凝胶分析软件的使用,了解对分离出的特异蛋白质的进一步分析方法,了解利用电泳技术分析生物大分子的方法。
2. 实验原理从广义上讲,双向电泳是将样品电泳后为了不同的目的在垂直方向再进行一次电泳的方法。
目前蛋白质双向电泳常用的组合第一向为等电聚焦(载体两性电解质pH梯度或固相pH梯度),根据蛋白质等电点进行分离,第二向为SDS-PAGE,根据相对分子质量分离蛋白质。
这样经过两次分离后,在凝胶上显示出的蛋白点可以获得蛋白质等电点和相对分子质量信息。
双向电泳技术作为分离蛋白质的经典方法,目前得到了相当广泛的应用。
在植物研究中,成功建立了拟南芥、水稻、玉米等植物种类的双向电泳图谱数据库,对推动植物蛋白质组研究起到重要作用。
第一向等电聚焦:等电聚焦(isoelectrofocusing,IEF)是在凝胶柱中加入一种称为两性电解质载体(ampholyte)的物质,从而使凝胶柱在电场中形成稳定、连续和线性pH梯度。
以电泳观点看,蛋白质最主要的特点是它的带电行为,它们在不同的pH值环境中带不同数量的正电荷或负电荷,只有在某一pH时,蛋白质的净电荷为零,此pH即为该蛋白质的等电点(isoeletric point,PI)。
在电场中,蛋白质分子在大于其等电点的pH环境中以阴离子形式向正极移动,在小于其等电点的pH 环境中以阳离子形式向负极移动。
如果在pH梯度环境中将含有各种不同等电点的蛋白质混合样品进行电泳,不管混合蛋白质分子的原始分布如何,都将按照它们各自的等电点大小在pH梯度某一位置进行聚集,聚焦部位的蛋白质质点的净电荷为零,测定聚焦部位的pH即可知道该蛋白质的等电点。
第二向SDS聚丙烯酰胺凝胶电泳:SDS是一种阴离子表面活性剂,当向蛋白质溶液中加入足够量的SDS时,形成了蛋白质-SDS复合物,这使得蛋白质从电荷和构象上都发生了改变。
蛋白质双向电泳【实验目的】1、学习和掌握蛋白质双向电泳的基本原理和方法。
2、了解双向电泳技术在蛋白质组学研究中的应用。
【实验原理】蛋白质的双向电泳的第一向为等电聚焦(Isoelectrofocusing, IEF),根据蛋白质的等电点(pI,isoelectric point)不同进行分离;第二向为SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),按蛋白质亚基分子量大小(Mr, relative molecule)进行分离。
经过电荷和分子量两次分离后,可以得到蛋白质分子的等电点和分子量信息。
等电聚焦(IEF, isoelectric focusing)是一种特殊的聚丙烯酰胺凝胶电泳,其特点是在凝胶中加入一种两性电解质载体,从而使凝胶在电场中形成连续的pH梯度。
蛋白质是典型的两性电解质分子,它在大于其等电点的pH环境中以阴离子形式向电场的正极移动,在小于其等电点的pH环境中以阳离子形式向负极移动。
这种泳动只有在等于等电点的pH环境中才停止。
如果在一种pH梯度的环境中将含有各种不同等电点的蛋白质混合样品进行电泳,那么在电场作用下,不管这一群混杂的蛋白质分子原始分布如何,各蛋白质分子将按照它们各自的等电点大小在pH梯度相对应的位置进行聚集经过一定时间后,不同的蛋白质组分便分割在不同的区域之中。
这个过程称作等电聚焦,蛋白质聚集的部位蛋白质所带电荷为零,测定此部位的pH值,即可知该蛋白质的等电点。
SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),主要用于测定蛋白质亚基分子量,SDS是一种阴离子去污剂,作为变性剂和助溶剂,它能断裂分子内和分子间的氢键,使分子去折叠,破坏蛋白质分子的二级和三级结构。
强还原剂(DTT,二硫苏糖醇)则能使半光氨酸残基之间的二硫键段裂。
在样品和凝胶中加入SDS和还原剂后,分子被解聚成它们的多肽链。
解聚后的氨基酸侧链与SDS充分结合形成带负电荷的蛋白质-SDS胶束,所带的负电荷大大超过了蛋白质分子原有的电荷量,这就消除了不同分子之间原有电荷的差异。
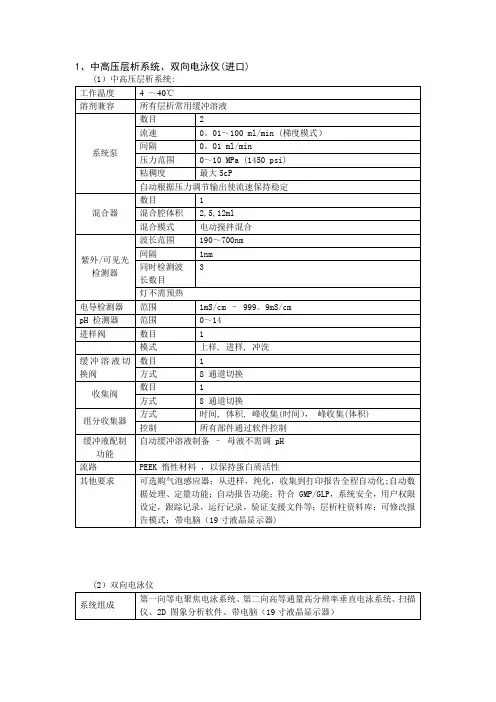
第一向等电聚焦(IEF)
图示:Ettan IPGphor3等电聚焦仪器和Ettan IPGphor3控制软件双向电泳的第一向IEF电泳采用IPGphor,实验将变得很简单。
IPGphor包括半导体温控系统(18°C-25°C)和程序化电源(8000V,1.5mA)。
可采用普通型胶条槽一步完成胶条的水化、上样和电泳,大大减少操作步骤。
IPGphor一次可进行12个胶条槽的电泳(7, 11, 13 ,18 ,24cm),因采用高电压(8000V),可缩短聚焦时间。
最新推出的通用型杯上样胶条槽因采用可移动的上样杯和电极,适合任何长度的IPG 胶条,尤其适合极性等电点蛋白的分离。
1.IPG胶条的水化和电泳
(1)仪器:IPGphor
(2)试剂:水化液(8M尿素,2%CHAPS,15mM DTT和0.5%IPG缓
冲液):水化液需当天新鲜配制(可配成储液分装-20℃保存,但不可反复冻融,尿素溶液加热温度不能超过37°C,否则蛋白会发生氨甲酰化)。
(3)实验步骤:
1)用样品溶解缓冲液(9M尿素,4%CHAPS,2%IPG缓冲液,40mM DTT,40mM Tris-base)溶解样品。
蛋白质上样浓度不要超过10mg/ml(若浓度过高,可以加Lysis buffer稀释),否则会造成蛋白质的集聚或沉淀。
2)吸取适量(见表2.1)含有样品的水化液放入标准型胶条槽中,为确保样品充分进入胶条中,不要加入过量的水化液。
表2.1IPG胶条所需水化液体积
3)从酸性端(尖端)一侧剥去IPG胶条的保护膜,胶面朝下,先将IPG 胶条尖端(阳性端)朝标准型胶条槽的尖端方向放入胶条槽中(酸性端抵住胶条槽底端),慢慢下压胶条,并前后移动,避免生成气泡,最后放下IPG胶条平端(阴极),使水化液浸湿整个胶条,并确保胶条的两端与槽的两端的电极接触。
4)IPG胶条上覆盖适量(1.5mL)Immobiline DryStrip覆盖油(从两侧往中间加),盖上盖子。
5)将标准型胶条槽的尖端背面电极与IPGphor仪器的阳极平台接触;胶条槽的平端背面电极与IPGphor仪器的阴极平台接触(在此过程中,需用水平仪检查平台是否平衡,然后用两块白色条形板压在胶条槽上,最后盖上IPGphor的盖子)。
6)设置IPGphor仪器运行参数:IPG胶条水化的电压,温度和时间;等电聚焦电泳时的梯度电压和温度。
电泳参数见表2.2 。
表2.2:IPGphor运行条件
低电压时水化,有利于高分子量蛋白进入胶中,并减少蛋白形成聚集体。
7)IPG胶条水化后可自动进行等电聚焦电泳。
8)暂时不进行第二向的IPG胶条可夹在两层塑料薄膜中于-80°C保存几个月。
注意:不推荐每条IPG胶条的电流超过50μA,因为这有可能产生过多的热量且有可能损坏胶条和槽,IPG胶条甚至会烧胶。
附注:一向等电聚焦电泳需21-22h
2.IPG 胶条的平衡
IPG 胶条平衡两次,每次15min 。
平衡缓冲液包括6M 尿素和30%甘油,会减少电内渗,有利于蛋白从第一向到第二向的转移。
第一步平衡在平衡液中加入DTT ,使变性的非烷基化的蛋白处于还原状态;第二步平衡步骤中加入碘乙酰胺,使蛋白质巯烷基化,防止它们在电泳过程中重新氧化,碘乙酰胺并且能使残留的DTT 烷基化(银染过程中,DTT 会导致点拖尾"point streaking") 。
将IPG 胶条轻轻润洗,并去除多余的平衡缓冲液,然后放入第二向SDS 胶中。
注:如果缩短平衡时间,会影响一部分蛋白从IPG 胶条转移到SDS 胶的效率。
这种情况下建议在蛋白从 IPG 胶条转移到SDS 胶后,将IPG 胶条染色,以检查是否所有蛋白都已离开IPG 胶条。
(1)仪器:平衡管 (200 mm 长, 20 mm i.d.), Parafilm, 水平式摇床
(2)实验步骤:
1)使用前每10ml 平衡缓冲液中加入0.1g DTT (相当于平衡缓冲液I )
,
取出IPG胶条分别放入平衡管中(支持膜贴着管壁,每个平衡管中放入一条IPG胶条),用Parafilm封口,报纸盖上平衡管,避光,在水平式摇床上摇晃15分钟,倒掉平衡缓冲液I。
2)每10ml平衡缓冲液加入0.3g碘乙酰胺(相当于平衡缓冲液II)。
将IPG 胶条转移至平衡缓冲液II中,用Parafilm封口,报纸盖上平衡管,避光,在水平式摇床上摇晃15分钟。
(注:平衡缓冲液Ⅰ和Ⅱ用同一平衡管,即先用DDT平衡,缓缓地倒掉DDT,小心别把IPG胶条倒掉,再加入IAA进行平衡即可。
每根胶条一般需10ml平衡液,如若要平衡3根胶条,洗2个50ml离心管,分别称量0.1g×3=0.3g DDT和0.3×3=0.9gIAA,各加入30ml)。
附注:在胶条平衡未完之前,进行剥胶,用ddH2O冲洗胶板,去除板上碎胶,并加满ddH2O置于支架上,一段时间后,将ddH2O倒掉,用滤纸片吸干水分,并吸取加热后的琼脂糖密封液灌满胶板空隙。
3)IPG胶条的转移:用镊子取出IPG胶条,将胶条的支持面(即带字的面,不能是胶面)边缘置于滤纸上几秒钟,以去除多余的平衡缓冲液,并将胶条浸泡在2×SDS电泳缓冲液中数秒钟。
然后,将IPG胶条放在位于玻璃板之间的凝胶面上,使胶条支持面贴着其中的高板,用一薄尺将IPG胶条轻轻地向下推,使整个胶条下部边缘与板胶的上表面完全接触。
确保在IPG胶条与板胶之间以及玻璃板与塑料支持膜间无气泡产生。
4)最后往胶板空隙中补满琼脂糖密封液(温度不高于65℃),使IPG 胶条被完全覆盖住,在此过程中不要产生气泡,放置一会儿,直至凝
固。
附注:配置新鲜上槽液1.2L=480mL+ddH2O至终体积(将5×Laemmli SDS 电泳缓冲液稀释至2×,加水至),用1mL的量筒配置并存放(因为在转移IPG胶条之前,先得在缓冲液中浸泡数秒钟)倒入Ettan DALTsix 上槽中,下槽液为1×电泳缓冲液,可重复利用。
缩略词表:
IPG:immobilized[ɪ'mobɪ,laɪz] PH gradient。