等电聚焦电泳法测定蛋白质的等电点
- 格式:doc
- 大小:43.00 KB
- 文档页数:4

等电聚焦电泳测定血清蛋白质等电点【实验原理】等电聚焦电泳是利用具有pH梯度的两性电解质为载体,分离等电点(pI)不同的蛋白质等两性分子的电泳技术。
在IEF电泳系统中,具有一个从阳极到阴极,pH值逐渐增大的连续而稳定的pH梯度,处于此系统的各种蛋白质分子,将根据各自的pI值与所处位点的pH值的差别带上正电或负电。
当蛋白质分子向相反电极移动的过程中,其逐渐靠近与其DI相同的pH位点,直至到达pH=pI,净电荷为零而停止移动,从而达到聚焦。
因此,将pI不同的蛋白质混合物加入有pH梯度的凝胶介质中,在电场内经过一段时间后,各组分会分别聚焦在各自pI相应的pH位置上,形成分离的蛋白质区带。
根据电泳装置的不同,IEF可分为管型IEF和平板型IEF,本实验介绍管犁PAGE—IEF.【试剂与器材】1.凝胶贮备液称取丙烯酰胺(Acr)20g,甲叉双丙烯酰胺(Bis)0.8g,蒸馏水溶解后定容至100mL,过滤,将未溶物滤去,盛于棕色瓶中,4℃冰箱保存。
2.1%(V/V)TEMED溶液。
3.5g/L过硫酸铵称取过硫酸铵0.5g,溶于蒸馏水100mL,冰箱存放,每周新配。
4.40%两性电解质载体。
5.0.5mmol/L磷酸溶液量取85%磷酸16mL,加蒸馏水定容至500mL。
6.0.5mmol/L NaOH溶液称取NaOH10g,加蒸馏水溶解并定容至500mL。
7.1g/L考马斯亮蓝固定染色液称取考马斯亮蓝R250 lg,溶于含甲醇200mL、乙酸100mL和蒸馏水700mL的混合液中,过滤后备用。
8.酸性乙醇脱色液乙醇25份,蒸馏水25份,冰醋酸8份,混匀备用。
9.血清样本血清无须稀释,但最好透析去除离子。
10.电泳仪选用电子管或晶体管整流电源,电压0~600V,电流0~300mA。
11.电泳槽圆盘电泳槽及电泳玻管。
12.锥形瓶,250px长针头或腰椎穿刺针头,5mL或10mL注射器。
食品安全检测农药兽药残留土壤成分分析焦炭成分分析【操作步骤】1.凝胶制备取洁净干燥的电泳玻璃管2支,将管底用胶布封闭,垂直放置在电泳管架上。

等电点不是蛋白质的特征参数1. 引言等电点是指溶液中物质带正负电荷数相等时的pH值。
在生物化学中,等电点通常与蛋白质相关联,但是有趣的是,等电点并不是蛋白质的特征参数。
在这篇文章中,我们将从不同角度深入探讨等电点并非蛋白质特征参数的原因,并针对这一主题展开讨论。
2. 理论与概念等电点是一个重要的生物化学概念,通常用于描述溶液中带电物质的性质。
在蛋白质方面,等电点被认为是蛋白质的特征参数之一,但其实情况并非如此。
蛋白质的等电点是由其氨基酸残基的pKa值决定的,而不同类型的氨基酸残基之间的pKa值差异很大,因此蛋白质的等电点也会有较大的变化范围。
3. 等电点的测定通常情况下,可以通过实验方法来测定蛋白质的等电点,其中最常用的方法是等电聚焦电泳。
等电聚焦是一种高分辨率的电泳技术,可以根据蛋白质在不同pH值下的等电点进行分离和测定。
然而,需要注意的是,蛋白质的等电点是会受到溶液条件、离子强度和温度等因素的影响,因此等电点并不是一个固定不变的参数。
4. 等电点与蛋白质结构蛋白质的等电点与其分子结构有密切关系。
蛋白质分子中含有大量的氨基酸残基,这些残基在不同pH值下会带有正或负电荷,从而影响蛋白质的整体电荷状态。
然而,蛋白质的结构本身是复杂多样的,其空间构象、侧链性质和疏水性等因素都会对等电点产生影响。
5. 等电点的局限性尽管等电点在一定程度上可以反映蛋白质的电荷特性,但它并非是蛋白质的全部特征。
蛋白质的功能、结构稳定性、溶解性等特性都与其等电点有一定的关联,但不能仅凭等电点来全面评价蛋白质的性质。
等电点并非蛋白质的特征参数。
6. 个人观点对我而言,蛋白质是生物体内最重要的功能性分子之一,其复杂的结构和多样的功能使得其性质的评价非常复杂。
虽然等电点是一个重要的指标,但我们仍需结合蛋白质的其他特性来全面理解其功能和作用。
未来的研究需要更多关注蛋白质的多个特征参数,以期能更好地揭示其在生物体内的作用机制。
7. 总结与展望通过本文的探讨,我们深入了解了等电点并不是蛋白质的特征参数这一主题。

测定蛋白质等电点:了解分析原理与实验方法的必备指南蛋白质是生物体内功能多样的重要分子,其性质与溶液中的pH值密切相关。
了解蛋白质的等电点对于理解其溶解性、稳定性和相互作用至关重要。
测定蛋白质的等电点可以帮助科学家们更好地理解蛋白质的特性,并在药物研发和生物工程等领域中发挥重要作用。
一、蛋白质等电点的原理。
蛋白质的电荷性质:蛋白质分子在不同pH值下带有正负电荷,这是由于其天然氨基酸残基上的带电基团。
等电点的定义:等电点是蛋白质溶液中净电荷为零的pH值,即带正电荷的氨基酸残基和带负电荷的氨基酸残基在该pH值下几乎相等。
二、测定蛋白质等电点的方法。
等电聚焦电泳(IEF):利用电场将蛋白质在聚丙烯酰胺凝胶中分离,根据其在电场中迁移的速率确定等电点。
等电点电泳(IPG):使用具有梯度pH值的聚丙烯酰胺凝胶,将蛋白质根据等电点在凝胶中定位。
pH梯度电泳:通过在凝胶中创建pH值梯度,使蛋白质在凝胶中以等电点静止。
三、蛋白质等电点分析的应用和局限性。
蛋白质溶解性和稳定性研究:等电点可以指导蛋白质的溶解条件和稳定性的优化。
蛋白质相互作用研究:等电点的差异可以用于研究蛋白质与其他分子的相互作用。
方法局限性:测定蛋白质等电点需要考虑样品纯度、离子强度和其他实验条件的影响。
测定蛋白质的等电点是研究蛋白质溶解性、稳定性和相互作用的重要手段。
了解蛋白质等电点的原理和常用方法对于科学家们理解蛋白质特性具有重要意义。
然而,我们也要认识到测定蛋白质等电点的方法存在一定的局限性,需要综合考虑实验条件和样品特性。
随着技术的不断发展,蛋白质等电点分析将为药物研发和生物工程等领域的进展提供更多的指导。
图1。

实验三十五IEF电泳测定蛋白质等电点等电点(isoelectri。
point)是蛋白质的最重要理化性质之一,其定义是当蛋白质的酸性解离与碱性解离趋势相等,蛋白质分子的净电荷为零时,环境的pH。
当蛋白质分子的pI<环境pH时带正电荷向负极移动,pI>环境pH时带负电荷,向正极移动,处于等电点时的蛋白质在电场中既不向阳极移动,也不向阴极移动。
每一种蛋白质都有一个特定的等电点,测定蛋白质的等电点最为普遍采用的方法是等电聚焦(isoelectric focusing,IEF)电泳,IEF是60年代建立起来的一种蛋白质分离分析手段,其分辨率高,可达0.001pH单位,且操作方便、迅速,因此除用于蛋白质等电点测定外,也常被用于蛋白质纯度鉴定及分离制备蛋白质,是生物化学、分子生物学、遗传学等研究中的重要分离、分析方法。
实验原理等电点聚焦电泳的基本原理是通过在凝胶中加入载体两性电解质,使其在电场作用下,从阳极到阴极形成一个连续而稳定的线性pH梯度,其正极为酸性,负极为碱性,通常使用的载体两性电解质是脂肪族多氨基多羧酸化合物,其在电泳中形成的pH梯度范围有3~10,4~6,5~7,8~10等,蛋白质在IEF电泳时,当样品置于负极端时,因pH>pI,蛋白质分子带负电荷,电泳时向正极移动,在移动过程中,由于pH逐渐下降,蛋白质分子所带的负电荷逐渐减少,蛋白质分子移动的速度逐渐变慢,当移动到pH=pI时,蛋白质所带的净电荷为零,蛋白质即停止移动而聚焦成带。
当蛋白质置于正极时,也会获得同样的结果。
因此在进行IEF电泳时,样品可以置于任何位置。
由于各种不同蛋白质的氨基酸组成不同,因而有不同的等电点,在IEF电泳时,会分别聚焦于相应的等电点位置,形成一个很窄的区带。
在IEF电泳中蛋白质区带的位置是由电泳pH梯度的分布和蛋白质的pI所决定,而与蛋白质分子的大小及形状无关。
因此根据蛋白质区带在pH梯度中的位置便可测得该蛋白质的等电点。

等电点聚焦测蛋白质等电点一.实验目的1.了解蛋白质的两性解离性质和等电点聚焦的原理;2. 学习测定蛋白质等电点的方法并掌握圆盘电泳技术。
二.实验原理等电点聚焦(IEF)是在电场中分离蛋白质技术的一个重要发展,IEF实质就是在稳定的pH梯度中按等电点的不同分离两性大分子的平衡电泳方法。
在电场中充有两性载体和抗对流介质,当加上电场后,由于两性载体移动的结果,在两极之间逐步建立起稳定的pH梯度,当蛋白质分子或其它两性分子存在于这样的pH梯度中时,这种分子便会由于其表面电荷在此电场中运动,并最终到达一个使其表面静电荷为0的区带,这时的pH则是这种分子的pI。
聚焦在等电点的分子也会不断地扩散.一旦偏离其等电点后,由于pH环境的改变,分子又立即得到正电荷或负电荷,从而又向pI迁移。
因此,这些分子总是处于不断地扩散和抗扩散的平衡之中,在pI处得以“聚焦”。
三.实验步骤1.凝胶制备按表1的比例配制4ml工作胶液,在真空干燥器中抽气10min.每组4管,每管加胶液1。
8ml。
混匀后立即注入到已准备好的凝胶管中,胶液加至离管顶部1cm 处,在胶面上再覆盖3mm厚的水层,应注意不要让水破坏胶的表面,室温下放置20~30min即可聚合.表1 凝胶工作液配比2。
电泳吸去凝胶柱表面上的水层,将凝胶管垂直固定于圆盘电泳槽中。
于电泳槽下槽加入0。
2%的500ml 硫酸作正极;上槽加入0。
5%的800ml 乙醇胺作负极打开电源,将电压恒定为300V,因为聚焦过程是电阻不断加大的过程,故聚焦电泳过程中,电流将不断下降,降至稳定时,即表明聚焦已完成,继续电泳约30min 后,停止电泳,全程约需3h 。
3。
剥胶电泳结束后,取下凝胶管,用水洗去胶管两端的电极液,按照柱状电泳剥胶的方法取出胶条,以胶条的正极为“头”,负极为“尾”,正极端呈酸性,负极端呈碱性.剥离后,量出并记录凝胶的长度。
4.固定取其中的凝胶条3根置于一个小培养皿内,倒入10%放在三氯乙酸固定液中固定,约半小时后,即可看到胶条内蛋白质的白色沉淀带。

蛋白质等电点的测定实验报告一、实验目的1、了解蛋白质等电点的概念及其重要性。
2、掌握测定蛋白质等电点的基本原理和方法。
3、学会使用酸度计等仪器进行实验操作。
二、实验原理蛋白质是两性电解质,在溶液中会发生解离。
当蛋白质溶液处于某一 pH 值时,蛋白质解离成正、负离子的趋势相等,即净电荷为零,此时溶液的 pH 值称为该蛋白质的等电点(pI)。
在等电点时,蛋白质的溶解度最低,容易沉淀析出。
利用这一性质,可以通过调节溶液的 pH 值,使蛋白质沉淀,从而测定蛋白质的等电点。
本实验采用醋酸纤维素薄膜电泳法来测定蛋白质的等电点。
醋酸纤维素薄膜具有均一的微孔结构,对蛋白质分子的吸附作用小,电泳时泳动速度快,分辨率高。
在一定的电场强度下,不同 pH 值的缓冲溶液中,蛋白质分子会向与其所带电荷相反的电极方向移动。
当溶液的 pH值等于蛋白质的等电点时,蛋白质分子的净电荷为零,泳动速度为零。
三、实验材料与仪器1、材料新鲜鸡蛋醋酸纤维素薄膜巴比妥缓冲液(pH 86、pH 74、pH 64、pH 54)蛋白质染色液(氨基黑 10B)漂洗液2、仪器电泳仪酸度计培养皿镊子剪刀直尺四、实验步骤1、醋酸纤维素薄膜的处理将醋酸纤维素薄膜剪成 2×8cm 的小条,在巴比妥缓冲液(pH 86)中浸泡 30 分钟,使其充分浸透。
用镊子取出薄膜,用滤纸吸干多余的缓冲液。
2、点样用毛细管吸取少量鸡蛋清样品,在薄膜的无光泽面距一端 15cm 处轻轻点样,点样宽度不超过 05cm。
3、电泳将点样后的薄膜光滑面朝下,搭在电泳槽的支架上,两端分别与电泳槽的正、负极相连。
在电泳槽中加入巴比妥缓冲液(pH 86),使薄膜完全浸没在缓冲液中。
接通电源,调节电压为 160V,电泳 40 分钟。
4、染色与漂洗电泳结束后,将薄膜取出,放入氨基黑 10B 染色液中染色 10 分钟。
取出薄膜,放入漂洗液中漂洗数次,直至背景无色,蛋白质条带清晰可见。
5、测定 pH 值分别配制 pH 74、pH 64、pH 54 的巴比妥缓冲液。

蛋白质等电点的测定蛋白质是生命体内构成最广泛的一类生物大分子,具有各种生物功能。
在生物体内,蛋白质具有正负电荷,并在不同PH值的溶液中表现出不同的电性质。
蛋白质在pH等于其等电点时,蛋白质的电荷处于中性状态,亦是纯蛋白质最稳定的情况,因此准确测定蛋白质等电点对于分离、纯化和鉴定蛋白质具有重要意义。
本文中将介绍三种测定蛋白质等电点的方法。
方法1. 等电点电泳法等电点电泳法是一种电泳分离方法,利用蛋白质在不同pH值下的电荷变化探测其等电点。
该方法的原理为将蛋白质经过电泳分离,直到电泳缓冲液pH等于蛋白质的等电点,此时蛋白质处于中性带中心。
与常规电泳仪不同的是,该仪器在酸性电极和碱性电极之间加入溶液,以确保酸碱缓冲系统能够维持所需的pH值。
等电点电泳法可以快速而准确地测定蛋白质等电点,但需要特殊仪器和耗时较长,且样品纯度较高。
方法2. 等电聚焦法等电聚焦法是一种电泳技术,利用在连续的pH梯度中,使具有等电点的蛋白质依次停止迁移,从而分离蛋白质。
该方法的原理是,利用蛋白质在不同pH值下的等电点特性,将样品置于pH梯度中,通过电压控制,使蛋白质在等电点处停止迁移,从而实现蛋白质分离。
等电聚焦法具有高分辨率和高分离效率,同时还可以同时分离出等电点相似但分子量不同的蛋白质,但样品量较小,需要特殊仪器和大量控制。
方法3. pH梯度管柱法pH梯度管柱法是一种可溶性蛋白质的标准测定方法,也是等电点法中最广泛应用的方法之一。
该方法的基本原理是,在含有不同pH值的缓冲液梯度的柱子上,蛋白质会在不同的pH值时呈现出不同的电荷状态。
在pH值等于其等电点时,蛋白质处于中性状态,停止迁移。
通过检测蛋白质在不同pH值下的吸收值,可以确定样品的等电点。
pH梯度管柱法的优点包括样品量较大,操作简单,数据可靠,但分辨率较低,需要特殊的柱子。
三种测定蛋白质等电点的方法各有侧重,实验操作难度大小也不同,一般来说,选择合适的测定方法应根据样品特点和实验条件。

等电聚焦电泳的原理和应用1. 原理等电聚焦电泳是一种基于蛋白质等电点(pI)差异的分析方法。
在等电聚焦电泳中,蛋白质被置于一个电荷梯度进行分离,直到达到其等电点时停止运动。
原理可分为以下几个步骤:1.1 准备电荷梯度电荷梯度是等电聚焦电泳中的关键。
通常使用聚丙烯酰胺凝胶,其中有两个极性的电解质进行稀释,创建一个pH梯度。
这个梯度会在凝胶中生成氢离子(H+)和氢氧根离子(OH-)。
1.2 样品加载样品通常会混合在一种称为“载体溶胶”的缓冲液中,以保持样品的pH稳定。
这些样品会在载体溶胶上浮,准备好进行电泳分离。
1.3 离子迁移一旦样品加载完成,电泳过程就开始了。
在电场的作用下,蛋白质在电荷梯度中迁移。
1.4 等电点停止当蛋白质在凝胶中达到其等电点时,它们的净电荷为零,停止迁移。
等电点是蛋白质的理论中性点。
2. 应用等电聚焦电泳在生物医学和生物化学研究中具有广泛的应用。
以下是一些应用示例:2.1 蛋白质分离和纯化等电聚焦电泳常用于蛋白质的分离和纯化。
通过优化电荷梯度和其他实验条件,可以实现对复杂样品的高分辨率分离。
这种方法对于深入了解蛋白质的结构和功能非常有帮助。
2.2 蛋白质组学研究等电聚焦电泳在蛋白质组学研究中发挥重要作用。
通过等电聚焦电泳,可以分析和比较不同样品中蛋白质的表达水平。
这对于研究疾病相关蛋白质的变化以及寻找生物标志物非常重要。
2.3 药物分析等电聚焦电泳在药物分析中也有应用。
它可以用来研究药物-蛋白质相互作用和药物的释放动力学。
这对于药物的开发和优化具有重要意义。
2.4 食品分析等电聚焦电泳在食品分析中也得到了广泛应用。
它可以用来检测食品中的蛋白质含量和质量,包括检测过敏原和添加剂。
这对于食品质量和安全性的监测非常重要。
3. 结论等电聚焦电泳是一种基于蛋白质等电点差异的分析方法。
它在分离和纯化蛋白质、蛋白质组学研究、药物分析和食品分析等领域都有广泛的应用。
这种方法具有高分辨率和灵敏度,对于研究生物分子在不同条件下的特性具有重要意义。

蛋白质两性性质及等电点的测定蛋白质是生物体中极其重要的有机化合物,是构成生物体的基本组成部分之一。
蛋白质具有很多种类和功能,不同的蛋白质在生物体内发挥着不同的作用。
蛋白质的性质也因其结构而异,其中包括两性性质和等电点。
本文将介绍蛋白质的两性性质及等电点的测定。
一、蛋白质的两性性质蛋白质是由多肽链组成的,其分子中含有氨基酸残基。
这些氨基酸残基中的羧基(-COOH)和氨基(-NH2)可以参与酸碱反应,所以蛋白质具有两性性质,能够在不同的pH值下呈现不同的电离状态。
1. 在低pH值下,蛋白质中的羧基处于质子化状态,成为正电荷,而氨基则不受质子化,保持中性。
因此,在低pH值时,蛋白质呈正电荷状态,称为阳离子。
2. 在高pH值下,蛋白质中的氨基受到氢离子的质子化,成为正电荷,而羧基则不受质子化,保持中性。
因此,在高pH值时,蛋白质呈负电荷状态,称为阴离子。
3. 在等电点附近,蛋白质的质子化和去质子化同时发生,羧基和氨基的质子化程度相等,呈中性状态。
此时,蛋白质没有净电荷,称为等电点。
由于蛋白质的两性性质,可以影响其溶解性、折叠构象和相互作用等特性,对其功能和生物学作用具有重要影响。
二、蛋白质等电点的测定等电点是蛋白质具有中性状态的pH值。
测定蛋白质的等电点可以帮助我们了解其溶解性、电动力学性质和酸碱加工过程中的变化。
常用的测定等电点的方法有以下几种:1. pH梯度电泳法:这是一种常用且广泛应用的测定等电点的方法。
在一个pH梯度上进行电泳,当蛋白质离子迁移速率和电场力相等时,达到等电点。
可以通过在梯度上观察蛋白质带的形成和移动情况来确定等电点。
2. 等电聚焦电泳法:这是一种利用电场作用下蛋白质在凝胶上垂直移动的方法,根据蛋白质在凝胶中的移动速率和电场力相等时的pH值来测定等电点。
3. 等电点电位计法:该方法利用等电点时蛋白质没有净电荷的特性,使用电位计测量蛋白质在不同pH值下的电位变化,找出没有净电荷时的pH值,即为等电点。
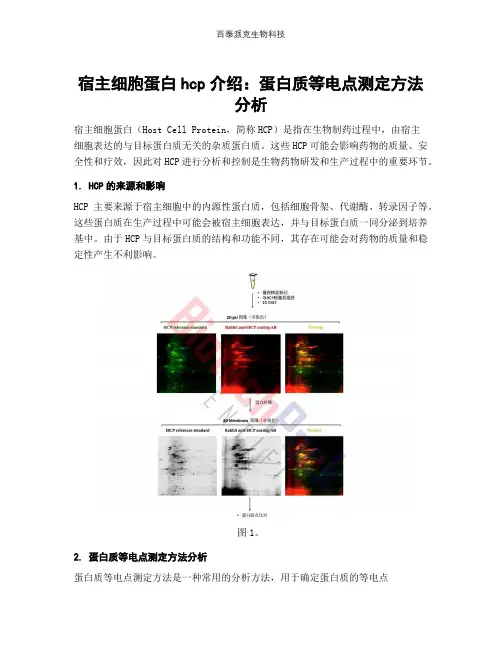
宿主细胞蛋白hcp介绍:蛋白质等电点测定方法分析宿主细胞蛋白(Host Cell Protein,简称HCP)是指在生物制药过程中,由宿主细胞表达的与目标蛋白质无关的杂质蛋白质。
这些HCP可能会影响药物的质量、安全性和疗效,因此对HCP进行分析和控制是生物药物研发和生产过程中的重要环节。
1. HCP的来源和影响HCP主要来源于宿主细胞中的内源性蛋白质,包括细胞骨架、代谢酶、转录因子等。
这些蛋白质在生产过程中可能会被宿主细胞表达,并与目标蛋白质一同分泌到培养基中。
由于HCP与目标蛋白质的结构和功能不同,其存在可能会对药物的质量和稳定性产生不利影响。
图1。
2. 蛋白质等电点测定方法分析蛋白质等电点测定方法是一种常用的分析方法,用于确定蛋白质的等电点(Isoelectric Point,简称pI)。
蛋白质的等电点是指在特定条件下,蛋白质带有净电荷的pH值。
通过测定蛋白质的等电点,可以帮助我们了解蛋白质的电荷性质,从而更好地进行HCP的分析和控制。
3. 蛋白质等电点测定方法图 2。
目前常用的蛋白质等电点测定方法包括等电聚焦电泳(Isoelectric Focusing,简称IEF)和等电点电位测定法(Isoelectric Point Electrophoresis,简称IEP)。
这两种方法都是基于蛋白质在不同pH值下的电荷性质进行分析。
3.1 等电聚焦电泳(IEF)。
等电聚焦电泳是一种基于蛋白质在电场中的迁移速率与其净电荷量之间的关系进行分析的方法。
在等电聚焦电泳中,蛋白质样品被加载到一个具有梯度pH值的凝胶中,然后通过电场进行分离。
在特定的pH值下,蛋白质的净电荷为零,停留在相应的位置,形成等电点聚焦带。
通过观察等电点聚焦带的位置,可以确定蛋白质的等电点。
3.2 等电点电位测定法(IEP)。
等电点电位测定法是一种通过测定蛋白质在不同pH值下的电位变化来确定其等电点的方法。
在等电点电位测定中,蛋白质样品被溶解在缓冲液中,然后通过改变缓冲液的pH值,测定蛋白质溶液的电位变化。

聚丙烯酰胺凝胶平板等电聚焦电泳测定蛋白质等电点一、目的:学习聚丙烯酰胺凝胶平板等电聚焦电泳测定蛋白质等电点的原理及方法。
二、原理:等电点聚焦(isoelectric focusing, IEF)或简称电聚焦(electrof ocusing),也曾称等电点分离聚焦电泳等。
它是60年代中期出现的技术,克服了一般电泳易扩散的缺点。
近年来,等电点聚焦电泳又有了新的进展,可以分辨等电点只差0.001pH单位的生物分子。
由于它的分辨力高、重复性好、样品容量大、操作简便、迅速,在生物化学、分类学、分子生物学及临床医学研究等诸方面,都得到广泛应用。
等电点聚焦电泳产生pH 梯度的方法有两种:一是用两种不同的pH缓冲液相互扩散,在混合区形成pH梯度,此为人工pH梯度。
这种pH梯度不稳定,常用于制备电泳;另一种是利用载体两性电解质在电场作用下形成自然pH梯度。
本实验就是利用载体两性电解质形成的自然pH梯度进行蛋白质样品等电焦聚电泳的。
理想的载体两性电解质应该在其本身的等电点处有足够的缓冲能力和良好的导电性,且分子量要小,组成与被分析样品有所区别,对分析样品无变性作用或发生化学反应。
常用的载体两性电解质是一系列脂肪族多氨基和多羧基类的混合物,即是一系列的异构物和同系物,分子量在300—1000之间,各组分的等电点(pI)既有差异又相接近,pI的范围在2.5—11之间。
合成载体两性电解质的原料是丙烯酸和多乙烯多胺,合成反应如下:R1 和R2为氢或带有氨基的脂肪基。
这一反应的特点是生成众多的异构物和同系物的混合物,而不是均一的化合物。
混合物中各成分的含量、等电点的分布,取决于原材料的性质、比例和合成条件。
目前常用的载体两性电解质的商品有:Ampholine(LKB公司)、Pharmlyte(Phar macia公司)、 Serralyty(Serva公司),近来已有国产商品了。
不同厂家合成的方法不同,电泳的条件也略有不同。
等电点常用的检测方法等电点是指在溶液或介质中,正负离子的浓度相等时的pH值。
在生物学研究中,等电点被广泛应用于蛋白质、细胞膜和DNA等生物大分子的研究中。
为了准确测定分子的等电点,科学家们开发了许多检测方法。
以下是一些常用的等电点检测方法。
1. 等电聚焦电泳法等电聚焦电泳法是一种基于电荷的分离技术,它使用特定的缓冲液体系和电场梯度,将混合的蛋白质在等电点处停留并分离。
这种方法通常用于检测蛋白质的等电点,其优点是操作简单、分离效果好、分离时间短。
2. 等电点电位仪法等电点电位仪法是一种基于电位的检测方法,它利用电位计测量溶液中蛋白质的等电点。
这种方法适用于检测高分子的等电点,如DNA和RNA等,它的优点是精度高、可靠性好。
3. 等电点扫描仪法等电点扫描仪法是一种基于光学的检测方法,它使用可见光和紫外线光谱技术,测量溶液中分子的吸收率和发射率,以确定分子的等电点。
这种方法适用于检测各种高分子的等电点,如蛋白质、DNA 和RNA等,其优点是准确度高、分析速度快。
4. 等电点显色法等电点显色法是一种基于化学反应的检测方法,它利用荧光染料和酸碱指示剂的颜色变化来测定分子的等电点。
这种方法适用于检测各种高分子的等电点,如蛋白质、DNA和RNA等,其优点是灵敏度高、测定精度高。
5. 等电点测定仪法等电点测定仪法是一种基于电泳和电学检测的方法,它利用电场和电荷的作用,将混合的分子在等电点处分离并检测。
这种方法适用于检测各种高分子的等电点,如蛋白质、DNA和RNA等,其优点是测定精度高、分离效果好。
以上这些方法都是常用的等电点检测方法,在生物学研究中都有广泛的应用。
不同的方法各有优缺点,选择适合自己研究的方法进行等电点检测,对于研究结果的准确性和科学价值都有着重要的意义。
1. 了解等电聚焦电泳(IEF)的基本原理和操作步骤。
2. 学习利用等电聚焦电泳技术测定蛋白质的等电点(pI)。
3. 掌握实验操作技能,提高实验动手能力。
二、实验原理等电聚焦电泳(IEF)是一种利用pH梯度介质分离等电点不同的蛋白质的电泳技术。
其基本原理是在一个具有pH梯度的介质中,蛋白质分子根据其等电点在电场作用下向相应pH位置移动,直至聚焦于该位置。
蛋白质分子是两性电解质,其等电点(pI)是指蛋白质分子在溶液中呈电中性时的pH值。
在pH低于蛋白质的pI时,蛋白质分子带正电荷;在pH高于蛋白质的pI 时,蛋白质分子带负电荷。
在等电聚焦电泳过程中,当蛋白质分子移动到与其pI相等的pH位置时,其净电荷为零,停止移动,从而实现蛋白质的分离和聚焦。
三、实验仪器与试剂1. 仪器:毛细管电泳仪、恒温水浴、pH计、移液器、超纯水系统等。
2. 试剂:蛋白质样品、两性电解质载体、尿素、磷酸、氢氧化钠、乙酸等。
四、实验步骤1. 准备样品:取适量蛋白质样品,加入适量两性电解质载体,制成蛋白质溶液。
2. 制备pH梯度:根据蛋白质的pI值,配制相应的pH梯度介质,置于毛细管中。
3. 样品上样:将制备好的蛋白质溶液加入毛细管中,注意避免气泡产生。
4. 设置参数:根据仪器要求,设置电泳电压、温度、时间等参数。
5. 运行实验:开启毛细管电泳仪,开始电泳实验。
6. 数据采集:实验结束后,采集数据,分析蛋白质的等电点。
五、结果与分析1. 根据实验数据,绘制蛋白质的迁移曲线,分析其等电点。
2. 与理论值进行比较,评估实验结果的准确性。
1. 等电聚焦电泳是一种有效的蛋白质分离和鉴定技术,具有分辨率高、操作简便等优点。
2. 通过本次实验,掌握了等电聚焦电泳的操作步骤,提高了实验动手能力。
3. 在实验过程中,需要注意以下几点:a. 精确配制pH梯度介质,确保pH梯度均匀。
b. 避免气泡产生,影响实验结果。
c. 严格控制实验参数,确保实验结果的准确性。
蛋白质的等电点名词解释蛋白质是构成细胞的基本成分之一,也是生命体内最重要的分子之一。
它们扮演着许多重要的角色,包括参与代谢过程、传递信号、构建身体组织等。
而蛋白质的等电点则是一个关键的概念,它与蛋白质的电荷性质以及溶液中的pH值紧密相关。
等电点指的是蛋白质在溶液中呈中性的pH值,也就是说,在等电点时,蛋白质具有零净电荷。
通常情况下,蛋白质的分子结构中存在许多氨基酸残基,这些残基中的一部分带有电荷。
氨基酸分子中的羧基(COOH)和氨基(NH2)在水溶液中可以离解成带负电荷的羧酸根离子(COO-)和带正电荷的氨基离子(NH3+)。
正负电荷的存在使得蛋白质分子在水溶液中具有净电荷,这会影响其在溶液中的行为和性质。
当蛋白质的净电荷为零时,称之为等电点。
此时,蛋白质的总正电荷与总负电荷相等。
这意味着在等电点时,蛋白质不带电荷,它的溶解度也会受到影响。
由于电荷的中性化,蛋白质在溶液中会变得较为稳定,从而降低了聚集和析出的倾向。
要了解蛋白质的等电点,首先需要了解氨基酸的性质。
氨基酸是构成蛋白质的基本单元,它们的结构中包含着氨基(NH2)和羧基(COOH)。
这些基团在水溶液中可以接受或者释放质子(即H+离子),从而导致氨基酸带有正电荷或负电荷。
当pH值低于氨基酸的等电点时,氨基酸会失去质子并呈现正电荷;当pH值高于氨基酸的等电点时,氨基酸会接受质子并呈现负电荷。
蛋白质的等电点可以通过计算氨基酸的pKa值来确定。
pKa值是指蛋白质中的一个氨基酸分子失去或者接受质子时的离解常数的负对数。
当溶液的pH值等于某个氨基酸的pKa值时,该氨基酸的离子化程度为50%。
因此,计算蛋白质的等电点就是要找出使得整个蛋白质分子中带正电荷和负电荷的氨基酸离子数量相等的pH值。
蛋白质的等电点对于其结构和功能的研究具有重要意义。
它可以用于预测蛋白质在不同的pH值下的溶解度和电荷,进而了解其在不同条件下的稳定性和活性。
此外,等电点还能用于蛋白质的电泳分离和纯化。
蛋白质的等电点是蛋白质的特征常数蛋白质是生物体中最基本的组成部分之一,它们在维持生命活动中起着至关重要的作用。
而蛋白质的等电点则是蛋白质分子上带电离子数量相等的pH值,也被称为蛋白质的等电点pI。
蛋白质由氨基酸组成,而氨基酸分子上具有两种性质的基团:氨基基团(NH2)和羧基团(COOH)。
在不同的pH条件下,氨基酸分子上的这两种基团会发生离子化反应,从而使蛋白质带有正电荷或负电荷。
蛋白质的等电点是指在特定条件下,蛋白质分子上带正电荷和负电荷数量相等的pH值。
在等电点附近的pH值下,蛋白质的净电荷接近零,因此蛋白质在这个pH值下呈现中性状态。
蛋白质的等电点可以通过一些实验方法来确定,例如等电聚焦电泳。
在等电聚焦电泳中,将蛋白质样品置于一个聚丙烯酰胺凝胶上,然后通过改变电场强度和pH值,使蛋白质在凝胶中移动。
当蛋白质达到等电点时,它将停止移动,因为在该pH值下净电荷为零。
蛋白质的等电点对于其物理化学性质和生物学功能都具有重要影响。
在蛋白质溶液中,当pH值低于等电点时,蛋白质带正电荷,容易与带负电荷的物质发生相互作用;当pH值高于等电点时,蛋白质带负电荷,容易与带正电荷的物质发生相互作用。
这种相互作用可以影响蛋白质的溶解性、稳定性和功能。
蛋白质的等电点还可以用于蛋白质的纯化和分离。
在等电点附近的pH值下,蛋白质净电荷接近零,容易与其他带电离子的物质分离。
因此,可以利用等电点来纯化蛋白质样品。
蛋白质的等电点是蛋白质的特征常数,它反映了蛋白质分子上带正电荷和负电荷数量相等的pH值。
了解蛋白质的等电点有助于我们理解蛋白质的物理化学性质和生物学功能,并可以用于蛋白质的纯化和分离。
检测蛋白质等电点的方法
以下是 8 条关于检测蛋白质等电点的方法:
1. 电泳法呀,哇哦,就像让蛋白质们来一场赛跑!比如在凝胶上,不同的蛋白质会根据它们的电荷特性以不同速度前进,是不是很神奇呀?
2. 盐析法呢,就好像把蛋白质放在一个特殊的“筛子”里,随着盐浓度的变化,能看出它们的沉淀情况,这可是个很妙的方法哟!比如说鸡蛋清遇到盐会发生的变化。
3. 等电聚焦法,嘿,想象一下蛋白质顺着电势梯度找到自己的“专属位置”,多有意思呀!像在专门为它们打造的小天地里各就各位。
4. pH 滴定法,这就像是精确地调整酸碱度来引出蛋白质的神秘反应呀!比如慢慢地滴加酸碱看看会发生什么。
5. 分光光度法,哇塞,通过光的变化来洞察蛋白质的秘密,多酷啊!就像是用光线当钥匙打开蛋白质秘密的大门。
6. 超滤法呢,也好有趣呀,把蛋白质和其他东西分离开,就像在一个大混合物里精准地捞出我们想要的,你说好玩不?就拿混合溶液来试试呀。
7. 离子交换层析法,嘿,这就如同让蛋白质在离子的世界里穿梭筛选,找出它们的归宿,是不是很特别呢!就像在一个离子构建的迷宫里探索。
8. 透析法,哇哦,让蛋白质在膜的两边来回穿梭,想想就很刺激呀!就如同让它们玩一场特殊的“穿越游戏”。
我觉得每一种方法都有其独特之处和魅力呀,关键是能帮助我们更好地了解蛋白质的性质呢!。
北京来亨科学仪器有限公司销售中心:北京丰台区丰北路甲45号鼎恒中心6A1等电聚焦电泳测定蛋白质的等电点一、实验原理蛋白质是两性电解质,当Ph>PI 时带负电荷,在电场作用下向正极移动;当PH<PI 时带正电荷,在电场作用下向负极移动;当pH=PI 时净电荷为零,在电场作用下既不向正极也不向负极移动,此时Ph 就是该蛋白质的等电点。
各种PH 蛋白质的PI 不同,利用各种蛋白质PI 不同,以聚丙烯酰胺凝胶为电泳支持物,并在其中加入两性电解质载体,两性电解质载体在电场作用下,按各自PI 形成从阳极到阴极逐渐增加的平滑和连续的PH 梯度。
北京来亨科学仪器有限公司销售中心:北京丰台区丰北路甲45号鼎恒中心6A 2在电场作用下,蛋白质在此PH梯度凝胶中泳动,当迁移到PH值等于PI处时,就不再泳动,而被浓缩成狭窄的区带,这种分离蛋白质的方法称为聚丙烯酰胺等电聚焦电泳。
聚丙烯酰胺等电聚焦电泳操作简单,电泳时间短,分辨率高。
其应用范围广,可用于分离蛋白质及测定PI,也可用于临床鉴别诊断、农业、食品研究及动物分类等各种领域。
随着其他技术的不断改进,等电聚焦电泳也不断充实完善,从柱电泳发展到垂直板,又继而发展到超薄型水平板电泳等,还可与其他技术或SDS-PAGE结合,进一步提高灵敏度与分辨率。
二、实验用品(一)器材(1)垂直管电泳槽和玻管。
(2)恒压恒流电泳仪。
(3)酸度计(二)试剂(1)凝胶贮液:丙烯酰胺30g,甲叉双丙烯酰胺0.8g,加重蒸水使其溶解后定容至100ml,置棕色试剂瓶中,4℃贮存。
(2)10%TEMED:取10mlTEMED,加重蒸水至100ml,置棕色瓶内,4℃贮存。
(3)5%过硫酸胺:称AP1.0g,加重蒸水至10ml,当天配制。
(4)电极缓冲液。
5%磷酸溶液:量取58.8ml85%磷酸,定容至1000ml。
2%NaOH溶液:称20gNaOH,溶于蒸馏水并定容至1000ml。
北京来亨科学仪器有限公司销售中心:北京丰台区丰北路甲45号鼎恒中心6A 3(5)两性电解质载体PH3~10。
实验三等电聚焦电泳法测定蛋白质的等电点
一、实验目的
了解等电聚焦的原理。
通过蛋白质等电点的测定,掌握聚丙烯酰胺凝胶垂直管式等电聚焦电泳技术。
二、实验原理
等电聚焦(Isoelectric focusing,简称IEF)是六十年代中期出现的新技术。
近年来等电聚焦技术有了新的进展,已迅速发展成为一门成熟的近代生化实验技术。
目前等电聚焦技术已可以分辨等电点(pI)只差0.001pH单位的生物分子。
由于其分辨力高,重复性好,样品容量大,操作简便迅速,在生物化学、分子生物学及临床医学研究中得到广泛的应用。
蛋白质分子是典型的两性电解质分子。
它在大于其等电点的pH环境中解离成带负电荷的阴离子,向电场的正极泳动,在小于其等电点的pH环境中解离成带正由荷的阳离子,向电场的负极泳动。
这种泳动只有在等于其等电点的pH环境中,即蛋白质所带的净电荷为零时才能停止。
如果在一个有pH梯度的环境中,对各种不同等电点的蛋白质混合样品进行电泳,则在电场作用下,不管这些蛋白质分子的原始分布如何,各种蛋白质分子将按照它们各自的等电点大小在pH梯度中相对应的位置处进行聚焦,经过一定时间的电泳以后,不同等电点的蛋白质分子便分别聚焦于不同的位置。
这种按等电点的大小,生物分子在pH梯度的某一相应位置上进行聚焦的行为就称为“等电聚焦”。
等电聚焦的特点就在于它利用了一种称为两性电解质载体的物质在电场中构成连续的pH梯度,使蛋白质或其他具有两性电解质性质的样品进行聚焦,从而达到分离、测定和鉴定的目的。
两性电解质载体,实际上是许多异构和同系物的混合物,它们是一系列多羧基多氨基脂肪族化合物,分子量在300~1000之间。
常用的进口两性电解质为瑞典Pharmacia-LKB公司生产的Ampholine 和Pharmalyte,价格昂贵。
国产的有中国军事医学科学院放射医学研究所和上海生化所生产的两性电解质,价格便宜,质量尚佳。
两性电解质在直流电场的作用下,能形成一个从正极到负极的pH值逐渐升高的平滑连续的pH梯度。
若不同的pH值的两性电解质的含量与pI值的分布越均匀,则pH梯度的线性就越好。
对Ampholine两性电解质的要求是缓冲能力强,有良好的导电性,分子量要小,不干扰被分析的样品等。
在聚焦过程中和聚焦结束取消了外加电场后,如保持pH梯度的稳定是极为重要的。
为了防止扩散,稳定pH梯度,就必须加入一种抗对流和扩散的支持介质,最常用的这种支持介质就是聚丙烯酰胺凝胶。
当进行聚丙烯酰胺凝胶等电聚焦电泳时,凝胶柱内即产生pH梯度,当蛋白质样品电泳到凝胶柱内某一部位,而此部位的pH值正好等于该蛋白质的等电点时,该蛋白质即聚焦形成一条区带,只要测出此区带所处部位的pH值,即为其等电点。
电泳时间越长,蛋白质聚焦的区带就越集中,越狭窄,因而提高了分辨率。
这是等电聚焦的一大优点,不像一般的其他电泳,电泳时间过长则区带扩散。
所以等电聚焦电泳法不仅可以测定等电点,而且能将不同等电点的混合的生物大分子进行分185
离和鉴定。
早期的等电聚焦电泳是垂直管式的,其特点是体系是封闭的,不与空气接触,可防止样品氧化。
近年来,又发展了超薄层水平板式等电聚焦电泳。
此法的优点是加样数量多,节省两性电解质,电泳后固定、染色、干燥都十分迅速简便,其最大优点是防止了电极液的电渗作用而引起正负两极pH梯度的漂变。
测定pH梯度的方法有四种:
1. 将胶条切成小块,用水浸泡后,用精密pH试纸或进口的细长pH复合电极测定pH值,然后作图。
2. 用表面pH微电极直接测定胶条各部分的pH值,然后作图。
3. 用一套已知不同的pI值的蛋白质作为标准,测定pH梯度的标准曲线。
4. 将胶条于-70℃冰冻后切成1mm的薄片,加入0.5ml 0.01M KCl,用微电极
测其pH。
三、仪器和用具
1. 电泳仪
2. 垂直管式园盘电泳槽一套
3. 注射器与针头
4. 移液管:10ml、5ml、2ml、1ml、0.1ml
5. 小烧杯若干
6. 培养皿一套
7. 直尺
8. 小刀
9. 精密pH试纸和带细长复合pH电极的pH计
10. 塑料薄膜和橡皮筋
四、试剂
1. 丙烯酰胺
2. 甲叉双丙烯酰胺
3. 两性电解质Ampholine(40%,pH3.5~9.5)
4. 过硫酸胺(催化剂)
5. TEMED(四甲基乙二胺)(加速剂)
6. 磷酸
7. NaOH
8. 三氯乙酸(TCA)
五、溶液配制
1. 丙烯酰胺贮液(30%丙烯酰胺,交联度
2.6%):,30g丙烯酰胺和0.8g甲叉双丙烯酰胺溶于H2O,定容至100ml,滤去不溶物后存于棕色瓶,4℃可保存数月。
(全班公用)(另一配方为29.1g 丙烯酰胺和0.9g 甲叉双丙烯酰胺溶于H2O,定容至100ml,交联度为
3.0%)。
2. 两性电解质Amphline(40%)的加入量为:50 l /ml 胶液。
3. 过硫酸胺:配成1mg/ml的浓度,当天配制,配100ml全班公用。
胶液中的加入
185
185 量为0.5mg/ml 胶液。
4. TEMED :胶液中的加入量为1μl/ml 胶液。
5. 蛋白质样品:选用两种等电点相差较大的蛋白质,每根垂直管中每种蛋白质的加样量控制在<100μg 。
蛋白质样品配制成各为5mg/ml 的浓度。
配2.5ml 全班公用。
6. 固定液:10%的三氯乙酸,每组配50ml 。
7. 阳极电极液:0.1M H 3PO 4
3.4ml 浓磷酸(85%)加H 2O 至500ml ,每个电泳槽用500ml 。
8. 阴极电极液:0.5M NaOH
2g NaOH 加H 2O 溶解至500ml ,每个电泳槽用500ml 。
六、操作步骤
1. 配胶
过硫酸铵是胶聚合的催化剂,因此最后加入,加毕,立即摇匀,因胶很快就会聚合,必须立即装管。
通常化学聚合的胶液,需在过硫酸铵加入前进行减压抽气处理,本实验将此抽气步骤省略并不影响实验结果。
2. 装管
每个学生装两支管,每组装四支。
先用肥皂洗手,然后将圆盘电泳槽的玻璃管洗净,底端用塑料薄膜和橡皮筋封口,垂直放在试管架上,用移液管将配好的胶液移入管内,(每根玻璃管的容量约为1.5~1.8ml ),液面加至距管口1mm 处,用注射器轻轻加入少许
%
100⨯⨯=
胶液总体积
贮液加入量
丙烯酰胺贮液浓度胶浓度T %
100⨯+=
b
a b
C 甲叉双丙烯酰胺的量胶液中丙烯酰胺的量的量胶液中甲叉双丙烯酰胺交联度%
6.2%1008
.0308
.0=⨯+=
C 交联度
185
H 2O ,进行水封,以消除弯月面使胶柱顶端平坦。
胶管垂直聚合约30分钟,聚合完成时可观察到水封下的折光面。
3. 装槽和电泳
用滤纸条吸去胶管上端的水封,除去下端的薄膜,水封端向上,将胶管垂直插入圆盘电泳槽内,调节好各管的高度,记下管号。
每支管约1/3在上槽,2/3在下槽。
上槽加入500ml 0.1M H 3PO 4,下槽加入500ml 0.1M NaOH ,淹没各管口和电极,用注射器或滴管吸去管口的气泡。
上槽接正极,下槽接负极,开启电泳仪,恒压160V ,聚焦2至3小时,至电流近于零不再降低时,停止电泳。
4. 剥胶
取下胶管,用H 2O 将胶管和两端洗2次,用注射器沿管壁轻轻插入针头,在转动胶管和内插针头的同时分别向胶管两端注入H 2O 少许,胶条即自行滑出,若不滑出可用洗耳球轻轻挤出。
胶条置于小培养皿内,记住正极端为“头”,负极端为“尾”,若分不清时,可用pH 试纸鉴定,酸性端为正,碱性端为负。
5. 固定
取2支胶条置于一个小培养皿内,倒入10%三氯乙酸溶液至没过胶条,进行固定,约半小时后,即可看到胶条内蛋白质的白色沉淀带。
固定完毕,倒出固定液,用直尺量出胶条长度“L 2”和正极端到蛋白质白色沉淀带中心(即聚焦部位)的长度“L ’”。
固定后的胶条可在康强860紫外/可见分光光度计上用280nm 或238nm 波长作凝胶扫描,然后用扫描图作相应的测量和计算。
6. 测定pH 梯度
将放在另一个培养皿内未固定的胶条,用直尺量出待测pH 胶条的长度“L 1”。
按照由正极至负极的顺序,用镊子和小刀依次将胶条切成10mm 长的小段,分别置于小试管中,加入1ml H 2O ,浸泡半小时以上或过夜,用仔细校正后的带细长pH 复合电极的pH 计测出每管浸出液的pH 值。
七、数据处理
1. 以胶条长度(mm )为横座标,pH 值为纵座标作图,得到一条pH 梯度曲线。
所测每管的pH 值为10mm 胶条的pH 的混合平均值。
作图时将此pH 值取为10mm 小段中心即5mm 处的pH 值。
2. 用下式计算蛋白质聚焦部位至胶条正极端的实际长度L :
上式中: L’——量出蛋白质的白色沉淀带中心至胶条正极端的长度。
L 1——测pH 的胶条的长度 L 2——固定后胶条的长度
3. 根据计算出的L ,由pH 梯度曲线上查出相应的pH 值,即为该蛋白质的等电点。
4. 画出固定后所测胶条的示意图。
2
1'L L L L ⨯
=。