等电聚焦电泳和race原理
- 格式:pdf
- 大小:175.79 KB
- 文档页数:2

等电聚焦技术的基本原理等电聚焦技术是一种用于分离和纯化蛋白质或其他生物分子的技术。
本文将详细介绍等电聚焦技术的基本原理,主要包含以下几个方面:等电点、pH梯度、电泳、温度和缓冲液。
1.等电点等电点是指蛋白质等电点,即在溶液中同时存在正负电荷,且正负电荷量相等时的pH值。
蛋白质分子在等电点时呈电中性,最容易分离。
这是因为蛋白质分子在等电点时,正负电荷相互抵消,蛋白质分子不再带电,因此不容易再与其他分子相互作用,从而更容易被分离。
2.pH梯度在等电聚焦技术中,pH梯度是指溶液中不同部位的pH值不同,通常是在一个范围内变化。
通过控制pH梯度的变化,可以使得蛋白质分子在电场中的迁移率不同,进而使得不同的蛋白质分子得以分离。
pH梯度的建立可以通过使用缓冲液和调节溶液的酸碱度来实现。
3.电泳电泳是指带电粒子在电场中的移动现象。
在等电聚焦技术中,电泳主要是用于分离不同的蛋白质分子。
在电场作用下,带电的蛋白质分子会向相反电荷的电极移动,移动速度与蛋白质分子的电荷量、分子量和溶液的pH值等因素有关。
通过控制电场强度和电泳时间,可以进一步优化蛋白质分子的分离效果。
4.温度温度会影响蛋白质分子的状态和形状,进而影响其分离效果。
在等电聚焦技术中,温度主要通过影响水的体积来实现对蛋白质分离效果的影响。
温度升高会导致溶液的粘度降低,从而使得蛋白质分子的移动速度加快,有利于提高分离效率。
但是,过高的温度会导致蛋白质分子变性,影响其结构和功能,因此需要控制适宜的温度范围。
5.缓冲液缓冲液是指能够抵抗外来酸碱物质并保持其pH值稳定的液体。
在等电聚焦技术中,缓冲液的作用是保护蛋白质分子,使得其能够在电场中保持稳定的形态和结构。
常用的缓冲液包括磷酸盐缓冲液、碳酸盐缓冲液等。
缓冲液的选择应该根据具体实验条件和分离的蛋白质分子特性进行优化。
总之,等电聚焦技术是一种基于电荷和pH值分离蛋白质分子的有效方法。
通过掌握等电点、pH梯度、电泳、温度和缓冲液等基本原理,可以实现对蛋白质分子的高效分离和纯化。


等电聚焦电泳(IEF)在IEF的电泳中,具有pH梯度的介质其分布是从阳极到阴极,pH值逐渐增大。
如前所述,蛋白质分子具有两性解离及等电点的特征,这样在碱性区域蛋白质分子带负电荷向阳极移动,直至某一pH位点时失去电荷而停止移动,此处介质的pH恰好等于聚焦蛋白质分子的等电点(pl)。
同理,位于酸性区域的蛋白质分子带正电荷向阴极移动,直到它们的等电点上聚焦为止。
可见在该方法中,等电点是蛋白质组分的特性量度,将等电点不同的蛋白质混合物加入有pH梯度的凝胶介质中,在电场内经过一定时间后,各组分将分别聚焦在各自等电点相应的pH位置上,形成分离的蛋白质区带。
病毒基因、人工转入基因、转座子等外源性基因随机整合到宿主细胞基因组内,并利用宿主细胞进行转录时,常产生一些dsRNA。
宿主细胞对这些dsRNA迅即产生反应,其胞质中的核酸内切酶Dicer将dsRNA切割成多个具有特定长度和结构的小片段RNA(大约21~23 bp),即siRNA。
siRNA在细胞内RNA解旋酶的作用下解链成正义链和反义链,继之由反义siRNA 再与体内一些酶(包括内切酶、外切酶、解旋酶等)结合形成RNA诱导的沉默复合物(RNA—induced silencing complex,RISC)。
RISC与外源性基因表达的mRNA的同源区进行特异性结合,RISC具有核酸酶的功能,在结合部位切割mRNA,切割位点即是与siRNA中反义链互补结合的两端。
被切割后的断裂mRNA随即降解,从而诱发宿主细胞针对这些mRNA的降解反应。
siRNA不仅能引导RISC切割同源单链mRNA,而且可作为引物与靶RNA结合并在RNA聚合酶(RNA-dependent RNA polymerase,RdRP)作用下合成更多新的dsRNA,新合成的dsRNA再由Dicer切割产生大量的次级siRNA,从而使RNAi的作用进一步放大,最终将靶mRNA完全降解.RNAi发生于除原核生物以外的所有真核生物细胞内。


等电聚焦电泳(IEF)分离蛋白及测定蛋白质等电点等电点聚焦(IEF )是在电场中分离蛋白质技术的一个重要发展,等电聚焦是在稳定的pH 梯度中按等电点的不同分离两性大分子的平衡电泳方法。
在电场中充有两性载体和抗对流介质,当加上电场后,由于两性载体移动的结果,在两极间逐步建立稳定的pH 梯度,当蛋白质分子或其他两性分子存在于这样的pH 梯度中时,这种分子便会由于其表面电荷在此电场中运动,并最终达到一个使其表面静电荷为0 的区带,这时的pH 则是该分子的pI ,聚焦在等电点的分子也会不断扩散,一旦偏离其等电点后,由于pH 环境的改变,分子又立即得到正电荷或负电荷,从而又向pI 迁移。
因此,这些分子总会是处于不断扩散和抗扩散的平衡中,在pI 处得以“聚焦”.二、仪器与试剂1.材料:蛋白样品2.试剂:聚丙烯酰胺、甲乙聚丙烯酰胺、两性电解质、尿素、NP-40、teiton-100电极液:1M 磷酸(阳极液)、1M 氢氧化钠(阴极液)固定液:100g三氯乙酸、10g磺基水杨酸溶于500ml,定容为1000ml染色液:0.35g考马斯亮蓝R—150溶于300ml脱色液中,加热到60 - 70C,加入0.3g硫酸铜。
脱色液:25%乙醇、8%冰乙酸溶于水样品缓冲液:1%Ampholine 、2%Triton X-100 、9M 尿素三、操作步骤:1, 样品制备:用IEF 样品缓冲液提取待分析样品,如其他缓冲液提取的样品则应透析后,冷冻干燥、再复溶于IEF 样品缓冲液。
充分溶解后,离心去除不溶杂质。
2, 制模具:洗干净两块IEF 专用玻璃板,进行硅化和反硅化处理,两块玻璃板的硅化和反硅化面相对,放上夹条,夹子夹好。
3, 配胶:胶液组成:6ml 胶母液(10%,19/1)6—8 %尿素1ml Ampholine (pH3.5-10)60-80ul 10%AP5 ul TEMED4, 灌胶:配好的胶迅速灌入模具5, 电泳:等胶凝固后,小心揭去上下玻璃板,将塑料垫片底部擦干,小心放于电泳槽上。


等电聚焦电泳的原理及应用等电聚焦电泳,这个听起来复杂的名词,其实就像是一场精妙的舞会。
想象一下,各种各样的蛋白质、核酸,像小伙伴一样,聚集在一个舞台上,它们各自有自己的特长,有的擅长旋转,有的则能高高跳起,真的是热闹非凡。
好啦,今天就来聊聊这个舞会的规则和乐趣。
等电聚焦电泳,简单说就是利用电场把分子按照它们的等电点来分开。
每种分子在特定的pH值下会带上正负电荷,就像小朋友们在玩捉迷藏。
想象一下,有些小朋友喜欢在阳光下,而有些则喜欢在阴凉的地方玩耍。
这个等电点,就是分子在电泳中的“家”,它们会不遗余力地朝着自己的家奔去。
当电场施加时,分子们就像是在追逐游戏中疯狂奔跑,结果就是它们各自找到了最适合自己的地方,嘿,这可是个精彩的过程哦!说到应用,这个等电聚焦电泳就像一把万用钥匙,能够打开许多实验室的大门。
比如在蛋白质的分离上,它简直是个天才!许多科学家在做生物研究时,常常需要分离出特定的蛋白质。
这就好比你要从一堆水果中挑出苹果,当然得先知道苹果的特征。
而等电聚焦电泳正是通过调节pH值,让每种蛋白质在适合自己的地方聚集,就像是让苹果聚在一起,其他水果都乖乖地站在一旁。
你知道吗?这个方法不仅仅局限于研究蛋白质哦!在医学上,等电聚焦电泳也能派上大用场。
比如说,某些疾病的诊断,医生可以通过分析血液中的特定蛋白质来判断病情。
这就像是在给身体做一次“深度体检”,从中发现潜在的健康问题,简直是一种“未雨绸缪”的智慧。
说到这里,可能有人会问,这个过程会不会很复杂?其实不然,操作起来也算不上是太难。
只需要一些专业的仪器和实验室的环境,像个小化学家一样,轻松搞定。
不过,别忘了,实验中的每一步都得谨慎,哪怕是微小的差错,都可能导致结果大相径庭,就像你在做饭时不小心加错了盐,最后可能让整道菜变得难以下咽。
不过,最让人惊讶的是,这个技术的历史也蛮有意思的。
早在上世纪,科学家们就开始尝试用电泳分离分子,经过不断的摸索,终于找到了这条等电聚焦的路子。

等电聚焦电泳原理
等电聚焦电泳是一种常用的电泳技术,适用于分离与测量带有相近分子大小的生物分子。
其原理是利用电流和电场使带电生物分子在凝胶中移动,从而实现这些分子的分离。
等电聚焦电泳的基本原理是根据带电生物分子在凝胶中的异电点而进行分离。
异电点是指生物分子在特定pH值下,净电荷
为零的点。
在等电聚焦电泳中,一个pH 梯度被建立在凝胶中。
电泳开始时,电场中的带电分子会在其异电点处停止移动,因为此时分子的净电荷为零。
随着pH梯度的建立,凝胶中电场
的强度也会增加,这将使带电生物分子在偏离异电点的方向上移动。
通过调整电场的强度和时间,可以实现对特定分子数量、大小进行有效的分离。
等电聚焦电泳的优势在于,它能够对分子进行高分辨率的分离和定量。
通过调整pH梯度和电场强度,可以精确控制分子在
凝胶中的移动速度,从而实现对分子的准确分离。
此外,等电聚焦电泳还可以与其他电泳技术结合使用,如凝胶电泳和双向电泳,以进一步提高分离效果。
总的来说,等电聚焦电泳利用了分子在异电点附近的特性,通过建立pH梯度和调整电场强度,实现了对带电生物分子的有
效分离。
它是一种强大的生物分析工具,广泛应用于分离和测量复杂的生物分子混合物。
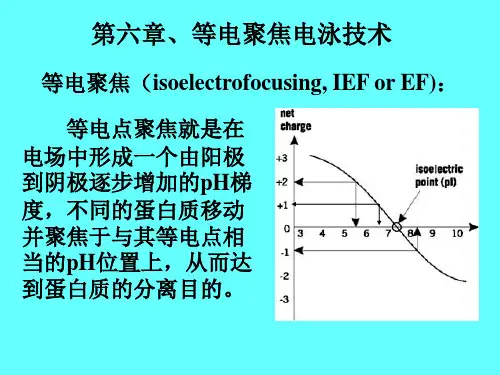

简述等电聚焦电泳法的原理、特点原理:不同的蛋白质等电点不同,如果分子处于pH和等电点一致的溶液中,则泳动就停止进行。
如果溶液内的pH是位置的函数,或者说有一个pH的位置梯度,那么在一个稳定连续的线性pH梯度的溶液中进行分离,每一种被分离的两性物质都移向与它的等电点相一致的pH位置,在那里不再移动。
由于在这点净电荷为零,因而又称等电聚焦。
特点:1、使用两性载体电解质,在电极之间形成稳定的、连续的、线性的pH梯度。
2、由于“聚焦效应”,即使很小的样品也能获得清晰的、鲜明的区带界面。
3、电泳速度快。
4、分辨率高。
5、加入样品的位置可任意选择。
6、可用于测定蛋白质类物质的等电点。
7、适用于中、大分子量生物组分的分离分析。

电泳技术的基本原理和分类电泳法,是指带电荷的供试品(蛋白质、核苷酸等)在惰性支持介质(如纸、醋酸纤维素、琼脂糖凝胶、聚丙烯酰胺凝胶等)中,于电场的作用下,向其对应的电极方向按各自的速度进行泳动,使组分分离成狭窄的区带,用适宜的检测方法记录其电泳区带图谱或计算其百分含量的方法。
电泳技术的基本原理和分类在电场中,推动带电质点运动的力(F)等于质点所带净电荷量(Q)与电场强度(E)的乘积。
F=QE质点的前移同样要受到阻力(F)的影响,对于一个球形质点,服从Stoke定律,即:F′=6πrην式中r为质点半径,η为介质粘度,ν为质点移动速度,当质点在电场中作稳定运动时:F=F′即QE=6πrην可见,球形质点的迁移率,首先取决于自身状态,即与所带电量成正比,与其半径及介质粘度成反比。
除了自身状态的因素外,电泳体系中其它因素也影响质点的电泳迁移率。
电泳法可分为自由电泳(无支持体)及区带电泳(有支持体)两大类。
前者包括Tise-leas式微量电泳、显微电泳、等电聚焦电泳、等速电泳及密度梯度电泳。
区带电泳则包括滤纸电泳(常压及高压)、薄层电泳(薄膜及薄板)、凝胶电泳(琼脂、琼脂糖、淀粉胶、聚丙烯酰胺凝胶)等。
自由电泳法的发展并不迅速,因为其电泳仪构造复杂、体积庞大,操作要求严格,价格昂贵等。
而区带电泳可用各种类型的物质作支持体,其应用比较广泛。
本节仅对常用的几种区带电泳分别加以叙述。
影响电泳迁移率的因素⒈电场强度 电场强度是指单位长度(cm)的电位降,也称电势梯度。
如以滤纸作支持物,其两端浸入到电极液中,电极液与滤纸交界面的纸长为20cm,测得的电位降为200V,那么电场强度为200V/2 0cm=10V/cm。
当电压在500V以下,电场强度在2-10v/cm时为常压电泳。
电压在500V以上,电场强度在20-200V/cm时为高压电泳。
电场强度大,带电质点的迁移率加速,因此省时,但因产生大量热量,应配备冷却装置以维持恒温。
等电聚焦电泳(IEF)
在IEF的电泳中,具有pH梯度的介质其分布是从阳极到阴极,pH值逐渐增大。
如前所述,蛋白质分子具有两性解离及等电点的特征,这样在碱性区域蛋白质分子带负电荷向阳极移动,直至某一pH位点时失去电荷而停止移动,此处介质的pH恰好等于聚焦蛋白质分子的等电点(pl)。
同理,位于酸性区域的蛋白质分子带正电荷向阴极移动,直到它们的等电点上聚焦为止。
可见在该方法中,等电点是蛋白质组分的特性量度,将等电点不同的蛋白质混合物加入有pH梯度的凝胶介质中,在电场内经过一定时间后,各组分将分别聚焦在各自等电点相应的pH位置上,形成分离的蛋白质区带。
病毒基因、人工转入基因、转座子等外源性基因随机整合到宿主细胞基因组内,并利用宿主细胞进行转录时,常产生一些dsRNA。
宿主细胞对这些dsRNA迅即产生反应,
其胞质中的核酸内切酶Dicer将dsRNA切割成多个具有特定长度和结构的小片段RNA(大约21~23 bp),即siRNA。
siRNA在细胞内RNA解旋酶的作用下解链成正义链和反义链,继之由反义siRNA再与体内一些酶(包括内切酶、外切酶、解旋酶等)结合形成RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)。
RISC与外源性基因表达的mRNA的同源区进行特异性结合,RISC具有核酸酶的功能,在结合部位切割mRNA,切割位点即是与siRNA中反义链互补结合的两端。
被切割后的断裂mRNA随即降解,从而诱发宿主细胞针对这些mRNA的降解反应。
siRNA不仅能引导RISC切割同源单链mRNA,而且可作为引物与靶RNA结合并在RNA聚合酶(RNA-dependent RNA polymerase,RdRP)作用下合成更多新的dsRNA,新合成的dsRNA再由Dicer切割产生大量的次级siRNA,从而使RNAi的作用进一步放大,最终将靶mRNA完全降解。
RNAi发生于除原核生物以外的所有真核生物细胞内。
需要说明的是,由于dsRNA抑制基因表达具有潜在高效性,任何导致正常机体dsRNA形成的情况都会引起不需要的相应基因沉寂。
所以正常机体内各种基因有效表达有一套严密防止dsRNA形成的机制。
SMARTTM 3'-RACE原理
利用mRNA的3' 末端的poly(A)尾巴作为一个引物结合位点,以连有SMART寡核苷酸序列通用接头引物的Oligo(dT)30MN作为锁定引物反转录合成标准第一链cDNA。
然后用一个基因特异引物GSP1(gene specific primer,GSP)作为上游引物,用一个含有部分接头序列的通用引物UPM(universal primer,UPM)作为下游引物,以cDNA第一链为模板,进行PCR循环,把目的基因3' 末端的DNA片段扩增出来。
(见下图)
SMARTTM 5'-RACE原理
先利用mRNA的3'末端的poly(A)尾巴作为一个引物结合位点,以Oligo(dT)30MN作为锁定引物在反转录酶MMLV作用下,反转录合成标准第一链cDNA。
利用该反转录酶具有的末端转移酶活性,在反转录达到第一链的5' 末端时自动加上3-5个(dC)残基,退火后(dC)残基与含有SMART寡核苷酸序列Oligo(dG)通用接头引物配对后,转换为以SMART序列为模板继续延伸而连上通用接头(见下图)。
然后用一个含有部分接头序列的通用引物UPM(universal primer,UPM)作为上游引物,用一个基因特异引物2(GSP 2 genespecific primer,GSP)作为下游引物,以SMART第一链cDNA为模板,进行PCR循环,把目的基因5'末端的cDNA片段扩增出来。
最终,从2个有相互重叠序列的3'/ 5'-RACE产物中获得全长cDNA,或者通过分析RACE产物的3'和5'端序列,合成相应引物扩增出全长cDNA。