人教版九年级化学第十一单元盐和化肥知识点
- 格式:docx
- 大小:23.14 KB
- 文档页数:4

千里之行,始于足下。
人教版九年级化学第十一单元盐化肥知识点总
结
人教版九年级化学第十一单元主要讲述了盐和化肥的相关知识。
下面是对这一单元的知识点的总结:
1. 盐的成分和性质:
- 盐是一类晶体化合物,由金属离子和非金属离子(通常是酸根离子)组成。
- 盐晶体具有离子晶格结构,其常见形式为正六方晶系。
- 盐的性质包括溶解性、导电性、熔点和沸点等。
2. 盐的制备方法:
- 盐的制备方法主要包括酸与金属反应、酸与碱反应和金属与非金属反应等。
- 酸与金属反应的产物为含有金属离子和酸根离子的盐。
- 酸与碱反应的产物是水和盐。
- 金属与非金属反应的产物是含有阳离子和阴离子的盐。
3. 化肥的种类和作用:
- 化肥是用于提供植物所需的营养元素的物质。
- 化肥可以分为有机肥和无机肥两种。
- 无机肥是指由人工合成的无机化合物制成的肥料,包括氮肥、磷肥和钾肥等。
- 有机肥是指由动植物的残体经微生物分解后形成的肥料,包括厩肥、堆肥和腐植酸肥等。
4. 肥料的标示和用量:
第1页/共2页
锲而不舍,金石可镂。
- 肥料的标示一般包括氮、磷、钾元素的含量。
- 氮肥的标志是\。

第十一单元盐化肥教材知识梳理知识点一:常见的盐及其用途1.日常生活中所说的盐,通常指食盐(主要成分是);而化学中的盐是指一类组成里含有和的化合物。
2. 是重要的调味品。
它还有很多的用途,例如医疗上的,农业上用它来,还可以作为化工原料,还可以腌制食品延长保存时间。
公路上的积雪也可以用来消除等。
3. 是一种工业用盐,有毒、有咸味,外形与食盐相似,人若误食会引起。
4.碳酸钠俗称或。
在工业上,碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
我国制碱工业的先驱— 发明了侯氏制碱法,这里的碱是指纯碱— (写化学式)。
5.天然存在的或的主要成分就是碳酸钙,它们都是重要的。
碳酸钙还可用作。
6.碳酸氢钠俗称。
碳酸氢钠是焙制糕点所用的的主要成分之一。
在医疗上,它是治疗的一种药剂。
碳酸氢钠跟碳酸钠一样能跟酸反应产生二氧化碳和水。
但碳酸氢钠又不同于碳酸钠的性质是:能产生碳酸钠、二氧化碳和水。
知识点二:复分解反应及其发生的条件7.两种互相交换成分,生成另外两种化合物的反应叫做反应。
只有当两种化合物互相交换成分,生成物中有生成时,复分解反应才可以发生。
8.常见沉淀:(写出其化学式)(1)蓝色沉淀:;(2)红褐色沉淀:;(3)既不溶于水也不溶于酸的白色沉淀:、;(4)溶于酸且能与酸反应产生气体的白色沉淀:、;(5)溶于酸且能治疗胃酸过多的白色沉淀:、。
9. 分析下列三个化学反应,回答问题①BaCO3+2HCl=BaCl2+H2O+CO2↑②K2CO3+2HNO3=2KNO3 + H2O+CO2↑③Na2CO3+H2SO4=Na2SO4+H2O+CO2↑(1)BaCO3、K2CO3、Na2CO3三种不同物质中,都含有的离子是,我们把这类盐叫做碳酸盐;(2)总结规律:碳酸盐能与酸反应生成气体;此外碳酸氢盐也能与酸发生反应生成该气体,例如蒸馒头揉面时需加入适量的,因为面团经过发酵后会产生乳酸等有机酸,与其反应生成二氧化碳气体,不但能除去面团中的酸味,还会使蒸出的馒头松软多孔。

千里之行,始于足下。
九年级化学第十一单元盐化肥知识点总结及习题九年级化学第十一单元主要讲述了盐和化肥的知识。
以下是对这个单元的知识点总结及习题:一、盐的基本概念:1. 盐是由酸和碱反应产生的化合物,通常是由金属离子和非金属离子组成的。
2. 盐可以分为阳离子和阴离子,其中阳离子是金属离子,阴离子是非金属离子。
二、盐类的命名:1. 一价阳离子和一价阴离子组成的盐的命名方法为“阳离子名称+阴离子名称”。
2. 二价阳离子和一价阴离子组成的盐的命名方法为“阳离子名称(+元素名称的后缀冠词)+阴离子名称”。
3. 二价阳离子和二价阴离子组成的盐的命名方法为“阳离子名称(+元素名称的后缀冠词)+阴离子名称”。
三、化肥的种类及其成分:1. 氮肥:包括铵盐肥料和硝酸铵肥料,主要含有氮元素。
2. 磷肥:包括磷酸二铵肥料和磷酸一铵肥料,主要含有磷元素。
3. 钾肥:包括氯化钾肥料和硫酸钾肥料,主要含有钾元素。
4. 复合肥:包括氮磷钾肥料,含有氮、磷、钾等元素。
四、化肥的作用及注意事项:第1页/共3页锲而不舍,金石可镂。
1. 氮肥的作用是促进植物的生长和发育,但过量使用会导致土壤酸化和水源污染。
2. 磷肥的作用是促进植物的根系发育和花果的形成,但过量使用会导致地下水污染。
3. 钾肥的作用是提高植物的抗病虫害能力和抗逆性,但过量使用会损伤植物的叶片。
4. 复合肥的作用是提供多种元素,适用于不同阶段的植物生长。
五、化肥的使用方法:1. 化肥的使用应根据作物的需求和土壤的情况来确定。
2. 化肥的施用时间要根据作物的生理需求来确定。
3. 化肥的施用方法要均匀,并避免过量使用。
六、习题:1. NaCl是由哪两个离子组成的盐?2. 下列化合物中属于复合肥的是:A. 氯化钾B. 硝酸铵C. 磷酸二铵D. 硫酸钾3. 植物吸收盐肥的主要途径是:A. 根系吸收B. 叶片吸收C. 茎部吸收D. 花朵吸收4. 过量施用氮肥可能导致的问题是:A. 土壤酸化B. 地下水污染C. 植物叶片损伤千里之行,始于足下。

人教版2023初中化学九年级化学下册第十一单元盐化肥考点大全笔记单选题1、在“粗盐的提纯”实验中,一定用不到的仪器是A.铁架台、蒸发皿B.酒精灯、漏斗C.细口瓶、试管D.量筒、烧杯答案:C粗盐的提纯需要溶解、过滤除去不溶性固体杂质,然后蒸发结晶得到氯化钠晶体;溶解需要用量筒量取合适量的水,在烧杯中溶解粗盐;过滤需要用到铁架台、漏斗、烧杯、玻璃棒;蒸发结晶需要用蒸发皿、玻璃棒、酒精灯等;由分析得,不需要试管;故选C。
2、化肥和农药影响农作物的产量。
下列说法正确的是A.使用化肥越多,农作物产量越高B.铵态氮肥与熟石灰混合使用可以提高肥效C.大量使用农药会导致土壤和食品污染,因此要杜绝使用农药D.适当增大蔬菜大棚内二氧化碳的浓度,可以促进蔬菜的光合作用答案:DA、化肥过多的施用不仅对农作物造成不好的影响,也会对环境造成一定的污染,不符合题意;B、铵态氮肥与碱性物质混合后能放出氨气,降低肥效;熟石灰显碱性,铵态氮肥不能与熟石灰混合使用,不符合题意;C 、农药能杀灭病虫害,不能杜绝使用农药,应合理使用,不符合题意;D 、植物进行光和作用时需要二氧化碳,所以为促进光合作用的进行,可在大栅内适当增大二氧化碳的浓度,符合题意。
故选D 。
3、某些金属氢化物与水反应可生成碱和氢气,如:NaH+H 2O ═NaOH+H 2↑,则CaH 2与足量Na 2CO 3溶液之间发生反应的产物是( )A .CaCO 3、NaOH 和H 2B .Ca(OH)2和H 2C .NaOH 和Ca(OH)2D .Ca(OH)2、CaCO 3和H 2答案:A试题分析:根据所提供的知识可知,氢化钙与水反应生成氢氧化钙和氢气,氢氧化钙和碳酸钠反应生成氢氧化钠和碳酸钙,故发生反应的产物是碳酸钙、氢氧化钠、氢气,选A考点:金属氢化物的性质4、河道两旁有甲、乙两厂,它们排放的工业废水中共含有H +、Na +、Ba 2+、Cl -、SO42-、CO 32-六种离子。

人教版九年级下册化学第十一单元盐、化肥知识点总结盐、化肥知识点总结一、盐的基本概念1. 盐是由阳离子和阴离子通过离子键结合而形成的化合物。
阳离子可以是金属离子或铵离子,阴离子可以是非金属离子、氧酸根离子或酸根离子。
2. 盐的命名可以根据阳离子和阴离子命名的方式进行。
对于阳离子为单质的金属离子,一般以金属名称命名;对于氧化物的亚氧根离子,一般以“亚氧化物”加阴离子的名称命名;对于非金属元素阴离子,一般以“酸根”加“酸”加“-ate”或“-ite”命名。
3. 盐的性质包括溶解性、热稳定性、溶液的电离度等。
二、常见盐的种类和性质1. 氯化盐:氯化盐的特点是它们的溶液导电性好,并且会产生氯气的气体。
常见的氯化盐包括氯化钠(NaCl)、氯化铵(NH4Cl)、氯化钾(KCl)等。
2. 硝酸盐:硝酸盐的溶液可以产生硝气的气体。
常见的硝酸盐有硝酸钠(NaNO3)、硝酸铵(NH4NO3)。
3. 硫酸盐:硫酸盐的溶液可以产生硫酸的酸性气味。
常见的硫酸盐有硫酸钠(Na2SO4)、硫酸铵(NH4)2SO4)。
第1页/共4页4. 碳酸盐:碳酸盐在酸性溶液中会产生二氧化碳气体,常见的碳酸盐有碳酸氢钠(NaHCO3)、碳酸钠(Na2CO3)。
三、化肥的基本概念1. 化肥是指用来满足植物对营养元素需求的化学物质。
常见的化肥包括氮肥、磷肥和钾肥。
2. 氮肥:氮肥可以提供植物所需的氮元素,促进植物的生长和发育。
常见的氮肥有尿素、铵态氮肥和硝态氮肥。
3. 磷肥:磷肥可以提供植物所需的磷元素,促进植物的根系生长和果实发育。
常见的磷肥有磷酸二铵((NH4)2HPO4)、磷酸三钙(Ca3(PO4)2)等。
4. 钾肥:钾肥可以提供植物所需的钾元素,促进植物的养分吸收和抗逆能力。
常见的钾肥有氯化钾(KCl)、硫酸钾(K2SO4)等。
四、化肥的施用方法和注意事项1. 化肥的施用主要包括追肥和基肥两个阶段。
追肥是指在作物生长期适量补充化肥元素,基肥是指在作物生长开始之前施加足够的化肥。

千里之行,始于足下。
人教版九班级化学下册第十一单元盐、化肥学问点一、盐的概念和性质1. 盐的概念:盐是由阳离子和阴离子组成的化合物,通常是由酸和碱中的阳离子和阴离子结合而成。
2. 盐的性质:(1)晶体形态:盐大多数是无色结晶体,也有少数是有色的,如铜(II)盐是蓝色的。
(2)溶解性:大多数盐是可溶于水的,但也有一些盐是不溶于水的,如银氯化物。
(3)电解性:盐在水中能够进行电解,产生正离子和负离子。
(4)熔点和沸点:不同的盐有不同的熔点和沸点。
二、常见的盐及其制备方法1. 氯化盐:氯化钠(NaCl),制备方法包括海水蒸发结晶、盐井和岩盐矿提取等。
2. 硫酸盐:硫酸铁(FeSO4),制备方法包括铁和硫酸反应、硫酸和铁的反应等。
3. 碳酸盐:碳酸钠(Na2CO3),制备方法包括自然产物提取、化学工业方法等。
三、化肥的概念和分类第1页/共3页锲而不舍,金石可镂。
1. 化肥的定义:化肥是通过人工合成或加工制成的,含有一种或多种植物养分元素的化合物。
2. 化肥的分类:(1)氮肥:主要包括尿素、铵盐肥等;(2)磷肥:主要包括一般磷肥、高效磷肥等;(3)钾肥:主要包括硫酸钾、氯化钾等;(4)复合肥:主要包括氮磷钾复合肥、氮磷复合肥等。
四、化肥的作用和用途1. 化肥的作用:化肥可以供应植物所需的养分元素,促进植物的生长和发育。
2. 化肥的用途:广泛应用于农业生产中,可以用于蔬菜、水果、粮食等作物的种植和生产。
五、化肥的优缺点1. 化肥的优点:(1)提高农作物的产量和质量,满足人们对食物的需求。
(2)使用便利,施肥效果明显,能够快速供应植物所需的养分元素。
2. 化肥的缺点:(1)过量使用化肥可能导致土壤和地下水污染。
(2)长期使用化肥可能降低土壤的肥力。
(3)含有过量氮素和磷素的化肥可能对环境造成污染。
六、合理使用盐和化肥的留意事项千里之行,始于足下。
1. 盐的使用:(1)不宜过量摄入,尤其是高血压患者。
(2)盐应避开与酸性物质接触,以防腐蚀。

人教版九年级化学第十一单元盐化肥知识点总结人教版九年级化学第十一单元盐化肥知识点总结第一节常见的盐盐的定义是由金属离子(或NH4+)和酸根离子形成的化合物。
常见的盐有以下几种:1.氯化钠:白色粉末,水溶液有咸味。
它可以作为调味品、腌制咸菜、防腐剂和消除积雪的融雪剂。
但是,长期过量使用融雪剂会破坏植被和道路,溶解度受温度影响不大还会使土壤盐碱化。
在农业上,氯化钠溶液可以用来选种。
浓度为0.9%的氯化钠溶液可以制作生理盐水。
2.碳酸钠:用于玻璃、造纸、纺织、洗涤、食品工业等。
但是,玻璃是个例外。
此外,碳酸钠还可以作为建筑材料、补钙剂和制糕点所用的发酵粉。
在医疗上,碳酸钠可以治疗胃酸过多。
3.碳酸氢钠:白色晶体,易溶于水。
它可以用于制取二氧化碳的原料,也可以用于制糕点所用的发酵粉。
但是,碳酸氢钠不稳定,受热能分解:2NaHCO3.需要注意的是,区别碳酸钠和碳酸氢钠的方法就是分别加热,有能使澄清石灰水变浑浊的气体生成的,就是碳酸氢钠,否则是碳酸钠。
碳酸钠和碳酸氢钠的水溶液都呈碱性。
4.碳酸钙:白色固体,不溶于水。
它是实验室制取二氧化碳的原料的主要成分。
需要注意的是,工业用盐亚硝酸钠有毒,不能食用。
消毒用盐有多种,如硫酸铜、高锰酸钾和二氧化氯。
钠离子可以维持细胞内外的水分分布,促进细胞内外物质交换;氯离子可以促生盐酸、帮助消化,增进食欲。
氯化钠等溶于水后,会使水的凝固点降低,以达到溶雪的目的。
但是,氯化钠作为融雪剂,对植物有害,会腐蚀桥梁等,所以现在逐渐被绿色融雪剂代替。
第二节粗盐提纯粗盐的初步提纯只是去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
粗盐中由于含有氯化镁、氯化钙等杂质,易吸收空气中的水分而潮解。
无水氯化钙可用作干燥剂。
粗盐的实验步骤包括溶解、过滤、蒸发和回收。
实验仪器包括烧杯、铁架台、漏斗、蒸发皿等。
在实验过程中,玻璃棒的作用是搅拌,加速溶解。
硝酸铵、硫酸铵、氯化铵、氨水和硝酸钠是常用的氮肥,它们的化学式分别为CO(NH2)2、NH4NO3、(NH4)2SO4、NH4Cl和NaNO3,含氮量分别为46.7%、17.7%、35%、21.2%和26.2%。

千里之行,始于足下。
人教版九年级化学下册第十一单元盐、化肥知识点一、盐的性质和应用1. 盐是由酸和碱反应生成的化合物,是一类离子化合物。
2. 盐有晶体结构,常见的盐有离子键,具有良好的溶解性和导电性。
3. 盐能与金属发生置换反应,生成相应的金属盐。
4. 盐的应用:用于食品的调味、制作肥皂、制冰、染料和玻璃等工业生产中。
二、化肥的分类及应用1. 化肥按其来源分为天然肥料和人工合成肥料。
- 天然肥料:如磷矿石、硝酸钠、硫酸铵等,主要有磷肥、氮肥和钾肥。
- 人工合成肥料:如尿素、硫酸铵、硝酸钾等,也主要包括磷肥、氮肥和钾肥。
2. 化肥的应用:- 磷肥:促进植物的根系发育,在结实和抗寒抗旱方面起着重要作用。
- 氮肥:促进植物的茎叶生长,增加产量,并提高作物的品质。
- 钾肥:提高植物的抗病性和抗逆性,促进光合作用和合成蛋白质的过程。
- 复合肥:同时含有氮、磷和钾的化肥,能够为植物提供全面的养分。
三、盐和化肥的合理使用1. 合理使用盐:- 食盐:应适量摄入,不宜过多或过少,有助于调节体内的水盐平衡。
- 工业盐:应遵守相关的环保规定,减少对环境的污染。
2. 合理使用化肥:- 合理施肥:根据不同作物的需肥量和生长阶段的需求,按时合理施肥,避免肥料的浪费和对环境的污染。
第1页/共2页锲而不舍,金石可镂。
- 生物肥料:合理使用生物肥料(如绿肥、有机肥),有利于改善土壤结构,提高农作物的产量和品质,减少化肥的使用量。
- 农业循环利用:通过农作物残留物和畜禽粪便的回收利用,减少对化肥的依赖,实现农业的循环、可持续发展。

盐化肥
一、氯化钠的性质和主要用途:
1.氯化钠(NaCl)是食盐的主要成分,无色透
明的晶体,易溶于水,味咸。
2.主要用途:作调味品,腌制食品。
能维持人体正常生理机能,医疗上用来配制生理盐水,工业上用来作原料制取碳酸钠、氢氧化钠、氯气和盐酸等,农业上用氯化钠溶液来选种。
二、碳酸钠的性质和主要用途:
1.碳酸钠(Na2CO3)俗称纯碱、苏打。
白色粉末,易溶于水。
2.化学性质:①与酸反应: Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②与可溶性碱反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
3.主要用途:用于生产玻璃、造纸、纺织、洗涤剂。
三、碳酸氢钠的性质和主要用途:
1.碳酸氢钠(NaHCO3)俗称小苏打。
细小的白色晶体,可溶于水。
2.化学性质:①与酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑;
②加热分解:2NaHCO3Na2CO3+H2O+CO2↑。
3.主要用途:发酵粉的主要成分,治疗胃酸过多的药剂。
四、碳酸钙的性质和主要用途:
1.碳酸钙(CaCO3)是石灰石、大理石的主要成分,白色固体,难溶于水。
2.化学性质:①与酸反应: CaCO3+2HCl=CaCl2+H2O+CO2↑;
②高温分解:CaCO3CaO+CO2↑。
3.用途:可用作补钙剂。
石灰石、大理石用作建筑材料,也用于实验室制取二氧化碳。
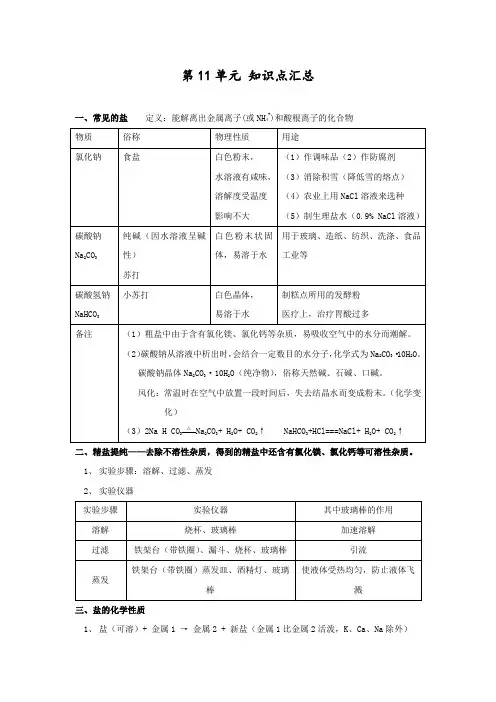
第11单元知识点汇总一、常见的盐定义:能解离出金属离子(或NH4+)和酸根离子的化合物二、精盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
1、实验步骤:溶解、过滤、蒸发2、实验仪器三、盐的化学性质1、盐(可溶)+ 金属1 →金属2 + 新盐(金属1比金属2活泼,K、Ca、Na除外)2、盐 + 酸→新盐 + 新酸3、盐 + 碱→新盐 + 新碱(反应物需都可溶,且满足复分解反应的条件)4、盐 + 盐→两种新盐(反应物需都可溶,且满足复分解反应的条件)四、酸、碱、盐的溶解性1、酸:大多数都可溶(除硅酸H2SiO3不溶)2、碱:只有氨水、氢氧化钠、氢氧化钾、氢氧化钡和氢氧化钙可溶于水,其余均为沉淀3、盐:钾盐、钠盐、铵盐、硝酸盐都可溶;氯化物除AgCl难溶外,其余多数均可溶;硫酸盐除BaSO4难溶,Ag2SO4、CaSO4微溶外,其余多数可溶;碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶。
注:BaSO4、、AgCl 不溶于水,也不溶于酸附:常见酸碱盐溶解性表记忆法1.全溶盐:钾、钠、铵、硝酸(盐);盐酸银盐对着干;硫酸用钡来检验;可溶碱:钾、钠、铵、钡(碱)。
2.钾钠铵硝酸盐,完全溶解不困难;氯化银硫酸钡,生成沉淀记心间;碱类、碳酸盐,可溶只有钾钠铵。
五、化学肥料1、农家肥料:营养元素含量少,肥效慢而持久、价廉、能改良土壤结构。
2、化学肥料(氮肥、钾肥、磷肥)⑴氮肥作用:促进植物茎、叶生长茂盛、叶色浓绿(促苗)。
缺氮:叶黄a、常用氮肥尿素CO(NH2)2:含氮量最高的氮肥(有机物)46.7%b、NH4+的检验试剂:碱(NaOH、Ca(OH) 2等)、湿润的红色石蕊试纸NH4NO3 + NaOH=NaNO3 +NH3↑+H2Oc、生物固氮:豆科植物的根瘤菌将氮气转化为含氮的化合物而吸收⑵钾肥作用:促使作物生长健壮、茎杆粗硬,抗倒伏(壮秆);缺钾:叶尖发黄常用钾肥: KCl、草木灰、K2SO4⑶磷肥作用:促进植物根系发达,穗粒增多,饱满(催果);缺磷:生长迟缓,产量降低,根系不发达常用磷肥:磷矿粉 Ca3 (PO4) 2、钙镁磷肥(钙和镁的磷酸盐)、过磷酸钙 Ca(H2PO4) 2和CaSO4重过磷酸钙Ca(H2PO4)2⑷复合肥:含N、P、K中的两种或三种。

千里之行,始于足下。
九年级化学第十一单元盐化肥知识点总结及习题盐化肥的知识点总结:1. 盐化肥的定义:盐化肥是指由无机化合物制成的肥料,主要是以盐酸、硫酸、磷酸等无机酸与氨、氮肥、磷肥等无机化合物反应得到。
2. 盐化肥的分类:- 氮肥盐化肥:如硫酸铵、尿素磷铵等。
- 磷肥盐化肥:如磷酸二铵、磷酸铵等。
- 钾肥盐化肥:如氯化钾、硫酸钾等。
- 复合肥:包含多种养分,如氮、磷、钾等。
3. 盐化肥的优点:- 养分含量高,能迅速提供作物所需养分。
- 适用范围广,可以满足不同作物和土壤的需求。
- 便于携带和施用,易于控制肥料的用量和施肥方式。
4. 盐化肥的缺点:- 长期过量施用会造成土壤质量下降,导致土壤微生物的减少和土壤酸化。
- 容易挥发和淋溶,造成肥料的浪费和环境污染。
- 不能提供有机质,对土壤生态环境的修复有限。
5. 盐化肥的施用方法:- 基本原则:根据作物的需求和土壤的养分状况,合理选择肥料种类和施肥量。
第1页/共3页锲而不舍,金石可镂。
- 施肥时间:一般在作物生长旺盛期和需要养分的时期进行施肥。
- 施肥方式:包括根部追施、撒播施肥、叶面喷施等多种方式。
习题:1. 下列哪种是氮肥盐化肥?A. 硫酸铵B. 磷酸二铵C. 氯化钾D. 硫酸钾2. 盐化肥的主要优点是什么?A. 养分含量高B. 适用范围广C. 便于携带和施用D. 全部都是3. 盐化肥的主要缺点是什么?A. 长期过量施用会造成土壤质量下降B. 容易挥发和淋溶C. 不能提供有机质D. 所有都是4. 盐化肥的施用方法包括:A. 根部追施B. 撒播施肥C. 叶面喷施D. 全部都是答案:千里之行,始于足下。
1. A. 硫酸铵2. D. 全部都是3. D. 所有都是4. D. 全部都是第3页/共3页。
课题一生活中常见的盐一、几种常见的盐盐:解离出金属离子(或铵根离子)和酸根离子的化合物。
大多数盐溶液呈中性,pH=7。
盐=金属离子 + 酸根离子或盐= NH4+ + 酸根离子1.氯化钠( NaCl食盐的主要成分水溶液pH=7)⑴物理性质:白色固体、易溶于水、咸味。
⑵区别:工业盐NaNO2 ≠食盐NaCl NaNO2有毒不能食用。
⑶用途:调味品,每天约需3~5g;配制生理盐水,其溶质质量分数约为0.9%;农业上用氯化钠溶液来选种;腌渍蔬菜、鱼、肉、蛋;可作融雪剂消除公路积雪。
通电重要的工业原料 2NaCl + 2H2O = 2NaOH + H2↑+ Cl2↑。
⑷氯化钠在自然界中分布很广,除海水里含有大量氯化钠外,盐湖、盐井和盐矿也是氯化钠的来源。
步骤玻璃棒的作用①取样、称量②溶解搅拌、加速溶解③过滤引流④蒸发搅拌,防止因局部温度过高,造成液滴飞溅⑤转移转移固体⑥计算产率蒸发所需仪器:蒸发皿、铁架台、酒精灯、玻璃棒等仪器。
⑹粗盐提纯注意点①蒸发皿中的液体体积不超过其容积的2/3。
防止加热时液体外溢。
②蒸发皿加热时不需要垫石棉网。
本实验石棉网的作用是实验结束后将热的蒸发皿摆放在石棉网上,防止烫坏试验台。
③当蒸发皿中有较多固体出现时,停止加热,利用蒸发皿的余热将剩余的水分蒸干。
目的:节约能源。
④产率= m精盐÷ m粗盐×100%2.碳酸钙(CaCO3大理石、石灰石、水垢的主要成分)⑴物理性质:白色固体、难溶于水。
⑵用途:实验室(工业)制取CO2 ;重要的建筑材料;补钙剂;烧制生石灰。
3.碳酸钠(Na2CO3 纯碱、口碱、苏打水溶液呈碱性)侯氏(侯德榜)制碱法:纯碱Na2CO3及氮肥。
冬天捞碱Na2CO3,夏天晒盐NaCl。
⑴物理性质:白色粉末状固体、易溶于水。
⑵用途:重要的工业原料广泛用于玻璃、造纸、纺织和洗涤剂的生产等;食品工业发酵粉的次要成分;纯碱制烧碱。
★纯碱水溶液呈碱性,但是纯碱不是碱,纯碱是盐。
第十一单元盐化肥课题1 生活中常见的盐知识点1:氯化钠氯化钠(NaCl)易错警示盐是一类化合物的总称,不是仅指食盐,如把工业用盐(如NaNO2)误作食盐,会使人中毒。
拓展延伸人体内所含的氯化钠大部分以离子形式存在于体液中。
钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。
人们每天要摄入适量的食盐以满足人体的正常需要,但如果长期摄入过量食盐会引起高血压、冠心病等疾病。
【例1】关于氯化钠的叙述错误的是( )A.氯化钠易溶于水B. B.0.9 %的氯化钠溶液常用作医疗上的生理盐水C.人们每天要消耗氯化钠,因此氯化钠摄入越多越有利于健康D.氯化钠能融雪是因为其溶液的凝固点比水低知识点2:碳酸钠和碳酸氢钠Na2CO3、NaHCO3的性质及用途比较见表1:物质碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)俗称纯碱、苏打小苏打物理性质白色固体,易溶于水;碳酸钠晶体中含有结晶水,化学式为Na2CO3·10H2O白色固体,易溶于水化学性质(1)与酸反应:Na2CO3 +2HCl2NaCl+H2O+CO2↑(2)与某些碱反应:Ca(OH)2+Na2CO3CaCO3↓+2NaOH(注:此反应用于工业上制取氢氧化钠)(1)与酸反应:NaHCO3+HCl NaCl+CO2↑+H2O(2)受热分解:2NaHCO3Na2CO3+CO2↑+H2O用途用于玻璃、造纸、纺织、洗涤剂的生产(1)发酵粉的主要成分(2)治疗胃酸过多症的一种药剂【例2】按图1装置进行实验,气球中装有相同质量的Na2CO3与NaHCO3,试管中装有相同质量分数的足量的稀盐酸,把两种药品同时倒入试管中,请回答下列问题:图1(1)Na2CO3俗称,它与盐酸反应的化学方程式为。
(2)反应过程中气球膨胀的快慢:甲(填“>”、“<”或“=”,下同)乙,反应完全后气球膨胀的大小:甲乙。
第十一单元盐化肥课题1 生活中常见的盐一、盐:金属离子(或铵根离子NH4+)与氯离子(Cl-)、硫酸根离子(SO42-)、碳酸根离子(CO32-)、硝酸根离子(NO3-)、碳酸氢根离子(HCO3-)等构成的化合物。
如氯化钠NaCl。
(一)食盐、纯碱、小苏打、碳酸钙等盐在日常生活中的用途。
1、食盐(氯化钠NaCl)的用途:重要的调味品。
人的正常生理活动所必需的物质。
医疗上的生理盐水。
腌渍蔬菜、鱼、肉、蛋等――风味独特并可延长保存时间。
消除公路上的积雪。
工业用盐如亚硝酸钠(NaNO2)误作食盐用于烹调会引起中毒。
2、碳酸钠Na2CO3(俗名纯碱、苏打)的用途:用于玻璃、造纸、纺织和洗涤剂的生产等。
用于焙制糕点。
Na2CO3+2HCl==2NaCl+H2O+CO2↑3、碳酸钙CaCO3(俗名大理石或石灰石)用于建筑业。
用于作补钙剂。
4、碳酸氢钠NaHCO3(俗名小苏打)的用途:发酵粉以及治疗胃酸(HCl)过多的一种药剂。
NaHCO3+HCl==NaCl+H2O+CO2↑二、复分解反应:1、复分解反应定义:由两种化合物互相交换成分,生成另外两种化合物的反应叫复分解反应。
如:Na2CO3 + Ca(OH)2 ==CaCO3↓+2NaOH2、复分解反应发生的条件:只有两种化合物互相交换成分,生成物中有气体、沉淀或水生成时,复分解反应才能发生。
(1)常见的有气体生成的复分解反应:①含CO32-的盐+ 酸(H+)→ CO2↑如:CaCO3 + 2HCl ==CaCl2 + H2O + CO2↑②含HCO3-的盐+ 酸(H+)→ CO2↑如:NaHCO3 + HCl==NaCl+H2O+CO2↑③含NH4+的盐+碱(OH-)→ NH3↑如:NH4Cl + NaOH == NaCl + H2O + NH3↑(2)复分解反应中常见的沉淀:三、我国制碱工业的先驱-----侯德榜。
侯德榜先生发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法)。
九年级化学下册“第十一单元盐化肥”必背知识点一、盐的概念及性质1. 盐的定义:盐是由金属离子 (或铵根离子)和酸根离子组成的化合物。
例如,氯化钠 (NaCl)、碳酸钠 (Na₂CO₂)等。
2. 盐的分类:根据阳离子分类:钠盐、钾盐、铵盐等。
根据阴离子分类:硫酸盐、碳酸盐、碳酸氢盐等。
根据溶解性分类:可溶性盐、难溶性盐、微溶盐。
3. 盐的化学性质:复分解反应:两种化合物相互交换成分,生成两种新的化合物的反应。
其条件为生成物中有沉淀、气体或水生成。
碳酸盐的化学性质:能与酸反应生成气体 (二氧化碳),并用于检验碳酸盐。
二、常见的盐及其用途1. 氯化钠(食盐):物理性质:白色粉末,水溶液有咸味,溶解度受温度影响不大。
用途:调味品、腌制咸菜、消除积雪、农业上选种、制生理盐水等。
2. 碳酸钠(纯碱、苏打):用途:制玻璃、造纸、纺织、洗涤剂等。
3. 碳酸氢钠(小苏打):用途:焙制糕点的发酵粉、治疗胃酸过多。
化学性质:不稳定,受热易分解。
4. 碳酸钙:用途:建筑材料、补钙剂、实验室制取二氧化碳的原料。
三、化肥的分类及作用1. 氮肥:定义:以氮素为主要养分的肥料。
作用:促进作物的茎叶生长,使叶色浓绿。
常见氮肥:尿素、氨水、碳酸氢铵、氯化铵、硝酸铵等。
注意事项:铵态氮肥不能与碱性物质混合使用,否则易失去肥效。
2. 磷肥:定义:以磷素为主要养分的肥料。
作用:促进植物根系发达,穗粒增多,饱满。
常见磷肥:磷矿粉、钙镁磷肥、过磷酸钙等。
注意事项:过磷酸钙不能与碱性物质混合施用。
3. 钾肥:定义:以钾素为主要养分的肥料。
作用:促进作物生长健壮、茎杆粗硬,增强抗倒伏能力。
常见钾肥:氯化钾、硫酸钾、草木灰等。
4. 复合肥:定义:同时含有两种或两种以上的营养元素的化肥。
作用:能同时满足作物对多种营养元素的需求。
常见复合肥:硝酸钾、磷酸二氢钾、磷酸铵等。
四、化肥的施用与影响1. 施用原则:根据作物的需求和土壤的养分状况,合理选择肥料种类和施肥量。
人教版2023初中化学九年级化学下册第十一单元盐化肥常考点单选题1、下列物质由离子构成的是()A.氦气B.水C.氯化钠D.金刚石答案:CA、氦气属于稀有气体单质,是由氦原子直接构成的,故A不正确;B、水是由非金属元素组成的化合物,是由水分子构成的,故B不正确;C、氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,故C正确;D、金刚石属于固态非金属单质,是由碳原子直接构成的,故D不正确。
故选C。
2、小明家种的水稻,出现了倒伏现象。
据此,应该施用的化肥是()A.NH4H2PO4B.K2SO4C.CO(NH2)2D.Ca3(PO4)2答案:B分析:田里的水稻出现了倒伏现象,说明土壤缺乏钾元素,应施用含钾元素的化肥。
A、NH4H2PO4中含有氮元素和磷元素,不符合要求,此选项不符合题意;B、K2SO4中含有钾元素,符合要求,此选项符合题意;C、CO(NH2)2中含有氮元素,不符合要求,此选项不符合题意;D、Ca3(PO4)2中含有磷元素,不符合要求,此选项不符合题意。
故选B。
3、下列离子能在pH=1的无色溶液中大量共存的是()A.Cu2+、SO42-、Cl-、Na+B.OH-、K+、NO3-、Ba2+C.Mg2+、SO42-、Al3+、NO3-D.Na+、CO32-、Ca2+、Cl-答案:CA、铜离子在溶液里是蓝色的,不符合题意,A错。
B、pH=1的无色溶液中含有氢离子,氢离子和氢氧根离子生成水,不共存,B错。
C、Mg2+、SO42-、Al3+、NO3-不能生成气体沉淀和水,能共存,C符合题意。
D、pH=1的无色溶液中含有氢离子,氢离子和碳酸根离子生成水和二氧化碳,不共存,碳酸根离子和钙离子生成碳酸钙沉淀,不共存,D错。
故选:C。
4、小深同学用思维导图梳理了Na2CO3的相关知识,其中描述错误的是()A.AB.BC.CD.D答案:AA、碳酸钠俗称纯碱或苏打,不是烧碱,烧碱是氢氧化钠的俗称,描述错误符合题意;B、碳酸钠是白色固体,描述正确不符合题意;C、碳酸钠和稀盐酸反应,生成氯化钠二氧化碳和水,和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,和氯化钙反应生成碳酸钙沉淀和氯化钠,描述正确不符合题意;D、碳酸钠可用于玻璃、洗涤剂的生产,描述正确不符合题意。
阴离子OH -NO -3Cl -SO 2-4CO 2-3阳离子41 3 3 4 盐、化肥课题 1 生活中常见的盐1. 盐〔 〕盐:由金属离子〔或NH + 〕和酸根离子构成的化合物。
常见的盐有:食盐〔主要成4分是 NaCl 〕、碳酸钠〔Na 2CO ,俗称纯碱、苏打〕、碳酸氢钠〔NaHCO ,俗称小苏打〕、高 锰酸钾〔KMnO 〕、石灰石和大理石的主要成分碳酸钙〔CaCO 〕等。
3〔2〕酸、碱、盐的溶解性〔室温〕H + 溶、挥 溶、挥 溶 溶、挥NH +溶、挥溶溶溶溶K +溶溶溶溶溶 Na +溶溶溶溶溶Ba 2+溶溶溶不不 Ca 2+微溶溶微不Mg 2+不溶溶溶微Al 3+不溶溶溶— Mn 2+不溶溶溶不Zn 2+不溶溶溶不 Fe 2+不溶溶溶不Fe 3+不溶溶溶— Cu 2+不溶溶溶 —Ag +—溶不微不“溶”表示那种物质可溶于水;“不”表示不溶于水;“微”表示微溶于水;“挥”表示挥发性;“—”表示那种物质不存在或遇到水就分解了。
2.氯化钠〔NaCl〕(1)氯化钠在常温下是白色固体,有咸味,易溶于水,溶解度受温度影响较小,是食盐的主要成分。
氯化钠在自然界中分布很广,除海水里含有大量氯化钠外,盐湖、盐井和盐矿也是氯化钠的来源。
(2)氯化钠的作用①氯化钠是重要的调味品;②人体内所含的氯化钠大局部以离子形式存在于体液中;③钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用;④人们每天都要摄入一些食盐来补充由于出汗、排尿等而排出的氯化钠,以满足人体的正常需要〔每人每天约需3g~5g食盐〕,但长期食用过多食盐不利于人体安康。
(3)氯化钠的用途:①医疗上用来配制生理盐水;②农业上用氯化钠溶液来选种;③工业上,氯化钠用于制取某些化工产品〔碳酸钠、氢氧化钠、氯气和盐酸等〕;④生活中,氯化钠用来调味、腌制食品;⑤交通运输中,氯化钠可用作除雪剂除去道路积雪。
人教版九年级化学第十一单元盐和化肥知识点
1、氯化钠:NaCl,食盐的主要成分
物性:白色粉末状固体易溶于水
用途:①、重要的调味品,②、医疗上配制生理盐水,③、农业上配制溶液选种,
④、工业上作重要原材料,制取Na₂CO₃、NaOH、Cl₂、HCl等
⑤、生活中腌制蔬菜、水果、肉类
⑥、交通方面,用NaCl除积雪。
(其他可溶性盐也具有这种性质,但要注意环保)。
2、粗盐:含有可溶性NaCl、MgCl₂、CaCl₂,也含难溶性固体:如泥沙。
粗盐提纯方法:溶解→沉淀(反应或静置或吸附)→过滤→蒸发→结晶。
3、①名称:碳酸钠②化学式:Na₂CO₃③俗称:纯碱、苏打④物性:白色粉末状固体易溶于水⑤用途:工业原料,广泛用于玻璃、造纸、纺织和洗涤剂生产等
4、①名称:碳酸钙②化学式:CaCO₃③主要成份:大理石,石灰石、鸡蛋壳、贝壳
④物性:白色粉末状固体,难溶于水⑤用途:建筑材料、补钙剂、摩擦剂等。
5、①名称:碳酸氢钠②化学式:NaHCO₃③俗称:小苏打④物性:白色粉末状固体、可溶于水⑤、用途:发酵粉主要成分之一,医疗上治疗胃酸过多症,除去浓硫酸清洗后的残留液。
6、碳酸钠与稀盐酸反应
现象:反应剧烈,有气泡产生,生成气体能使澄清石灰水变浑浊。
反应原理:Na₂CO₃+2HCl=2NaCl+CO₂↑+H20
7、碳酸氢钠与稀盐酸反应
现象:反应剧烈,有气泡产生,生成气体能使澄清石灰水变浑浊。
反应原理:NaHCO₃+HCl=NaCl+CO₂↑+H₂O
8、CO32-、HCO3-的鉴定方法
①药品:稀盐酸、澄清石灰水
②方法:取样,向待测样品中加入过量的稀盐酸,将产生的气体通入澄清石灰水中,如果出现白色浑浊,则证明待测样品中含有CO32-或HCO3-。
9、Na₂CO₃与Ca(OH)₂反应
现象:溶液中有白色沉淀生成
原理:Na₂CO₃+Ca(OH)₂=CaCO₃↓+2NaOH.
10、Na₂CO₃与BaCl₂反应
现象:溶液中有白色沉淀生成
原理:Na2CO₃+BaCl₂=BaCO₃↓+2NaCl
11、CuS04与Fe反应
现象:在铁的表面析出红色物质,溶液由蓝色变为浅绿色。
原理:Fe+CuSO₄=FeSO₄+Cu
12、盐的化性:①能与较活泼金属发生置换反应。
②能与酸发生复分解反应
③能与碱发生复分解反应④能与盐发生复分解反应
13、四种基本反应类型
①、化合反应②、分解反应
③、置换反应④、复分解反应
14、复分解反应定义:两种化合物互相交换成分,生成另外两种化合物的反应,其中反应物和生成物都是化合物,且各元化合价不变。
AB+CD=AC+BD
15、复分解反应条件:
①、反应物和生成物必须是两种化合物。
②、反应物有酸时,另一反应物可溶于水或不溶于水,但一定要溶于酸。
③、反应物无酸时,两种反应物必须要溶于水。
④、反应物一般是酸、碱、盐、金属氧化物两两之间的相互反应。
⑤、生成物中必须要有水或气体或沉淀。
16、常见酸碱盐溶解性情况
①初中阶段,酸一般认为可溶于水。
②碱中有铵、钾、钠、钡可溶,钙微溶,其他一般不溶(AgOH不稳定,容易分解,不存在)
③盐中:a、铵、钾、钠、硝酸盐全溶。
b,氯化物中只有AgCl不溶,其他全溶。
c、硫酸盐中,钡盐(BaSO₄)不溶,CaSO4,Ag₂SO₄微溶,其他硫酸盐可溶。
d、碳酸盐中,铵、钾、钠可溶,镁盐微溶,钙钡不溶。
17、沉淀颜色
①白色不溶于水,但溶于酸的沉淀:CaCO₃、BaCO₃、Mg(OH)₂,Al(OH)₃
②白色不溶于水,也不溶于酸的沉淀:AgCl,BaSO4
③红褐色不溶于水,但能溶于酸沉淀:Fe(OH)₃
④蓝色不溶于水,但能溶于酸沉淀Cu (OH)₂
18、复分解反应及其应用
①离子是否共存.
离子间反应生成气体或沉淀或水不能共存,常见不能共存组合有:
a、OH-与H⁺、NH₄+、Mg²+、Fe²⁺、Fe³⁺、Cu2+、Ag+不能共存。
b、H⁺与OH-、CO32-、HCO3-.不能共存
c、CO32-与H+\Ca2+\Ba2+不能共存。
d、Ag+与Cl-或OH-,Ba2+与SO42-\CO32-不能共存。
19、农业上,肥料分为农家肥,化肥。
20、化肥有氮肥、磷肥、钾肥、复合肥。
21、氮肥的作用:促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量,缺氮会造成叶色变黄。
22、磷肥的作用:促进作物生长,增强作物的抗寒、抗旱能力。
23、钾肥的作用:促进作物生长,增强抗病虫害、抗倒伏能力。
24、氮肥、钾肥、磷肥的鉴别
①外观:氮肥和钾肥为白色晶体,磷肥为灰白色粉末。
②气味:
③水溶性:氮肥和钾盐能金部溶于水,磷肥绝大部分不溶于水
④加入熟石灰混合研磨:若有刺激性气味放出的是铵态氮肥,若没有刺激性气味放出的是钾肥。
为什么铵态氮肥(铵盐)不能与碱性物质(如草木灰、熟石灰等)混合施用?因为,二者混合会发生反应生成氨气逸走,降低肥效。
25、铵盐(含NH₄+的盐)的鉴定方法:a,方法|(干态):取样与熟石灰混合研磨,若有刺激性气味产生,且生成气体能使湿润红色石蕊试纸变蓝,说明样品中含NH4⁺。
b、方法2(湿态)、取少量样品配成溶液与氢氧化钠溶液混合加热,若有刺激性气味产生,且生成气体能使湿润红色石蕊试纸变蓝,说明样品中含NH4+。
26、物质除杂:将物质中含有少量杂质除去,可以利用物理或化学方法除去,除杂原则是除杂时不能将本物质除去,同时不能引入新杂质。
27、物质鉴别(区分、区别):利用物理或化学方法对物质进行鉴别。
物理方法有:颜色,状态、气味、熔点、沸点、硬度、密度、水溶性,溶解时吸热或放热,挥发性等。
化学方法有:主要利用物质与物质间的反应过程中表现出来明显特征现象进行区分。
例如反应有气体或特征沉淀生成。
28、关于NaOH的变质情况分析:氢氧化钠在空气中首先吸收水蒸气而潮解,然后吸收空气中的CO2,反应变质原理:2NaOH+CO₂=Na₂CO₃+H20。
因此,NaOH在空气中可能部分变质或全部变质,必须密封保存。
29、粗盐中难溶性杂质去除方法:①溶解②过滤③蒸发
a、溶解时,玻璃棒作用:搅拌,加速溶解。
b、过滤时,玻璃棒作用:引流作用。
C、蒸发时,玻璃棒作用:搅拌,使液体均匀受热,以防飞溅。
△待蒸发皿出现较多固体时,停止加热。
利用余热使滤液蒸干。
转移固体时,也用玻璃棒。
30、常见离子鉴定方法。
①、Ca ²+的鉴定方法:取少量溶液于试管中加入Na₂CO₃溶液,若有白色沉淀产生,证明溶液中含有Ca2+。
②、Mg²+或Al3+的鉴定方法:取少量溶液于试管中,加入NaOH溶液,若有白色沉淀产生,证明溶液中含有Mg²+或Al³⁺。
③、Fe²⁺的溶液是浅绿色,加NaOH有白色沉淀产生。
④、Fe3+的鉴定方法:
a、含Fe³⁺的溶液是黄色。
b、取少量溶液于试管中,加入NaOH溶液若有红褐色沉淀产生,说明溶液中含有Fe³⁺。
⑤、H⁺的鉴定方法
(利用酸的五种化性鉴别)
a、用酸碱指示剂、pH试纸,蓝色石蕊试纸
b、用较活泼金属:Mg、Al、Zn、Fe等
c、用某些金属氧化物:CuO、Fe₂O₃等,CuO+H₂SO₄=CuSO₄+H₂O;
Fe₂O₃+3H₂SO₄=Fe₂(SO₄)₃+3H₂O
d、用某些难溶性碱:Fe(OH)₃,Cu(OH)₂
Fe(OH)₃+3HCl=FeCl₃+3H20
Cu(OH)₂+2HCl=CuCl₂+2H₂O
e、用某些盐:Na₂CO₃.或NaHCO₃
Na₂CO₃+2HCl=2NaCl+CO₂↑+H₂O
NaHCO₃+HCl=NaCl+CO₂↑+H₂O
⑥、Cu²⁺的鉴定方法
a、含Cu²+的溶液是蓝色。
b、用NaOH溶液,具体方法:取少量溶液于试管中,加入NaOH溶液,若有蓝色沉淀产生,则说明溶液中含有Cu2+。
⑦、Ag⁺的鉴定方法:
取少量溶液于试管中,加入NaCl和稀硝酸的混合液,如果有白色沉淀产生,则说明溶液中含有Ag⁺。
⑧、Ba²⁺的鉴定方法:
方法1:用Na₂CO₃溶液
方法2:用Na₂SO₄溶液
⑨、NH₄⁺的鉴定方法:
方法:用熟石灰或者NaOH溶液。
⑩、OH-的鉴定方法:
方法1、用酸碱指示剂、PH试纸等等;方法2,用含Cu ²+或Fe³⁺的溶液
⑪、CO₃2⁺的鉴定用含H⁺\Ca2⁺或Ba2⁺溶液
⑫、HCO₃-的鉴定方法:用酸
⑬、SO42-的鉴定用Ba²+溶液鉴定。
其中Cl-的鉴定方法:用Ag+和稀硝酸的混合液;MnO4-的鉴定方法:初中主要看颜色(溶液为紫红色)。